1) Calcolare il pH di una soluzione ottenuta mescolando volumi uguali di cloridrato di glicina
(HOOC−CH2−NH3+Cl- ) 0.1 M e di NaOH 0.1 M (pKa1=2.35, pKa2=9.78).
A) 9.81
B) 8.43
C) 6.06
D) 10.7
1. Soluzione
la glicina è un aminoacido che possiede 2 atomi di H di cui uno carbossilico ed uno sull’NH2(che forma NH3+)in ambiente acido come indicato nel testo. L’aggiunta di NaOH neutralizza l’ H+ che si trova sul carbossile (pKa1 2,35).
Si forma uno ione dipolare detto Zwitterione che è la specie predominante al pH corrispondente al punto isoelettrico. Il punto isoelettrico è il valore di pH al quale l’amminoacido esiste nella forma zwitterionica:
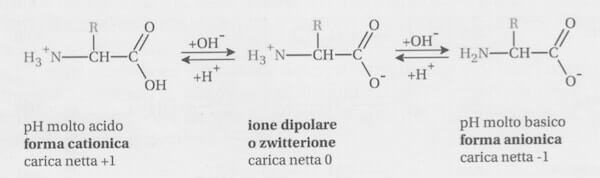
Nella glicina R = H.
Per aggiunta di ulteriore NaOH si neutralizza l’ H sull’NH3.
Lo ione dipolare esiste al punto isoelettrico cioè a quel valore di PH in cui PKa1+PKa2 /2 cioè un valore medio rispetto al PK delle due strutture estreme. Pertanto:
PH= Punto Isoelettrico = (pKa1 + pKa2)/2 = (2,35 + 9,78)/2 = 6,06.
risposta corretta C
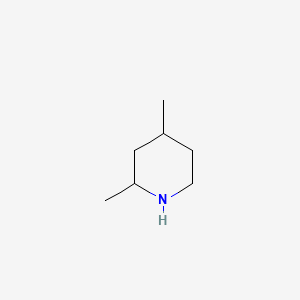
2) Indicare il numero di stereoisomeri della 2,4-lupetidina (2,4-dimetil-piperidina)
A) 2
B) 4
C) 3
D) 1
soluzione
Nella molecola vi sono 2 centri chirali cioè i due atomi di C in posizione 1 e 3. Sapendo che i possibili stereoisomeri sono 2n dove n = numero centri chirali allora si ha
Numero stereoisomeri possibili = 22 = 4
risposta corretta B
3) Dei seguenti composti, derivati dell’acido acetico, qual è il corretto ordine di reattività crescente in reazioni di idrolisi?
A) acetammide < anidride acetica < cloruro di acetile < acetato di etile.
B) acetammide < cloruro di acetile < acetato di etile < anidride acetica.
C) anidride acetica < cloruro di acetile < acetato di etile < acetammide.
D) acetammide < acetato di etile < anidride acetica < cloruro di acetile.
soluzione
Il cloruro di acetile

è il più reattivo a causa dell’azione attrattiva del cloro e repulsiva del gruppo CH3- e viene usato per aggiungere facilmente l’acetile (CH3CO-) ad altre molecole organiche. L’anidride acetica serve anch’essa per acetilare altre molecole però la reattività è minore del cloruro di acetile perchè in questo caso vi è l’azione del solo CH3-

L’acetato di etile
![]()
reagisce meno dell’anidride acetica in quanto in questo caso l’azione di CH3CH2- è minore rispetto al CH3-
L’acetammide
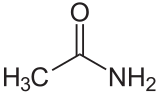
Le ammidi non hanno caratteristiche basiche, in quanto il loro doppietto dell’azoto è parzialmente delocalizzato, il che rende meno facile l’acetilazione.
L’ordine richiesto è quindi acetammide < acetato di etile < anidride acetica < cloruro di acetile.
Si deduce che la risposta è D
4) Quale dei seguenti sistemi può essere considerato in uno stato di equilibrio?
A) un bicchiere contenente una soluzione acquosa di glucosio esposto all’aria
B) un matraccio tappato contenente una soluzione acquosa di glucosio e vapore acqueo
C) una soluzione di glucosio in acqua dentro un matraccio tappato, agitata per mezzo di
un’ancoretta magnetica
D) una soluzione di glucosio in acqua dentro un matraccio tappato, a contatto con una fonte di
calore
soluzione
Nel caso A la soluzione non è in equilibrio in quanto le molecole di acqua passano allo stato di vapore non essendo un recipiente chiuso.
La soluzione B è invece in equilibrio essendo contenuta in un recipiente chiuso.
Nella soluzione C invece pur essendo il recipiente chiuso, l’agitazione dovuta all’ ancoretta magnetica produce calore per cui la soluzione non risulta essere all’equilibrio come anche la soluzione D in cui il calore fornito dal riscaldatore ne altera l’equilibrio.
La risposta corretta è B
5) A e B sono due soluzioni acquose di KCl, rispettivamente 0.2 M e 0.05 M. Se le due soluzioni,
alla stessa temperatura, sono separate da una membrana semipermeabile al solvente, avverrà
che:
A) il KCl migrerà dalla soluzione B ad A
B) il KCl migrerà dalla soluzione A a B
C) il KCl non migrerà
D) il solvente migrerà dalla soluzione A a B
soluzione
Le membrane semipermeabili permettono il passaggio del solo solvente e non del sale. Poichè le due soluzioni tendono a raggiungere l’equilibrio di concentrazione allora il solvente passerà attraverso la membrana, dalla soluzione che contiene più solvente ( quella più diluita) a quella che ne contiene di meno (quella più concentrata) cioè da B ad A mentre KCl non migra.
La risposta al quesito è C
6) Secondo la teoria VSEPR, una geometria quadrato-planare deriva dalla presenza sull’atomo
centrale di:
A) due coppie di legame e quattro coppie di non legame
B) quattro coppie di legame e una coppia di non legame
C) quattro coppie di legame e nessuna coppia di non legame
D) quattro coppie di legame e due coppie di non legame
soluzione
Secondo il metodo AXE utilizzato per attribuire una struttura spaziale alle molecole secondo la teoria VESPR sappiamo che AX4 è tetraedrica AX4E è ad altalena AX4E2 è Planare quadrata: E rappresenta il numero di coppie elettroniche di non legame mentre X rappresenta i legandi.

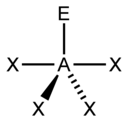

si deduce che la risposta corretta è D cioè 4 legandi e 2 coppie di non legame
7) Indicare la risposta corretta:
A) tutte le reazioni esotermiche sono spontanee
B) tutti i processi spontanei sono esotermici
C) i processi endotermici non sono mai spontanei
D) nessuna delle precedenti
soluzione
Un processo spontaneo è un processo in cui il sistema rilascia energia sotto forma di Energia libera ΔG (spesso sotto forma di calore ) e si sposta ad uno stato energetico più basso, più stabile.
Basta ricordare che un processo spontaneo hanno un ΔG < 0 e poichè sappiamo che
ΔG = ΔH ‒ TΔS
affinché la reazione sia spontanea, la variazione di energia libera di Gibbs deve essere negativa, pertanto:
- Se ΔS>0 e ΔH<0, il processo è sempre spontaneo e quello opposto mai;
- Se ΔS>0 e ΔH>0, il processo è spontaneo solo ad alte temperature (quindi l’esotermicità della reazione ha poca rilevanza);
- Se ΔS<0 e ΔH<0, il processo è spontaneo solo a basse temperature (quindi l’esotermicità della reazione è molto importante);
- Se ΔS<0 e ΔH>0, il processo non è mai spontaneo e quello opposto sempre;
Questo indica che le risposte A,B,C sono errate e la risposta corretta al quesito è D
8) Indicare il gruppo funzionale a cui appartiene il carbonio 1 del seguente monosaccaride (gli
atomi di idrogeno legati ai carboni sono stati omessi).
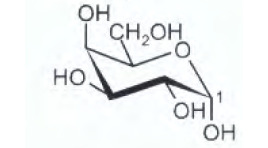
A) Etere
B) Alcol
C) Emiacetale
D) Estere
soluzione
L’atomo di C indicato fa parte di un gruppo che si chama emiacetale , infatti il gruppo aldeidico legato al C in esame reagisce con il gruppo alcolico della stessa molecolae che è legato al C immediatamente vicino al gruppo CH2OH formando l’emiacetale :
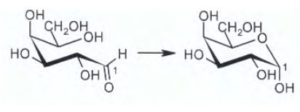
cioè si forma un composto ciclico con struttura a sedia.
risposta corretta C
9) La reazione di sintesi dell’ammoniaca è esotermica: 3 H2(g) + N2(g) → 2 NH3(g)
Indicare come si può agire sul sistema in modo da determinare un aumento della quantità di
NH3 all’equilibrio.
A) innalzamento della temperatura
B) addizione di un catalizzatore
C) innalzamento della pressione
D) aumento del volume del reattore
soluzione
Per avere le idee più chiare riscriviamo la reazione comprendente anche il calore Q che si sviluppa :
3 H2(g) + N2(g) <=> 2 NH3(g) + Q
trattiamo Q come s si trattasse di un composto. Per la legge di Gouldeberg Waage se aumentiamo Q la reazione si sposta verso sinistra quindi la risposta A è da scartare.
Se aggiungiamo un catalizzatore la reazione avviene più velocemente ma le quantità non cambiano perchè il catalizzatore agisce sull’energia di attivazione e quindi cambia solo la velocità con cui si formano i prodotti e non interviene sul valore di ΔG (in un equilibrio chimico ΔG = 0). La risposta B è da scartare.
Nel caso di un equilibrio chimico un aumento di pressione produce uno spostamento dell’equilibrio dalla perte in cui vi è minor numero di molecole ed in questo caso le molecole iniziali sono 4 e quelle finali 2 quindi l’equilibrio si sposta a destra.
L’aumento di volume non sposta l’equilibrio.
La risposta corretta è C
10) Indicare l’affermazione ERRATA tra le seguenti.
A) una molecola è polare se la somma vettoriale dei momenti di dipolo in essa contenuti è diversa
da zero
B) condizione necessaria ma non sufficiente affinché una molecola sia polare è la presenza in essa
di legami covalenti polari
C) una molecola ABn è sempre polare se l’atomo centrale A presenta coppie solitarie
D) se in una molecola sono presenti solo legami covalenti apolari, la molecola sarà sicuramente
apolare
soluzione
Le affermazioni A,B,D sono corrette mentre non è corretta l’affermazione C. Infatti se le coppie solitarie sono asimmetriche le molecole possono essere polari mentre se le coppie solitarie sono simmetriche non modificano il vettore polarità della molecola come per esempio si osserva in molecole planari quadrate o lineari.
11) Date le capacità termiche molari dell’acqua liquida e gassosa (rispettivamente 75 e 36 /Kmol, considerate indipendenti dalla temperatura), la capacità termica molare dell’acqua all’ebollizione (1 atm e 100 °C) risulta:
A) 75 J K-1 mol-1
B) 36 J K-1 mol-1
C) infinita
D) 39 J K-1 mol-1
soluzione
Ricordiamo che la capacità termica è C = Q/ ΔT.
Quando si ha l’ebollizione, cioè nei passaggi di stato liquido-vapore (o anche in una trasformazione solido liquido) la temperatura rimane costante in quanto tutto il calore fornito serve per aumentare l’energia interna delle molecole. Questo significa che C = Q/ o = ∞
risposta corretta C
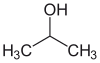
12) Indicare qual è il prodotto di ossidazione del 2-metil-2-pentanolo
A) 2-pentanone
B) 2-metilpentanale
C) 2-metil-3-pentanone
D) non si ossida
soluzione
Il 2-metil-2- pentanolo ha la seguente struttura ed è un alcool terziario (legato ad un atomo di C a sua volta legeto a 3 atomi di C)
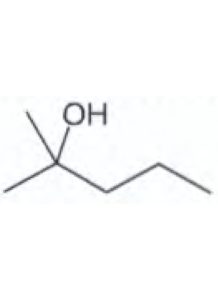
è evidente che non avendo atomi di H disponibili legati al C che porta l’OH il composto non potrà mai formare il doppio legame C=O per cui non può essere ossidato e non può formare nè un’aldeide nè un chetone per cui la risposta corretta è D.
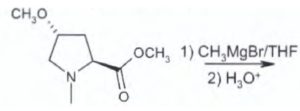
13) Indicare il composto che si ottiene dalla seguente reazione:
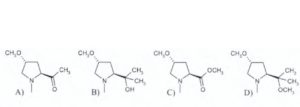 A) 1
A) 1
B) 2
C) 3
D) 4
soluzione
Si tratta di una reazione di formazione di un alcol terziario dall’attacco sull’estere del reattivo di Grignard ( si nelimina CH3O per sostituirlo con CH3-) e si forma il corrispondente chetone A che reagisce ulteriormente con il reattivo di Grignard e si aggiunge un altro CH3- ed in presenza di H+ trasforma il CO in COH e si forma l’alcol terziario.
Risposta corretta B
14) Calcolare quante moli di KMnO4 sono necessarie per ossidare 0,10 moli di alcol etilico,secondo
la reazione (da bilanciare):
CH3CH2OH(aq) + MnO4-(aq) + H+(aq) → Mn2+(aq) + CO2(g) + H2O(l)
A) 5,7
B) 0,98
C) 0,24
D) 3,7
soluzione
il n.o. del C dell’alcol è -1 (2 legami con H quindi -2 ed 1 legame con -OH +1)quindi +1 -2= -1)
Il C quindi si ossida a CO2 cioè ad un C con n.o. +4
pertanto la prima semireazione è:
5[CH3CH2OH + 12 e +→ 2 CO2
12[MnO4- +5e + 8 H+ → Mn+2 + 4H2O
———————————————————-
5 CH3CH2OH + 12 MnO4‒ + 36 H+ → 12 Mn2+ + 10 CO2 + 33 H2O
se per ossidare 12 moli di alcol occorrono 5 moli di permanganato allora per 0,1 moli occorreranno X moli di KMnO4
5:12 = 0,1 :X X = 0,1 x 12/5 = 0,24 moli
Risposta corretta C
15) Una bevanda analcolica contenente fruttosio e saccarosio è analizzata mediante HPLC, con
colonna di silice derivatizzata con gruppi amminici e fase mobile acetonitrile/acqua (80:20 v/v).
Indicare il tipo di rivelatore da utilizzare.
A) Rivelatore UV-VIS
B) Rivelatore ad indice di rifrazione
C) Rivelatore fluorimetrico
D) Rivelatore conduttimetrico
soluzione
Le soluzioni di fruttosio e saccarosio non sono fluorescenti, non conducono la corrente (non essendo ioni), non assorbono all’UV e sono distinguibili solo con un rivelatore ad indice di rifrazione.
Risposta corretta B
16) Sulla base dei potenziali elettrodici standard, trattando il cromo metallico con un eccesso di
HCl 1M, cosa si può prevedere che accada?
Cr3+(aq) +3e-→ Cr(s) (E0=0,74V)
Cr2O72-(aq) +14H+(aq) +6e-→ 2Cr3+(aq) +7H2O(l) (E0=1,33V)
H+(aq) +e-→ ½H2(g) (E0=0V).
A) si forma Cr3+ e Cr2O72-
B) si forma solo Cr3+
C) si forma solo Cr2O72-
D) non succede nulla.
soluzione
Sappiamo che l’elemento o gruppo che possiede un E° più elevato (più positivo o meno elettronegativo) agisce sempre da ossidante . Nelle razioni date dal quesito vediamo che E° per l’ H ha un valore più grande del Cr ( zero per l’idrogeno e -0,74 per il Cr metallico ) quindi l’idrogeno ossida il cromo a Cr+3
risposta corretta B
17) La temperatura critica di una sostanza pura è:
A) la temperatura al di sotto della quale il gas non può essere liquefatto agendo unicamente sulla
pressione.
B) la temperatura al di sopra della quale il gas non può essere liquefatto agendo unicamente sulla
pressione.
C) la temperatura di equilibrio tra le tre fasi
D) nessuna delle precedenti
soluzione
Il grafico che rappresenta gli stati di una sostanza in funzione di temperatura e pressione ha la seguente forma:
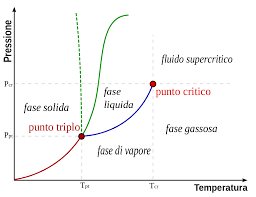
La temperatura critica di una sostanza pura (che nel grafico sopra è indicata con Tc) è la temperatura al di sopra della quale il gas non può essere liquefatto per semplice compressione perché si ottiene un fluido supercritico cioè una sostanza che ha la densità di un liquido, ma si comporta come un gas.
Risposta corretta B
18) Quale tipo di legame si instaura nei nucleosidi tra il ribosio (o deossiribosio) e la base
azotata?
A) Il carbonio anomerico dello zucchero è unito a un atomo di azoto della base azotata con legame
-N-glicosidico
B) Il carbonio anomerico dello zucchero è unito a un atomo di azoto della base azotata con legame
-N-glicosidico
C) Il carbonio anomerico dello zucchero è unito a un atomo di carbonio della base azotata
D) Il carbonio anomerico dello zucchero è unito tramite un atomo di ossigeno alla base azotata con
legame -glicosidico
soluzione
I nucleosidi sono composti chimici costituiti da un pentoso (D-Ribosio oppure 2-deossi D-Ribosio) e da una base azotatataa purinica (adenina, guanina) o pirimidinica (citosina, uracile, timina) unite per mezzo di un legame β-glucosidico.


adenosina deossiadenosina
nucleosidi si formano grazie ad una reazione di condensazione tra lo zucchero e la base azotata: si forma un legame β-N- glicosidico tra il carbonio-1′ dello zucchero e tra il gruppo amminico in posizione 1 di una pirimidina o con il gruppo amminico in posizione 9 di una purina .
Risposta corretta A
19) L’acetaldeide reagisce con il 2-metil-1,3-propandiolo e catalisi acida formando due acetali
isomeri, di cui uno è il prodotto principale.
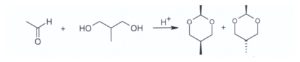
Scegliere l’affermazione corretta tra quelle riportate sotto:
A) I due acetali sono chirali e l’isomero trans è il prodotto principale
BI due acetali sono achirali e l’isomero trans è il prodotto principale
C) L’isomero trans è chirale e l’isomero cis è il prodotto principale
D) L’effetto elettronico degli ossigeni nel ciclo fa prevalere l’isomero trans
soluzione
La chiralità è la proprietà di un oggetto rigido di essere non sovrapponibile alla sua immagine speculare. Un atomo di carbonio è chirale quando è legato a quattro sostituenti diversi. L’atomo di carbonio centrale al quale sono legati i quattro sostituenti diversi è detto centro stereogenico o stereocentro. La reazione data nel quesito porta ad un prodotto achirale quindi ambedue gli acetali sono achirali e l’isomero trans è il prodotto principale perché i sostituenti CH3 si trovano nella posizione equatoriale che è la più stabile.
risposta corretta B
20) Il naftalene dà facilmente le reazioni di sostituzione elettrofila aromatica e la posizione più
reattiva è la posizione 1. Qual è la ragione di questa evidenza?
A) L’intermedio formato nella reazione con attacco in posizione 1 è stabilizzato da più strutture di
risonanza.
B) Pur essendo stabilizzato dallo stesso numero di strutture di risonanza, l’intermedio formato
nella reazione con attacco in posizione 1 è rappresentato da strutture più stabili.
C) La regioselettività è governata dagli effetti sterici
D) L’attacco alla posizione 2 potrebbe favorire la perdita dell’aromaticità del naftalene.
soluzione
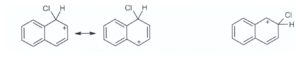
Il naftalene reagisce sulla posizione 1 perché l’intermedio che si forma, pur essendo stabilizzato dallo stesso numero di strutture di risonanza di quello con attacco in posizione 2, può contare su 2 forme limite che conservano l’aromaticità nel secondo anello e che quindi sono più stabili.
risposta corretta B
21) Completare in modo corretto la frase che segue. I lantanidi sono:
A) un insieme di 14 elementi e in essi si ha il riempimento progressivo dell’orbitale 4d
B) un insieme di 10 elementi e in essi si ha il riempimento progressivo dell’orbitale 4d
C) un insieme di 10 elementi e in essi si ha il riempimento progressivo dell’orbitale 4f
D) un insieme di 14 elementi e in essi si ha il riempimento progressivo dell’orbitale 4f
soluzione
La serie dei lantanoidi (in passato chiamati lantanidi, termine coniato da Victor Moritz Goldschmidt nel 1925) è costituita dai 15 elementi chimici, che sulla tavola periodica si trovano fra il lantanio e afnio. Essi hanno numero atomico compreso fra 57 e 71 (estremi inclusi). Essi costituiscono, insieme a Scandio ed Ittrio le cosiddette Terre Rare.
Nei lantanoidi (spesso indicati con il simbolo Ln) gli orbitali atomici 4f sono parzialmente o completamente riempiti, mentre gli orbitali p e d, più esterni, restano ancora vuoti. Visto lo scarso effetto degli orbitali f sulle proprietà chimiche di un elemento rispetto agli orbitali s, p e d, tutti i lantanoidi mostrano sostanzialmente lo stesso comportamento e le stesse proprietà, rendendo molto difficile una loro separazione per via chimico-fisica.
D’altra parte gli orbitali f conferiscono loro una serie di proprietà magnetiche e ottiche molto interessanti: il Samario è molto usato in lega con il cobalto per fabbricare magneti permanenti mentre l’erbio viene sfruttato da drogante per le fibre ottiche allo scopo di renderle attive, cioè capaci di amplificare il segnale luminoso che le attraversa direttamente.
I lantanoidi sono pertanto 14 elementi i cui orbitali 4f vengono riempiti progressivamente e la risposta corretta è D
22) Indicare quale, tra queste quaterne di numeri, contiene numeri di ossidazione possibili per
l’ossigeno:
A) +2, 0, −2, −3
B) +3, +2, 0, −1
C) 0, −1, −2, −4
D) +2, 0, −1, −2
soluzione
La risposta corretta è D in quanto l’ossigeno può formare ad esempio OF2 in cui il n.o. è + 2 o la molecola O2 in cui il n.o è zero mentre nell’H2O2 ha n.o. -1 ed in H2O ha n.o., -2
23) Indicare, sulla base della teoria VSEPR, quale coppia è costituita da specie planari:
A) CH3+ e XeF4
B) CH3 e CH3-
C) CH3 e XeF4
D) CH4 e XeF4
soluzione
Il catione CH3+ ha una struttura planare in quanto il C è ibrido SP2 e possiede un orbitale Pz contenente la carica positiva.Il carboanione ha invece una struttura tetraedrica in cui vi sono 4 ibridi SP3 uno dei quali contiene 2 elettroni disponibili. CH4 è tetraedrico. Xe F4 ha una struttura planare quadrata in cui 4 atomi di F si trovano sullo stesso piano. Si deducew che la risposta esatta è A
24) Indicare le strutture che rappresentano un estere e un’aldeide:


1 2 3 4
A) 1 e 2
B) 2 e 3
C) 3 e 4
D) 1 e 4
soluzione
Un estere è un prodotto di reazione tra un acido carbossilico ed un alcol ( ROH ). L’attacco avviene sull’OH che viene sostituito da RO.
Un’aldeide è un composto che contiene il gruppo H-C=O .
La risposta corretta è B
Un’aldeide è un carbonile che da un lato lega un gruppo alchilico e dall’altro un
idrogeno.
25) Indicare il composto più solubile tra i solidi seguenti (considerando solo l’equilibrio di
solubilità):
A) SrSO4 (Kps=2.8·10-7)
B) CaSO4·H2O (Kps=2.4·10-5)
C) Ag2SO4 (Kps=1.7·10-5)
D) PbSO4 (Kps=1.8·10-8)
soluzione
Per i composti CaSO4, PbSO4, SrSO4 la solubilità è calcolabile da Kps= S x S = S2
Per il composto Ag2SO4 è invece calcolabila da Kps= (2S)2 x S = 4S3
Pertanto per CaSO4 S= √2,4 x 10-5 = 4,9 x 10-3 moli/l
per PbSO4 S = √1,8 x 10-8 = 1,3 x 10-4 moli/l
Per SrSO4 S = √2,8 x 10-7 = 5,3 x 10 -4 moli/l
Per Ag2SO4 S = 3√1,7 x 10-5 = 2,6 x 10-2 moli /l
Concludiamo dicendo che Ag2SO4 è il sale più solubile perchè in soluzione si trova una maggior quantità si ioni .
risposta corretta C
26) Una reazione avente legge cinetica v=k[A]2[B] si dice
A) di ordine 2 rispetto ad A, di ordine 1 rispetto a B e complessivamente di ordine 2
B) di ordine 1 rispetto ad A, di ordine 2 rispetto a B, e complessivamente di ordine 3
C) di ordine 2 rispetto ad A, di ordine 1 rispetto a B, e complessivamente di ordine 3
D) di ordine 3 rispetto ad A, di ordine 1 rispetto a B, e complessivamente di ordine 2
soluzione
In chimica, l’ordine di reazione relativo ad un reagente è l’esponente al quale è elevata la concentrazione del reagente nell’equazione cinetica.Nel caso specifico la rezione è di ordine 2 rispetto ad A e di ordine 1 rispetto a B . Per la reazione complessiva l’ordine di reazione è dato dalla somma degli ordini di reazione dei composti che partecipano alla reazione, in questo caso 2+1 =3
La risposta corretta è C
27) Due sostanze hanno formula rispettivamente Cu5FeS4 e Cu2S. Indicare quale tra queste
affermazioni è CORRETTA.
A) le due sostanze contengono la stessa percentuale in peso di rame
B) la percentuale in peso di rame è maggiore in Cu5FeS4
C) la percentuale in peso di rame è maggiore in Cu2S
D) la percentuale in peso di rame in Cu5FeS4 è 2,5 volte quella di Cu2S
soluzione
Per rispondere al quesito occorre calcolare la % di Cu in ognuno dei composti.
Cu5FeS4 PM= 501,6 g/mol. La % di Cu è quindi calcolata dalla proporzione Cu5FeS4 :5Cu = 100 :X
X= 5 ∙ 63,55 x 100 /501,6 = 63%
PM Cu2S = 159,1 g/mol. La % di Cu è calcolata dalla proporzioneCu2S :2Cu= 100 :X
X= 2 ∙ 63,55 x 100 /159,1 = 80%.
si deduce che la risposta corretta è C
28) Quale delle seguenti condizioni è necessaria affinché si verifichi una collisione tra molecole
che sia efficace per una reazione chimica:
I) Orientazione favorevole delle molecole nell’urto
II) Energia cinetica sufficiente
III) Elevato ΔH di reazione
A) Condizione I
B) Condizioni I e II
C) Condizioni II e III
D) Le tre condizioni
soluzione
In una reazione chimica esistono fattori che influiscono sulla velocità delle reazione. Nel recipiente in cui avviene una reazione il numero degli urti tra le molecole dei reagenti cresce all’aumentare del numero di particelle presenti per unità di volume, cioè all’aumentare della concentrazione dei reagenti stessi.
Perché due sostanze reagiscano non basta che le loro molecole si urtino, ma è anche necessario che lo facciano nel modo giusto.Infatti nella formazione di un legame covalente ed essendo quello covalente un legame direzionale, è necessario che l’urto coinvolga proprio quegli orbitali che sovrapponendosi danno luogo al legame stesso. Solo gli urti di quest’ultimo tipo, che si dicono pertanto urti efficaci, daranno luogo al legame, e quindi alla reazione, mentre se le molecole si urtano nel modo sbagliato la reazione non ha luogo. In una reazione chimica per passare dallo stato iniziale a quello finale,cioè quando dai reagenti si formano i prodotti che sono contraddistinti da un livello di stabilità maggiore, si deve superare un dosso energetico, corrispondente ad uno stadio di transizione nel quale gli atomi dei reagenti sono pressoché liberi da ogni legame: l’energia richiesta per superare questo ostacolo è proprio l’energia di attivazione .
Il ΔH quindi non ha alcuna relazione col numero di urti quindi possiamo dire che le condizioni perchè vi sia un numero di collisioni sufficiente in una reazione dipendono dalla direzionalità e quindi dalla geometria dei reagenti e dall’energgia di attivazione.
La risposta corretta è B
29) Indicare l’ordine di legame Cl-O nella formula di risonanza più stabile dello ione ClO4-
A) 1
B) 1,25
C) 1,75
D) 1,5
soluzione
l’ordine di legame è un indice della forza del legame chimico tra due atomi, ed è definito come la semidifferenza tra il numero di elettroni leganti e il numero di elettroni antileganti. Cioè o.l. = elttroni leganti-elettroni antileganti /2
Nello ione ClO4- i 3 atomi di ossigeno formano 3 doppi legami ed un legame semplice
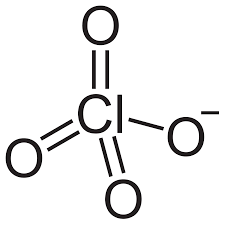
quindi gli elettroni di legame sono 6+1=7 e poichè ogni atomo di O possiede 1 elettrone antilegante ed essendo i 4 atomi di ossigeno equivalenti si ha che il numero di elettroni antileganti nella molecola sono 4 pertanto:
o.l. = 7/4 =1,75
risposta corretta C
30) Indicare quale delle seguenti affermazioni è esatta:
A) Una miscela racemica può essere risolta tramite distillazione frazionata
B) Una miscela racemica può essere risolta tramite cromatografia chirale
C) Una miscela racemica può essere risolta solo tramite cristallizzazione
D) Una miscela racemica non può essere risolta
soluzione
Una miscela racemica può essere risolta facendo interagire i due enantiomeri con una sostanza chirale. Questo avviene in una cromatografia, se la fase stazionaria è chirale, perché i due enantiomeri interagiscono in modo diverso con la fase stazionaria chirale e uno dei due è più trattenuto. (Risposta B)
Una miscela racemica si può risolvere anche formando un sale con una sostanza chirale, in questo modo si formano due sali diastereoisomeri che si possono separare per cristallizzazione frazionata. La risposta C, però, dice “solo tramite cristallizzazione”, mentre abbiamo visto che esistono altri metodi.
Un’altra tecnica utilizzabile consiste nel preparare un derivato, per esempio un estere, e poi idrolizzarlo con unenzima che riconosca solo il derivato di uno dei due enantiomeri
31) La cisteina e’un amminoacido che, nella sua forma protonata, presenta tre costanti acide:
Ka1= 10-1.70, Ka2=10-8.36, Ka3 =10-10.8. Indicare a quali gruppi funzionali possono essere attribuite.
+H3N CH CCH2OHOSH
A) Ka1: COOH , Ka2:NH3+, Ka3:SH
B) Ka1: NH3+, Ka2: COOH , Ka3: SH
C) Ka1: COOH , Ka2: SH , Ka3: NH3+
D) Ka1: SH , Ka2: COOH, Ka3: NH3+
soluzione
Per semplicitò pKa
pKa1 = 1,7 pKa2 = 8,36 pKa3 = 10,8.
Il primo (1,7) è sicuramente relativo al gruppo COOH che è il più acido.
Occorre adesso stabilire quale tra il gruppo SH e NH4+ è il gruppo più acido. Per questo calcoliamo il PKa dell’H2S e di NH4+ :
Ka di H2S è 1,0 ∙10‒7 per cui pKa= 7.
La Kb di NH3 è 1,8 ∙10‒5 per cui pKb = 4,75. E quindi pKa di NH4+ = 14 ‒ 4,75 = 9,3.
Da questi valori di PKa vediamo che H2S è più acido dello ione ammonio, pertanto possiamo dire che pKa2 (8,36) si riferisca a SH e pKa3 (10,8) a NH3+
Risposta corretta C
32) Un certo sistema chiuso, in cui non avvengono reazioni chimiche, viene portato da uno stato iniziale 1 a uno finale 2 mediante un processo che non prevede svolgimento di alcun lavoro. Quale delle seguenti affermazioni è vera?
A) Il calore scambiato nel processo non dipende dall’effettivo percorso seguito
B) Il calore scambiato nel processo dipende dall’effettivo percorso seguito
C) Il calore scambiato è nullo
D) Nessuna delle precedenti
soluzione
Il primo principio della termodinamica è : ΔE = Q ‒ L. Se il lavoro è nullo, L=0 e quindi si ha: ΔE= Q. Cioè il calore Q scambiato corrisponde alla variazione di energia interna ΔE. Sappiamo inoltre che l’energia (E) è una funzione di stato e quindi non dipende dal tipo di percorso seguito per raggiungere lo stato finale, ed essendo ΔE= Q anche per Q in queste condizioni (cioè quando L=0) possiamo dire che il valore non dipende dalla modalità con cui si raggiunge lo stato finale e pertanto la eisposta corretta è A .
33) Utilizzando la teoria VSEPR, prevedere quale tra le seguenti coppie di molecole è apolare.
A) SO2 e XeF2
B) H2O e XeF2
C) CO2 e H2O
D) CO2 e XeF2
soluzione
sappiamo che sia H2O che SO2 dono molecole polari il che ci permette di escludere le risposte A,B,C.
Sappiamo inoltre che O=C=O è anch’essa apolare perchè i 2 vettori polari C–>O hanno valore di modulo uguale ma verso opposto quindi il vettore risultante ha modulo 0. Analogo discorso può essere fatto per XeF2 anch’essa con vettori polari di verso opposto come CO2.
La risposta corretta è D
34) Calcolare il prodotto di solubilità di Bi2S3, sapendo che a 25°C la sua solubilità è uguale a
10−15 M. (Si consideri solo l’equilibrio di solubilità, trascurando tutti gli equilibri acido-base)
A) 8,4 × 10–70
B) 1,1 × 10–73
C) 5,2 × 10–33
D) 9,6 × 10−55
soluzione
La reazione di dissociazione è: Bi2S3 → 2 Bi3+ + 3 S2‒
da questa si evince che :
Kps = [Bi3+]2[S2‒]3= (2s)2(3s)3= 4s2∙ 27s3= 108 s5
ma s= 10‒15
Kps = 108 (10‒15)5 = 108 ∙10‒75 = 1,1 ∙10‒73
La risposta corretta è B
35) Indicare quale delle seguenti affermazioni è errata.
A) Nelle forme meso è sempre presente solo uno stereocentro
B) Nelle forme meso esiste un piano di simmetria
C) Le forme meso sono molecole achirali
D) Enantiomeri e diasteroisomeri coesistono con la forma meso
soluzione
Un composto meso è un composto la cui molecola contiene più stereocentri cioè più atomi chirali, ma nel suo complesso, a causa dell’esistenza di un piano di simmetria interno, risulta otticamente inattivo. Tale genere di composto presenta tipicamente degli stereoisomeri che tra loro sono enantiomeri. Alcune forme meso si possono riconoscere, per esempio, perché i sostituenti legati agli atomi chirali sono gli stessi e si trovano secondo la proiezione di Fisher dallo stesso lato della molecola. A differenza di un racemo che è una miscela equimolecolare di una coppia di enantiomeri e quindi separabili, un composto meso è un composto puro che non presenta attività ottica e le parti otticamente attive non sono separabili.
Da quanto sopra la risposta errata è A
36) Determinare la formula minima del composto costituito dal 47,97% di zinco e dal 52,03% di cloro.
A) ZnCl
B) ZnCl2
C) Zn2Cl3
D) Zn2Cl
soluzione
Le moli di zinco su 100 g sono: 47,97/65,38 = 0,7337 mol.
Moli di cloro su 100 g: 52,03/35,45 = 1,468 mol.
Dividendo per il valore più piccolo si ottiene: Zn (0,7337/0,7337 = 1); Cl (1,468/0,7337 = 2). La formula minima è quindi ZnCl2.
risposta corretta B
37) Si è trovato che la reazione elementare A→prodotti segue una cinetica del primo ordine.
Cosa è possibile presumere sul suo meccanismo di reazione?
A) La reazione decorre a causa di una instabilità intrinseca di A
B) La reazione decorre a causa degli urti tra le molecole di A e quelle dei prodotti
C) La reazione decorre a causa degli urti tra le molecole di A
D) nessuna delle precedenti
soluzione
La reazione decorre a causa di una instabilità intrinseca di A. Se dipendesse dagli urti di A con A dipenderebbe da [A]2 e non sarebbe più del primo ordine.
Risposta corretta A
38) Quanti grammi di NaF occorre aggiungere a 0,50 L di una soluzione acquosa di HF 0,05 M per ottenere una soluzione con pH=3,14 ? La costante di ionizzazione acida di HF = 7,2×10-4
A) 2,10
B) 1,05
C) 3,15
D) 6,20
soluzione
Il pKadi HF è: pKa= ‒log Ka= ‒log 7,2 ∙10‒4= 3,14.
In una soluzione tampone
pH = pKa ‒log [HA]/[A‒]
Da cui log [HA]/[A‒] = pKa ‒ pH = 3,14 ‒ 3,14 = 0 quindi: [HA] = [A‒] cioè la concentrazione di NaF deve essere 0,05 M. Le moli da aggiungere sono moli = C ∙ V = 0,05 ∙ 0,5 = 0,025 mol.
La massa molare di NaF è: 23 + 19 = 42 g/mol. La massa di NaF è: 42 ∙ 0,025 = 1,05 g.
Risposta corretta B
39) Il grado di dissociazione di un acido debole HA in una sua soluzione è il 20%. Di quante volte bisogna aumentare il volume di tale soluzione, aggiungendo acqua, perchè il grado di
dissociazione diventi 50%?
A) 2 volte
B) 4 volte
C) 10 volte
D) 3,5 volte
soluzione
La reazione di dissociazione è: HA → H++ A‒Mol/L iniziali C Mol/L finali C(1‒a) Ca Ca Ka
= [H+] [A‒]/[ HA] = C2 a2/C(1‒a) = C a2/(1‒a)
Con a = 0,2 si ha: Ka = C1 0,22/0,8 = 0,05 C1. Con a = 0,5 si ha: Ka= C2 0,52 /0,5 = 0,5 C2. Dato che Ka è la stessa si ottiene: 0,05 C1 = 0, 5 C2 e quindi C1 = (0,5/0,05) C2 = 10 C2. Risposta corretta C
40) Quale dei seguenti metalli presenta una configurazione elettronica con l’orbitale d
completo?
A) Fe
B) Cu
C) Ni
D) Co
soluzione
ferro Ar 3d6 4s2
cobalto Ar 3d7 4s2
nikel Ar 3d8 4s2
rame Ar 3d10 4s1
Fe, Co, Ni riempiono gli orbitali 3d accoppiando gli elettroni e la loro configurazione è rispettivamente 4s23d6, 4s23d7, 4s23d8
Il successivo elettrone del Cu arriverebbe alla situazione 4s2 3d9 tuttavia la maggior stabilità viene data dal riempimento di tutti gli orbitali d (3d10) lasciando un solo elettrone in 4s dato dal 4s un elettrone si sposta sul d il che fornisce al rimanente elettrone 4s una schermatura di 10 elettroni d La configurazione del rame è quindi 4s1 3d10
Risposta corretta B