TITOLO DELLE SOLUZIONI E TITOLAZIONE ACIDO BASE
Il titolo di una soluzione non è altro che la sua concentrazione; dire che una soluzione di HCl ha titolo 0,1 M significa che la sua concentrazione è di 0,1 moli / litro.
Le soluzioni a titolo noto sono impiegate per effettuare l’analisi chimica quantitativa cioè servono per misurare le quantità di una sostanza contenuta in una soluzione. Poiché in questo tipo di analisi si usano volumi di liquido a titolo noto, l’analisi è detta ANALISI VOLUMETRICA.
L’ANALISI VOLUMETRICA può essere di diverso tipo a seconda delle reazioni utilizzate:
Acidimetria e Alcalimetria
quando si utilizza una reazione tra un acido ed una base con formazione di sale detta anche neutralizzazione
acidimetria: se si deve misurare la quantità di una base utilizzando acidi standard
alcalimetria : se si deve misurare la quantità di un acido utilizzando una base standard
Ossidimetria
Se si utilizzano reazioni REDOX che coinvolgono variazioni del numero di ossidazione o trasferimento di elettroni fra i reagenti
Complessometria
Se si utilizzano reazioni di formazione di sali complessi, che si basano sulla combinazione di ioni per formare uno ione o un composto poco solubile ad esempio:
- titolazione di una soluzione di un cianuro con nitrato di argento
- titolazione con EDTA per la misura del Calcio in una soluzione
Precipitometria
Se si utilizzano reazioni di precipitazione cioè reazione tra ioni che formano un un precipitato cioè un solido che si deposita sul fondo del recipiente.
Quando si usa Ag+ come reattivo titolante( come ad esempio nell’analisi dei cloruri) il metodo prende il nome di Argentometria.
TITOLAZIONE PER NEUTRALIZZAZIONE ACIDO BASE
In questo caso si utilizzano come reagenti SOLUZIONI STANDARD di acidi o basi, cioè acidi forti quali HCl, HClO4 e H2SO4 (da usare con cautela se concentrati o a caldo),HNO3 (ossidante) oppure basi forti quali NaOH, KOH, Ba(OH)2.
Come possiamo preparare in laboratorio una soluzione di un acido o di una base standard?
- Per diluizione
- Quando si diluisce una sostanza a titolo noto : in questo caso si ottengono soluzioni a concentrazione perfettamente nota
- Quando si diluisce una sostanza non a titolo noto. Si ottiene una concentrazione approssimata che deve essere standarizzata con una sostanza a titolo noto
- PER PESATA DIRETTA Se si parte da sostanze NON madri le soluzioni che si ottengono avranno titolo approssimato quindi è necessario standardizzarle successivamente con uno standard primario.
- se si parte da sostanze madri, si possono ottenere soluzioni a titolo perfettamente noto che vengono definite soluzioni di STANDARD PRIMARI
Perché una sostanza possa essere SOSTANZA MADRE deve :
1-Possedere un elevato grado di purezza (99,98%).
2-Reagire con la sostanza da titolare secondo un stechiometria ben definita
3-Avere un peso molecolare sufficientemente elevato, per rendere minimo l’errore di pesata.
4-Non essere ossidabile dall’ossigeno atmosferico.
5-Non essere igroscopica e non essere efflorescente (non perdere l’acqua detta di cristallizzazione).
E’ evidente che le sostanze con queste caratteristiche non siano proprio molte e quelle più usate sono:
metalli: rame, zinco e ferro.
Ossidi: HgO e ZnO
Acidi: acido ossalico (H2C2O4 x 2H2O) e ftalato acido di potassio (KHC8H4O4)
Sali: carbonato di sodio, tetraborato di sodio . 10 H2O, cloruro di sodio, bicromato di potassio, nitrato d’argento, bromato di potassio e iodato di potassio.
COME PREPARARE UNA SOLUZIONE STANDARD DI NaOH 0,1 M
USANDO COME SOSTANZA MADRE FTALATO ACIDO DI POTASSIO
l’ idrossido di sodio, essendo un solido di colore bianco fortemente igroscopico non è una sostanza madre per cui dopo aver preparato per pesata una soluzione a molarità approssimata dobbiamo standardizzarlo con una sostanza acida che è lo ftalato acido di potassio (KHC8H4O4)-. La quantità da pesare è calcolata ricordando che il PM = 40 gr e per avere una soluzione 0,1 moli in 1000 ml occorre pesare 4 gr e scioglierli in 1 litro di acqua. Pertanto la concentrazione approssimata è effettuata pesando 4 g di sostanza che si portano in soluzione in un beker da 250 mL utilizzando il minimo d’acqua necessaria. Si trasferisce la soluzione in un matraccio da litro, si lava più volte il beker versando sempre il liquido nel matraccio ed infine, si lascia la soluzione a T ambiente e poi si porta a volume. La standardizzazione avviene utilizzando uno standard primario :lo ftalato acido di potassio (KHC8H4O4)
L’idrossido di sodio reagisce con ftalato acido di potassio (KHC8H4O4) in un rapporto 1 mole: 1 mole :
NaOH + KHC8H4O4 ——> C8H4O42- + K+ + Na+
CALCOLO DELLA SOSTANZA MADRE DA PESARE
Per calcolare quanto ftalato occorre pesare, è necessario ricordare che la maggior precisione si ha ripetendo almeno 3 volte l’analisi del campione di ftalato e si utilizza la formula
m = Molarità x Volume di NaOH x PESO MOL. ftalato x RAPPORTO DI DILUIZIONE x RAPPORTO STECHIOMETRICO DI REAZIONE
Per il calcolo ipotizziamo di usare 30-40 ml di NaOH che dovrà essere 0,1 M . Il rapporto di diluizione che dovrà avere lo ftalato si ottiene considerando che usiamo per 3 titolazioni 25 ml di ftalato che preleviamo da un matraccio da 100 ml quindi dovrà essere 4 volte più concentrata e che il rapporto stechiometrico della reazione è 1:1. Pertanto
(0,1×0,030) x 204,22 x 4 x 1 =2,4506 g
(M xV litri ) x PM ftalato x fatt.dil. x rapporto stech. di reaz. = quantità da pesare
Ricordiamo che la pesata deve essere ripetuta più volte sino a peso costante lasciando sempre la sostanza nell’essiccatore e ripesando.
La quantità pesata di ftalato 2,4506 g si scioglie in un matraccio da 100 ml .
Procedimento: ( ripetere la titolazione per tre volte)
a. prelevare un aliquota esatta di 25 mL e trasferirli in una beuta da 250 mL, aggiungere un po’ d’acqua distillata, circa 100 mL.
b. Aggiungere 7-8 gocce di indicatore (fenolftaleina)
c. Riempire la buretta con 50 ml di soluzione di NaOH, dopo aver lavato la buretta con la stessa soluzione.
d. Titolare fino a viraggio della soluzione da incolore a rosa persistente.
e. Leggere il volume di soda usato considerando 2 cifre decimali
se i volumi di NaOH usati nelle tre titolazioni sono V1 V2 e V3 si calcola il volume medio (V1+V2+V3 )/ 3
la normalità dell’NaOH si calcola ricordando che al punto di equivalenza le moli di NaOH hanno reagito con tutte le moli di ftalato, cioè
Volume per Molarità della NaOH = volume x Molarità di ftalato
2,4506 / 204,22 =0,1199 moli queste moli sono state sciolte in 100 ml quindi la Molarità dello Ftalato è
100 :0,1199 = 1000 : X X= 0,1199 x 1000 /100 M= 0,1199
perciò 25 ml x 0,1199= moli diftalato
se per la reazione con Ftalato sono stati usati ad es 29,4 ml di NaOH allora la Molarità di NaOH è data da:
25 x 0,1199 = 29,4 x M da cui M = 25 x 0,1199/ 29,4 = 0,101
La Molarità di NaOH è quindi 0,101 M
CALCOLO DI UNA CURVA DI TITOLAZIONE
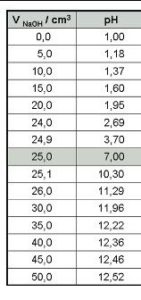
Supponiamo adesso di voler seguire l’andamento del PH quando si fa reagire 25 ml di NaOH 0,1 M con HCl 0,1 M.
Prima di aggiungere l’ NaOH, il PH della soluzione è PH= -log [H+] = -log [H+]= -log 10⁻¹ =1 essendo 0,1 la Molarità di HCl.
supponiamo di aggiungere 5 ml di NaOH 0,1 M a 25 ml di HCl 0,1 M e calcoliamo il nuovo PH:
le moli di NaOH usate sono date da Volume x Molarità cioè 5x 0,1 = 0,5 millimoli (essendo il volume espresso in millilitri)
0,5 mmoli di NaOH hanno perciò reagito con 0,5 mmoli di HCl. le moli inizial di HCl erano 25 x 0,1 = 2,5 mmoli
pertanto dopo l’aggiunta di 0,5 mmoli saranno rimaste 2,5 – 0,5 = 2 mmoli di HCl in un volume dato dalla somma ei volumi V1=25 ml e V2 = 5ml cioè 30 ml . La nuova [H+] è quindi
[H+] = 2,5- 0,5 / 25+5 = 2 / 30 =0,066 = 6,6 x 10⁻²
PH = -log [H+] = -log 6,6 x 10⁻² = 2- 0,81 = 1,18
se aggiungiamo 10 ml NaOH =0,1 M avremo 1 mmole di base che consuma 1 mmole di acido quindi rimangono
2,5 moli -1 = 1,5 mmoli in un volume totale di 35 ml perciò la nuova molarità è
1 mmole rimasta / 35 =0,028 quindi [H+] = 2,8 x 10⁻² PH = 2- 0,45 =1, 54
se aggiungiamo 15 ml di NaOH 0,1 M 15 x 0,1 mmoli avranno reagito con l’acido perciò l’acido rimasto è
2,5- 1,5 =1 mmole in un volume pari a 25+15 =40 ml di soluzione per cui [H+]= 1/40 = 0,025 =2,5 x 10⁻²
PH = -log 2,5 x 10⁻²= 2-log 2,5 = 2-0,39 =1,61
se aggiungiamo 20 ml di NaOH 0,1M avremo 2 mmoli di NaoH che avranno reagito con 2 mmoli di acido per cui le moli di acido rimanenti sono 2,5-2 =0,5 mmoli in un volume di 45 ml perciò [H+]= 0,5 /45 = 1,1 x 10⁻²
PH = 2-log 1,1= 0,041 = 1,96
se aggiungiamo 25 ml di NaOH 0,1 M ai 25 ml di HCl 0,1, le mmoli di acido avranno reagito tutte con le mmoli di NaOH ed in soluzione [H+] =[OH-] per cui PH =7
infatti [H+] = moli di [H+] che provengono dalla dissociazione dell’acqua cioè [H+]= 10⁻⁷ moli/l
se aggiungiamo 26 ml di NaOH 0,1 M allora vi saranno 2,6-2,5 mmoli in più di NaOH per cui il PH è da calcolare dopo aver calcolato [OH-]
avremo infatti [OH-] = 2,6-2,5 mmoli / 51 ml = 1,9x 10⁻ᶾ
POH = -log1, 9 x 10⁻ᶾ = 3 – log1, 9= 3- 0,28 = 2,72
PH = 14- POH = 14- 2,72 =11,28
Notiamo che immediatamente dopo il punto di equivalenza (il punto in cui le moli o gli equivalenti di acido sono uguali a quelli della base ) il PH sale notevolmente.
Se adoperiamo 30 ml di NaOH 0,1 M avremo [OH-] = 30- 25 mmoli di NaOH in più / 55 = 9x 10⁻² da cui
POH = – log 9x 10⁻²= 2- log 9 = 2-0,95= 1,05
PH = 14- 1,05= 12,95
si può osservare che adesso l’aumento del PH non è più brusco e continua in modo graduale.
Se si mettono in grafico il PH sulle ordinate ed i ml di soda aggiunto sulle ascisse, otteniamo una curva detta
CURVA DI TITOLAZIONE ACIDO FORTE BASE FORTE.
DATI DELLA TITOLAZIONE
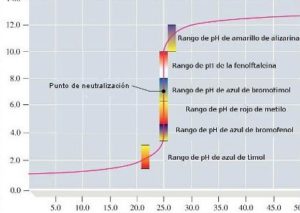
in questo grafico sono mostrati i vari indicatori di PH ed ovviamente sono da sceglier solo gli indicatori che cambiano colore in vicinanza del Punto di equivalenza (in questo caso PH 7). L’indicatore ottimale sarebbe il blu di Bromotimolo che cambia colore intorno al PH 7 ma viene spesso usata la fenolftaleina che cambia colore intorno a PH 9. Occorre aggiungere che l’indicatore cambia colore in un intervallo di PH di 2 unità e la fenolftaleina cambia colore quando il PH è 9 (da 8 a 10) per cui il punto di viraggio non coincide col punto di equivalenza (che è il punto di PH in cui tutto l’acido è neutralizzato dalla base e misurato con il calcolo sopra esposto)
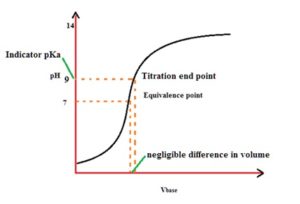
tuttavia, come si vede nel grafico, ad una grande differenza di PH tra il punto finale visivo della reazione con indicatore fenolftaleina ed il punto di equivalenza si ha una variazione di volume piccolissima che quindi è trascurabile.
In questo stesso blog puoi trovare alcuni video di you tube che ti mostrano come fare una titolazione in laboratorio
COSA SONO GLI INDICATORI?
sono acidi organici deboli o basi organiche deboli, la cui forma acida possiede un colore diverso da quello della forma basica
Un indicatore acido base viene genericamente indicato con HIn ed è come abbiamo detto, un acido debole perciò si dissocia in
HIn <====> H+ + In-
acido debole protone base coniugata dell’acido (forma basica)
colore A colore B
per questa dissociazione vi è un costante di equilibrio indicata con Kin perciò
Kin = [H+] [In-] / [HIn]
Kin =Kin = [H+] [In-] / [HIn]
l’occhio umano riesce a distinguere il colore A da quello B quando il colore A è 10 volte il colore B pertanto
Kin = Kin = [H+] [colore B ] / [colore B x 10 ]
quindi quando vediamo il colore A allora [H+] = KIn x 0,1
viceversa vediamo il colore B quando il colore B è 10 volte A
Kin = Kin = [H+] [ 10 x colore A] / [colore A ][H+] = KIn x 10
da cui nel primo caso si vede il colore A quando PH= PK +1
e nel secondo caso si vede il colore B quando PH = PK -1
queste due espressioni ci dicono che la variazione del colore non è netta ad un dato PH ma varia in un intervallo di PH di 2 unità. Questo intervallo di pH in cui l’indicatore cambia colore è detto
PH= PK +1
PH = PK -1 intervallo di viraggio dell’indicatore.
L’intervallo di viraggio di un indicatore viene misurato sperimentalmente tramite soluzioni tampone e questa tabella indica il PH di viraggio di alcuni indicatori
|
nome dello Indicatore |
Colore forma acida |
Colore forma basica |
Intervallo di viraggio |
pKin |
|
Blu timolo |
Rosso |
Giallo |
1.2-2.8 |
1.65 |
|
Giallo metile |
Rosso |
Giallo |
2.9-4.0 |
3.2 |
|
Metilarancio |
Rosso |
Giallo-arancio |
3.1-4.4 |
3.1 |
|
Blu bromofenolo |
Giallo |
Porpora |
3.0-4.6 |
4.1 |
|
Verde bromocresolo |
Giallo |
Blu |
3.8-5.4 |
4.9 |
|
Rosso metile |
Rosso |
Giallo |
4.2-6.2 |
5.0 |
|
Rosso clorofenolo |
Giallo |
Rosso |
4.8-6.4 |
6.25 |
|
Blu bromotimolo |
Giallo |
Blu |
6.0-7.6 |
7.30 |
|
Rosso fenolo |
Giallo |
Rosso |
6.4-8.0 |
8.0 |
|
Blu timolo |
Giallo |
Blu |
8.0-9.6 |
– |
|
Giallo alizarina |
Giallo |
Viola |
10.1-12.0 |
bisogna dire che in alcuni casi nessuno degli indicatori ha un punto di viraggio vicino al punto equivalente, tuttavia è possibile mescolare più indicatori o un indicatore con un colorante in modo da avere un punto di viraggio vicino al punto di equivalenza.
La scelta di un indicatore anziché un altro, viene effettuata ricordando che si sceglie l’indicatore che ha un PKin più vicino al PH di equivalenza.
Lascia un commento