Una volta accertata la presenza della particelle atomiche quali protoni elettroni e neutroni si pose il problema di come queste fossero disposte nell’atomo. La scoperta della radioattività e delle particelle alfa diede un contributo notevole alla ricerca sull’atomo. Infatti,si era accertato, da studi spettroscopici, che le particelle alfa altro non erano che atomi di Elio privati dei loro elettroni quindi si trattava di particelle piuttosto pesanti per le quali venne calcolata sia la carica sia la massa e ci si accorse che il rapporto carica / massa era 4820 unità elettromagnetiche, valore che era vicinissimo al valore trovato per l’elio pari a 4826. Si sapeva anche che le sostanze radioattive emettevano particelle alfa durante il loro decadimento. Tra gli elementi radioattivi che emettevano particelle alfa il più utilizzato negli esperimenti era il RADON o RADIO che aveva la caratteristica di emettere particelle alfa tutte con le stesse caratteristiche.
Geiger e Marsden effettuarono studi sperimentali della diffusione (o scattering) di particelle alfa attraverso sottilissimi strati metallici.L’esperimento di Geiger e Marsden (che fece comprendere dove fossero localizzati i protoni ed i neutroni in un atomo) venne effettuato nel 1908, sotto la guida di Ernest Rutherford. L’apparato sperimentale originario era costituito da una sorgente radioattiva, in questo caso il polonio che emette particelle alfa, e da uno schermo di piombo con una fenditura sottile che permetteva di ottenere un fascio di raggi alfa ben collimato che veniva indirizzato verso una sottile lamina di oro di circa o,o1 mm.
Geiger e Marsden osservarono che, anche se la maggior parte delle particelle attraversava il folgio metallico quasi in linea retta, alcune di esse – circa 1 su 8000 – erano fortemente deviate di un angolo maggiore di un angolo retto e venivano in seguito intercettati a diversi angoli da uno schermo di solfuro di zinco che è fluorescente nel punto in cui viene colpito dalle particelle cariche.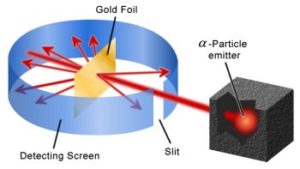
« E’ stato l’evento più incredibile della vita mia. Era come veder tornare indietro un proiettile da 15 pollici sparato contro un foglio di carta velina….” queste furono le parole di Rutherford riferendosi all’esperimento.
[embedyt] https://www.youtube.com/watch?v=ZTii46A-kaU[/embedyt]
La misura degli angoli di deflessione suggerì a Rutherford l’idea che l’atomo fosse sostanzialmente una struttura vuota e che la maggior parte della sua massa fosse concentrata in un punto che venne definito nucleo e che quindi era la sede delle cariche positive (protoni) e dei neutroni.
Infatti, quando le particelle alfa colpivano gli elettroni non venivano praticamente deviate mentre quando esse arrivavano in vicinanza del nucleo subivano una deviazione con una angolazione che dipendeva da quanto esse si avvicinassero al nucleo. Quando la particella alfa giungeva molto vicina al nucleo veniva addirittura riflessa.
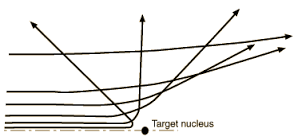
In conclusione, secondo l’esperimento di Rutherford l’atomo è composto da un nucleo centrale in cui sono concentrate la carica positiva e la massa dell’atomo ed il cui diametro che è intorno a a 10−15 m , ed è circa 100000 volte più piccolo del diametro dell’atomo che è dell’ordine di 10−10 m . Gli elettroni, secondo il modello di Ruthrford, si muovono intorno al nucleo simili a pianeti che ruotano attorno al sole e sono in numero tale da bilanciare la carica positiva del nucleo.
L’ipotesi di Rutherford, però, presentava un’ importante lacuna consistente nel fatto che secondo la fisica classica una particella in movimento come l’elettrone, dovrebbe emettere energia in modo continuo e quindi a poco a poco l’ energia dovrebbe diminuire sino ad annullarsi e l’elettrone dovrebbe,pertanto,cadere sul nucleo.Questo fenomeno, ovviamente, non è mai stato osservato.Non solo, se l’ atomo emettesse energia continuamente dovrebbe dare origine ad uno spettro a bande cioè ad uno spettro continuo come quello prodotto della luce bianca solare
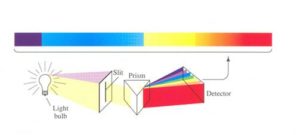
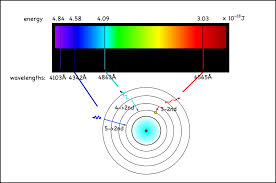
Quindi, non solo l’atomo non emette energia continuamente, per produrre uno spettro continuo, ma ,invece, produce uno SPETTRO A RIGHE ed ogni riga corrisponde ad una ben definita lunghezza d’onda.
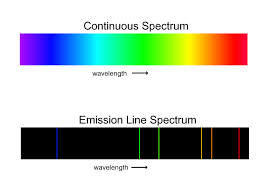
In definitiva, il modello di Rutherford pur rappresentando un notevole progresso nello studio dell’atomo, non riusciva, tuttavia, a dare una spiegazione agli spettri a righe (discontinui ) degli atomi, anche del più semplice di essi che è l’Idrogeno che presentava 4 righe spettrali visibili. In conclusione, era chiaro che la fisica classica non era in grado di fornire alcuna spiegazione sulle origini delle righe spettrali degli atomi.
LO SPETTRO DELL’ATOMO DI IDROGENO
Se le radiazioni provenienti da una lampada ad idrogeno venivano convogliate su un prisma si osservava su lastra fotografica posta dopo del prisma, uno spettro a righe, il più semplice di tutti gli spettri.
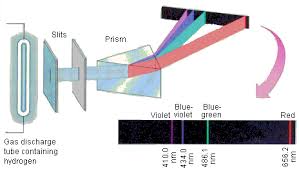
consistente in 4 righe spettrali.
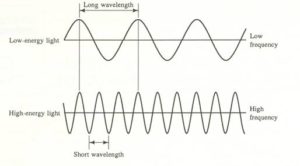
Ai tempi di Rutherford lo spettro dell’idrogeno era noto, e alcuni fisici erano stati anche in grado di trovare sperimentalmente alcune formule empiriche che riuscivano a fornire i valori delle lunghezze d’onda di quelle righe. Ogni radiazione luminosa,infatti, è energia radiante caratterizzata da un’onda la cui lunghezza si esprime con la lettera λ ed è la distanza che intercorre tra due punti di massimo di due onde successive e la frequenza è il numero di cicli che l’onda effettua in un secondo ed è espressa con la lettera ν . La luce con bassa energia ha una lughezza d’onda grande ed una bassa frequenza mentre la luce con alta energia ha bassa lunghezza d’onda ed alta frequenza.
Il fisico e matematico svizzero , Jakob Balmer fornì una formula empirica per il calcolo delle lunghezze d’onda delle righe dell’Idrogeno che cadevano nel campo visibile cioè dal violetto al rosso.Infatti nel 1885 fornì la formula
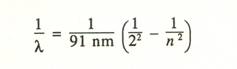
Per fare un esempio, se ad n veniva dato il valore 6 si aveva:

la λ =410 nanometri ottenuta dal calcolo la troviamo nella parte violetta dello spettro. Sostituendo ad n rispettivamente i valori 3, 4 ,5 allora si otterranno, per l’idrogeno, i valori delle λ delle altre righe che cadono nel visibile.Questa serie di righe venne detta SERIE DI BALMER
Successivamente, però, un altro fisico di nome Rydberg diede un’altra formula empirica per calcolare le λ dello spettro dell’Idrogeno che, in questo caso, cadevano nel campo dell’infrarosso e dell’ultravioletto:
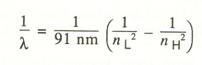
deve nL ed nH si riferiscono a d energie basse ed alte rispettivamente. Quando si pone nL=1 si hanno le λ nel campo dell’ultravioletto, mentre se nL= 3 la regione è quella dell’infrarosso ( come abbiamo visto sopra, per la formula di Balmer, se nL=2 la regione è quella del visibile).La serie di righe venne detta SERIE DI RYDBERG
LA TEORIA DI PLANCK E L’IPOTESI DI BOHR
Gli studi sull’atomo segnavano il passo per le difficoltà incontrate dalla fisica classica nel fornire le giuste spiegazioni ai fenomeni atomici, in particolare gli spettri atomici. Una svolta decisiva, però, venne fornita dagli studi di Stefan, Boltzman,Wien, Rayleigh e di Max Planck effettuati sul cosiddetto Corpo Nero.
E’ noto sperimentalmente che quando una radiazione colpisce una superficie qualunque di un corpo, parte dell’energia radiante viene riflessa, parte viene assorbita dal corpo e parte viene trasmessa cioè fatta passare oltre e quindi i corpi ordinari non assorbono energia in un modo perfetto.
In contrasto con i corpi ordinari esiste un CORPO IDEALE, definito CORPO NERO che, per definizione si presume assorbe COMPLETAMENTE qualunque energia radiante lo colpisca e , sempre per definizione, emette energia in modo completo e perfetto.
E’ noto che i corpi ordinari se riscaldati sino a raggiungere una certa temperatura, irradiano energia, ed il CORPO NERO irradia la maggior quantità di energia rispetto a tutti gli altri corpi.
Stefen e Boltzman osservarono che la quantità di energia emessa dal corpo nero dipendeva dalla Temperatura infatti
E= σ x T 4
dove σ = costante= 5,6697 x 10-5 ergs/sec.cm².grado4
I due fisici riuscivano a dare spiegazione del comportamento radiante del corpo nero sia a basse lunghezze d’onda che ad alte lunghezze do’nda. Ma fu Max Planck a dare la motivazione di quel comportamento. Infatti, suppose che il corpo nero emettesse energia in modo discontinuo cioè ” a pacchetti” che egli chiamò QUANTI di energia, pari a
E = h ν
dove h = costante di Plank = 6,6256x 10-27 ergs/sec e ν = frequenza della radiazione.
L’ipotesi di Planck era che il corpo nero fosse costituito da un numero n di oscillatori armonici (come le molle che si allungano e si restringono) ognuno dei quali emetteva una radiazione di frequenza ν ed energia E=hν, quindi l’energia emessa era pari ad
E = n x h ν
dove n è sempre un numero intero di oscillatori che costituiscono il corpo nero. Pertanto Planck fu in grado di ottenere la formula che descriveva il comportamento del corpo nero in funzione della temperatura (assoluta T= 273+ t°)
e= 8 h c /5 x 1 / ehc / kt λ -1
dove K = costante di Boltzman =K/N
Questa formula era valida per tutte le lunghezze d’onda e per ogni temperatura.
L’ ipotesi dell’emissione di energia a pacchetti cioè di un’energia quantizzata ha dato inizio ad una nuova era nello studio dell’atomo.
L’ IPOTESI DI BOHR
L’idea di Planck di una energia quantizzata in seguito allo studio del corpo nero, fece comprendere a Niels Bohr che anche nell’atomo si potesse verificare una forma di quantizzazione dell’energia posseduta dagli elettroni. Così come nel corpo nero la temperatura riusciva ad attivare gli oscillatori armonici di cui esso era costituito, allora anche la temperatura o un’ altra forma di energia poteva stimolare gli elettroni di un atomo. Cessata l’eccitazione e quindi l’acquisizione di energia, gli elettroni, ritornando allo stato iniziale potevano rilasciare l’energia acquisita dando origine ad una radiazione luminosa. di ben definita lunghezza d’onda.
Egli pensò infatti, che gli elettroni potessero descrivere solamente orbite circolari ognuna delle quali avesse un momento angolare (massa x velocità x raggio dell’orbita) mvr che fossero un multiplo intero di una quantità pari ad nh/2π cioè il momento angolare doveva essere quantizzato
primo postulato di Bohr
mvr = nh/2π
questo era il primo postulato di Bohr e ciò significa che questa quantizzazione non era il risultato di un calcolo matematico bensì era una semplice assunzione senza alcuna giustificazione matematica.
secondo postulato
contrariamente a ciò che sosteneva la meccanica classica, l’elettrone che si muove in un’orbita circolare conserva sempre la propria energia. Questa cambia se l’elettrone cambia la propria orbita.
terzo postulato
quando l’elettrone viene eccitato con un arco voltaico o con un altro mezzo che fornisce energia, l’elettrone l’ assorbe e cambia orbita muovendosi quindi in un’orbita con energia superiore alla precedente.
Quando l’elettrone ritorna nell’ orbita iniziale, riemette la quantità di energia che aveva assorbito però sotto forma di radiazione luminosa (quanto di luce E=hν)
Quest’ultimo postulato permise a Bohr di dare una spiegazione teorica alle righe spettrali dell’atomo di idrogeno.Cioè l’emissione del quanto di luce era conseguenza della differenza tra due livelli di energia :
E2 – E1 = h ν
CALCOLO DELL’ENERGIA DI UN ELETTRONE IN UN ATOMO SECONDO BOHR
sappiamo che la carica elettrica sul nucleo dell’atomo è Ze
l’elettrone di carica e viene attratto dal nucleo con una forza pari a : Ze x e/ r² dove r è la distanza dell’elettrone dal nucleo.
poichè l’elettrone non cade sul nucleo è evidente che la forza di attrazione deve essere bilanciata dalla forza centrifuga che è mv² /r pertanto per un elettrone di massa m che si muove ad una distanza r dal nucleo, si deve avere
Ze x e/ r² = mv² /r
da cui si può calcolare il raggio dell’orbita descritta dall’elettrone
r= Ze² / mv²
ricordando il primo postulato si ha
mvr = n h/2π
calcoliamo la velocità V
v = nh /2π m r
e sostituendo in questa espressione il valore di r ottenuto sopra si ha
r = n² h² / 4π² m z e²
questo permise a Bohr di calcolare il raggio dell’orbita descritta dall’elettrone a seconda del valore di n che venne chiamato NUMERO QUANTICO PRINCIPALE che può assumere, come è stato già detto, SOLO VALORI INTERI CIOE’ 1, 2, 3 ecc.
Il valore ottenuto per il raggio della prima orbita detto RAGGIO DI BOHR che si indica con a è :
a = 0,528 Angstrom (l’Angstrom è un’unità di misura atomica paria 10-8 cm )
E’ stato facile per Bohr calcolare l’energia totale dell’elettrone in quanto essa è data dalla somma tra ENERGIA CINETICA + ENERGIA POTENZIALE
E = ½ mV² – Ze² / r
il segno meno deriva dal fatto che l’elettrone ha una carica negativa e Ze è la carica positiva del nucleo quindi il prodotto delle cariche ha segno negativo. Sappiamo inoltre che
r = Ze² / mv²
mv² =Ze² / r
sostituendo si ha
E = ½ Ze² / r – Ze² / r
E = ½ Ze² / r
sappiamo però che
r = n² h² / 4π² m z e²
quindi sostituendo questo valore nell’equazione precedente avremo
E = – 2 π² Z² m e4 / n² h²
CALCOLO DELLA λ DELLA RADIAZIONE EMESSA DOPO SALTO QUANTICO
sappiamo che l’emissione di energia luminosa dipende dalla differenza di energia tra due livelli energetici dell’elettrone E2- E1 perciò
E2 = – 2 π² Z² m e4 / n2² h²
E1 = – 2 π² Z² m e4 / n1² h²
E2 – E1 = h ν
E2 – E1 =- 2 π² Z² m e4 / n2² h² + 2 π² Z² m e4 / n1² h²
E2 – E1 = 2 π² Z² m e4 /h² ( 1/n2² – 1/n1²) = h ν
e ricordando che le lunghezze d’onda spettrali vengono indicate meglio con il Numero d’onda pari a
ν /c dove c è la velocità della luce, allora si ha :
ν /c = 2 π² Z² m e4 /h² c x ( 1/n2² – 1/n1²)
il termine 2 π² m e4 /h² c = R = Costante di Rydberg = 109677,58 cm-1
quindi
ν /c = R Z² ( 1/n2² – 1/n1²)
per valori di n1 =1 e facendo variare n2 cioè ponendolo uguale a 2,3,4,5, si riscoprono la serie di righe che scopri Lyman , per valori di n1 = 2 e facendo varire n2 si ha la serie di Balmer ,ponendo n1 =3 si ha la serie di Paschen, per valori di n1 =4 si ha la serie di Brackett e per valori di n1=5 si ha la serie di Pfund.
INCOMPLETEZZA DELLA TEORIA DI BOHR : STRUTTURA FINE DEGLI SPETTRI
Il primo problema della teoria di Bohr nacque dal fatto che con l’avvento di spettroscopi più potenti si scoprì che in realtà ogni riga spettrale dell’atomo di Idrogeno era costituita da un gruppo di righe, cioè era costituita da una “struttura fine” .BOHR NON RIUSCI’ A DARE UNA SPIEGAZIONE ma Sommerfeld nel 1916 suppose che le orbite dell’elettrone non fossero solo circolari, ma anche ellittiche in cui il nucleo occupava uno dei fuochi. Ciò portò a scomporre il moto dell’elettrone in due componenti : una Radiale ed una Azimutale.
Poiché la quantità di moto doveva essere quantizzata ambedue le componenti dovevano assumere valori che fossero un multiplo di h :
quantità di moto radiale = r x h
quantità di moto azimutale = k x h
La somma delle due quantità doveva essere la quantità di moto totale dell’elettrone cioè n = r + k.
Ciò dava una spiegazione della struttura fine degli spettri in quanto ad ogni valore del livello n corrispondevano dei sottolivelli k ed r . Poiché un atomo che veniva sottoposto all’ azione di un campo magnetico dava origina a nuove righe spettrali si introdusse un nuovo numero quantico oltre ai precedenti n, k,r che venne definito numero quantico magnetico ed indicato con m.
Inoltre per poter spiegare che ogni riga spettrale fosse formata da una ( singoletto) due(doppietto) o tre (tripletta) righe si introdusse un altro numero quantico S detto “Spin” che però poteva avere due soli valori +½ e -½ .Si può quindi riassumere la teoria di Bohr -Sommerfeld :
L’ATOMO E’ COSTITUITO DA UN NUCLEO CENTRALE CARICO POSITIVAMENTE
L’ELETTRONE SI MUOVE IN LIVELLI ENERGETICI CARATTERIZZATI DAL NUMERO QUANTICO n
OGNI LIVELLO ENERGETICO PUO’ SCINDERSI IN SOTTOLIVELLI CARATTERIZZATI DAI NUMERI QUANTICI r e k
Numeri quantici n,r,k sono legati tra loro da condizioni matematiche ben precise infatti
n PUO’ ASSUMERE VALORI INTERI COMPRESI TRA 1 ED ∞
K PUO’ ASSUMERE VALORI COMPRESI TRA 0 ED n -1
m PUO’ ASSUMERE VALORI COMPRESI TRA +K E -K
S PUO’ ASSUMERE VALORI ±½ E SI PUO’ ASSIMILARE ALLA ROTAZIONE DELL’ELETTRONE IN SENSO ORARIO O ANTIORARIO
La quantizzazione dell’energia è stata confermata nel 1914 con
L’ESPERIMENTO DI FRANK ED HERTZ
che utilizzarono un tubo a raggi catodici con una griglia centrale il cui potenziale poteva essere variato.
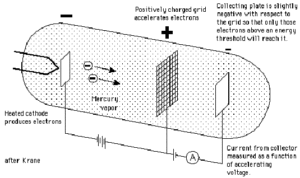
Gli elettroni trasferivano l’energia del loro moto alle molecole di gas contenute nel tubo e per effetto dell’urto elastico si osservava all’anodo un flusso di corrente. (In questo caso l’elettrone subisce la repulsione coulombiana della nuvola atomica ed esce dal processo di urto modificando la sua traiettoria ma senza perdere energia).
Quando, però, il potenziale di griglia aumentava, l’energia cinetica degli elettroni aumentava si osservava una brusca caduta della corrente perché gli urti divenivano anelastici. Infatti, se l’elettrone possiede sufficiente energia cinetica, nel processo d’urto una parte di tale energia viene ceduta al sistema atomico che, come detto in precedenza, passa dallo stato fondamentale al suo primo livello eccitato (a più alta energia).
Indicando con Ef ed Ei l’energia degli stati finali ed iniziali del sistema atomico, possiamo scrivere
Ef = Ei + ΔE
essendo in tal caso ΔE la differenza di energia fra lo stato iniziale e quello eccitato. L’energia perduta dall’elettrone durante l’urto è pari a
ΔE = m (vi2 – vf2) / 2
essendo vi e vf le velocità dell’elettrone prima e dopo l’urto. Utilizzando i corrispondenti valori misurati della corrente in funzione del potenziale si ottiene una curva corrente-tensione
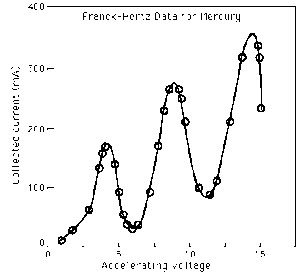
Il valore del potenziale di griglia a questo punto corrispondeva all’energia di ionizzazione degli elettroni nell’atomo del gas ciò significava che vi era un’energia di prima, seconda e terza ionizzazione. L’enegia di ionizzazione è quindi l’energia necessaria per staccare un elettrone da un atomo.
Lascia un commento