Considera i due composti

1 forma CIS 2 forma TRANS
nella forma CIS i due gruppi funzionali si trovano dalla stessa parte, mentre nella forma trans si trovano dalla parte opposta.
In cosa differiscono? Naturalmente nella molecola di sinistra vi sono due gruppi COOH dallo stesso lato della molecola mentre in quella di destra i due COOH si trovano su lati opposti.Lo stessa cosa la osserviamo per l’atomo di idrogeno. Le due molecole, che sono simili e quindi possiedono caratteristiche chimiche simili, tuttavia possiedono però caratteristiche fisiche diverse, infatti, i punti di fusione sono 403 Kelvin per la molecola 1 mentre per la 2 si ha 560 K, e la solubilità è rispettivamente 78,8 e 0,7.
Come si spiegano queste differenze?
Perchè un cristallo fonda, è necessario che il reticolo cristallino venga distrutto. Più forti sono i legami delle molecole tra loro e più energia occorre usare per la fusione cioè più aumenta il punto di fusione.La molecola 1 porta ad associazioni più forti tra le molecole che non la 2.
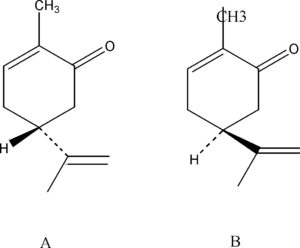
I due composti sono molto simili tra loro ma differiscono per due aspetti:
- l’atomo di H in A è legato all’anello a sei atomi da un legame che sta sopra il piano degli altri atomi e ciò è indicato dal simbolo nero solido mentre in B il legame è indirizzato verso il basso(indicato dalla linea tratteggiata) cioè si trova al di sotto del piano in cui si trovano gli altri atomi (ciò è indicato dalle linee normali).
- la stessa cosa avviene per il gruppo in basso a destra nelle molecole.
in conclusione possiamo dire che le due molecole differiscono esclusivamente per l’ orientamento nello spazio dei gruppi o atomi che le compongono.
Nel caso specifico i due composti hanno lo stesso punto di fusione e uguale solubilità, essendo molto simili, ma differiscono in una caratteristica che è l’odore. Noi sappiamo che gli odori sono fortemente associati alla distribuzione spaziale delle molecole che così interagiscono con i recettori dell’odore che vi sono nelle cellule nasali. Il composto A possiede un forte odore di menta mentre il secondo ha odore di semi di cumino.
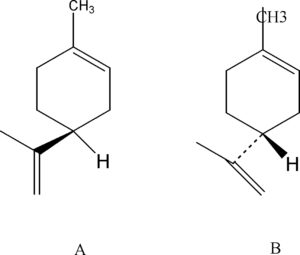
Anche questi composti differiscono per l’odore, infatti, il primo (A) ha un odore di limone mentre il secondo (B) ha un odore di arancio.
COME RAPPRESENTIAMO LE MOLECOLE NELLO SPAZIO ?
I modelli tridimensionali danno maggiori informazioni sulle molecole rispetto ai disegni su un piano.
Tuttavia anche su un piano è possibile rappresentare la distribuzione spaziale di una molecola . Infat
ti, consideriamo la seguente molecola
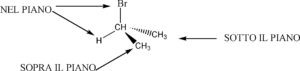
IL CUNEO SOLIDO (Flying Wedge) indica che l’atomo o il gruppo atomico è SOPRA il piano in cui è il resto della molecola.
IL CUNEO TRATTEGGIATO indica che l’ atomo o il gruppo atomico si trova SOTTO il piano
LA LINEA CONTINUA indica che l’atomo o il gruppo atomico si trova SUL PIANO
PROIEZIONI DI NEWMAN
Un altro modo di rappresentare le molecole organiche è la cosiddetta proiezione di Newman. La vista della molecola in questo caso è attraverso il legame carbonio carbonio. La seguente molecola spiega come .
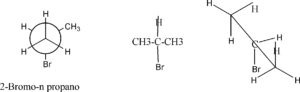
Come si vede, nella proiezione di Newman la molecola è vista dal gruppo metilico più vicino all’osservatore, e la catena di atomi di C più lontana dall’osservatore viene scritta dietro il cerchio.
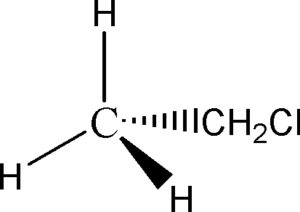
Scriviamo la molecola di CLOROETANO secondo la rappresentazione di Newman:

convertire la molecola di CLOROETANO scritta sopra secondo la proiezione a cuneo (Flying wedge)
GLI ISOMERI
Più molecole che contengono lo stesso numero e tipo di atomi possono avere differenti proprietà chimiche e fisiche. Differenti composti con le stesse formule molecolari sono detti ISOMERI.
Si possono dist inguere tre tipi di isomeri
- DI POSIZIONE
- DI GRUPPI FUNZIONALI O DI STRUTTURA
- STEREOISOMERI
GLI ISOMERI DI STRUTTURA hanno lo stesso arrangiamento di atomi nello scheletro della molecola, ma differiscono nella posizione di un sostituente sia esso atomo o gruppo atomico.
es. 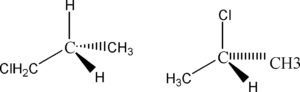
IN QUESTO CASO IL CLORO OCCUPA POSIZIONI DIVERSE NELLE DUE MOLECOLE LA CUI FORMULA E’ IDENTICA C3H7Cl
GLI ISOMERI DI GRUPPI FUNZIONALI differiscono solo perchè nelle molecole vi sono gruppi funzionali diversi
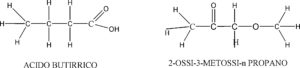
CH3CH2CH2COOH CH3COCH2OCH3
I GRUPPI FUNZIONALI SONO NEL PRIMO COMPOSTO IL GRUPPO ACIDO COOH E NEL SECONDO I GRUPPI CHETONICO CO E METOSSI
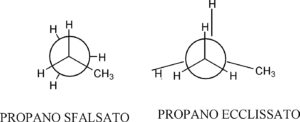
Gli stereoisomeri che possono essere interconvertiti per semplice rotazione intorno all’asse che unisce due atomi sono chiamati conformeri o forme conformazionali. Per esempio L’ETANO esiste nelle forme

A B
La forma A è detta sfalsata (staggered) mentre la forma B è detta “ecclissata”
il n butano ha più di una forma staggered
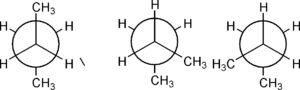
conformero anti conformeri Gauche
ed una forma ecclissata
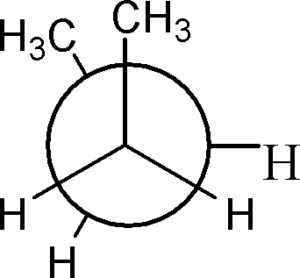
Questa forma è la meno stabile di tutte perché i due gruppi CH3 si influenzano tra loro stericamente.
Si possono separare le varie forme conformazionali? La risposta dipende dalle energie relative delle differenti conformazioni. Per esempio il n-butano ha 5 forme conformazionali
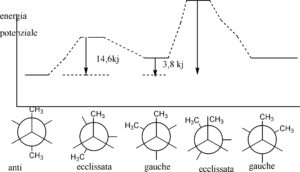
anti vuol dire che i gruppi CH3 sono dalla parte opposta (uno verso l’alto e l’altro verso il basso) e Gauche significa che i CH3 si trovano ambedue verso la stessa parte. Ovviamente la forma anti è più stabile della gauche essendo i gruppi più distanti tra loro e non si influenzano dal punto di vista sterico. In questo caso le barriere di energia tra le diverse conformazioni stabili sono basse, e questo provoca l’interconversione delle forme a temperatura ambiente.il n-butano esiste in una miscela di equilibrio di queste differenti conformazioni.
NEL CASO DEL BUTENE

L’ isomero Trans può essere isolato perché è separato dalla forma Cis da una significativa barriera di energia.
I composti ad anello o ciclici hanno limitate conformazioni spaziali in quanto le rotazioni intorno agli assi che uniscono gli atomi sono impedite, tuttavia esistono alcune possibilità. per esempio consideriamo l’esano questo può esistere in tre diverse conformazioni :
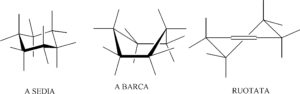
La forma a sedia risulta la più stabile essendo libera da problemi sterici che invece si hanno con le altre  .
.
le due forme a sedia si trasformano tra loro attraverso le due forme twisted ed a barca.Gli atomi di idrogeno possono assumere la conformazione equatoriale se sono in senso orizzontale, assiale se sono diretti verso l’alto o il basso rispetto agli atomi di carbonio cui sono legati.
Gli Stereoisomeri,(vedi figura)

sono molecole che differiscono tra loro per la diversa disposizione spaziale di atomi o gruppi atomici. Si possono distinguere due tipi di stereoisomeri:
- ENANTIOMERI
- DIASTEREOISOMERI
Sono detti ENANTIOMERI le coppie di molecole che sono immagini speculari l’una dell’altra (come le due mani) e non sono sovrapponibili. Sono conosciuti anche come isomeri ottici in quanto fanno deviare un raggio di luce polarizzata a destra(+) o sinistra(-). Sono molecole chirali dalla parola greca chiralos che significa mano ed hanno un atomo di C chirale cioè un atomo di C legato a 4 atomi o gruppi atomici diversi..Gli enantiomeri non posseggono né piani di simmetria né centri di inversione né assi Sn superiori .Quì mostriamo l’acido lattico
DIASTEREOISOMERI sono molecole che differiscono tra loro per la diversa disposizione spaziale di atomi o gruppi atomici ( isomeria geometrica).
Due stereoisomeri hanno spesso proprietà diverse quali ad esempio la solubilità (utile per la separazione mediante la cristallizazione frazionata), la densità ed il punto di ebollizione.
I DIASTEREOISOMERI si distinguono in Stereoisomeri R o S. Per individuare se un diastereoisomero è R o S si segue la regola ideata da CAHN, INGOLD, PRELOG
1- si ordinano i quattro gruppi legati all’atomo di carbonio CHIRALE dando priorità maggiore al gruppo che è legato a questo con un atomo che ha il numero atomico maggiore (il peso atomico, nel caso di ISOTOPI); se due gruppi sono legati all’atomo di carbonio chirale con atomi di uno stesso elemento si considerano i due successivi legati a questo elemento, se anche questi sono uguali si continua lungo le catene fino a quando viene individuata una differenza. A parità di atomi legati, legami tripli e doppi hanno priorità su quelli semplici.
- Prendendo ad esempio l’acido lattico (vedi figura sopra) gli atomi rappresentati in nero sono quelli di C, quelli in rosso sono di O , quelli in bianco di H . Qui i quattro gruppi sono, in ordine di priorità decrescente
- -OH, -COOH, -CH3,
- (infatti l’ossigeno ha n.atomico maggiore di C e siccome i due gruppi COOH e CH3 sono legati all’atomo di C chirale con lo stesso atomo (il C ) allora per stabilire la priorità si passa all’atomo successivo che è l’ O per COOH e l’H per CH3, quindi la priorità è di COOH rispetto a CH3)
- 2- si pone dietro il carbonio chirale il gruppo a priorità più bassa e si osserva quindi se la sequenza delle priorità degli altri tre, in ordine decrescente, segue una rotazione oraria o antioraria : se la rotazione è oraria si assegna il prefisso (R) se la rotazione è antioraria si assegna il prefisso (S) ( vedi sopra la figura che rappresenta l’acido lattico).
L’ATTIVITA’ OTTICA
Il metodo generalmente adoperato per prevedere se un composto possiede attività ottica è utilizzare i criteri di chiralità e la simmetria di assi Sn dove n rappresenta il numero di rotazioni che occorre effettuare per riportare la molecola nello stato iniziale.
La chiralità di un atomo nella molecola è condizione necessaria e sufficiente perchè la molecola mostri attività ottica . L’altra condizione è che non devono esistere assi di simmetria Sn con n diverso da 1. Quando è presente un asse S1 significa che vi è un piano di simmetria, mentre se vi è un asse S2 vi è un centro di simmetria i.
L’attività ottica di una molecola consiste nel far deviare a destra o sinistra un raggio di luce polarizzata.
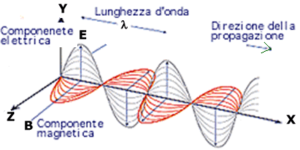
COS’E’ LA LUCE POLARIZZATA?
E’ noto che la luce è costituita da due onde, una elettrica ed una magnetica che vibrano in tutte le direzioni perpendicolari alla direzione secondo cui essa viaggia, cioè, le onde si muovono su diversi piani lungo la linea di propagazione.
Quando la luce ordinaria passa attraverso un prisma di Nicol (cristalli di calcite) o particolari filtri, detti polarizzatori, che sono in grado di far passare solo le onde che oscillano su di un piano ben preciso, la luce emergente è polarizzata linearmente ovvero il vettore elettrico vibra solo su uno dei piani prima interessati.
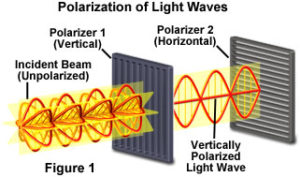
quando questa luce polarizzata attraversa una cuvetta contenente il campione, il composto può far deviare la luce polarizzata a destra o sinistra. Se questo raggio deviato si fa passare attraverso un altro filtro, detto analizzatore, collegato ad una scala graduata, si riporta la luce deviata nella posizione originaria e si legge sulla scala di quanti gradi il campione ha deviato il raggio polarizzato. L’angolo di deviazione si indica con α . Lo strumento utilizzato prende il nome di POLARIMETRO ed utilizza come sorgente di luce la linea D del Sodio cioè 589 nanometri.
Più lunga è la cuvetta o più concentrato è il campione, più grande sarà l’angolo di deviazione. I risultati della misura vengono espressi come ROTAZIONE SPECIFICA definita come segue
[α] tD = α / l c
per le soluzioni
[α] tD = α / l c = α / l d
per sostanze pure (senza solvente)
α = angolo di rotazione misurato
t= temperatura
D = lunghezza d’onda della radiazione.(in questo caso la riga D del sodio)
l = lunghezza della cella in decimetri (1 decimetro = 10 cm)
c = concentrazione del campione espressa in g/ml di soluzione
d= densità del campione espressa in g /ml
Il valore di [α] dipende dalla temperatura dal tipo di solvente e dalla lunghezza d’onda.
La rotazione ottica può anche essere espressa come Rotazione molecolare [M] oppure [Φ]
[α] tD x PM
[Φ ] = α /lc’ = __________________
100
dove c’ = concentrazione del campione in moli/ml di soluzione
esempio :
esprimere i dati in notazione standard:
10 g di composto C in soluzione acquosa che ruota il piano di luce polarizzata D del sodio di 25 ± 0,2°
a destra alla temperatura di 298 K in un tubo lungo 20 cm.
[α]D298 = +25± 0,2 ° (composto C , 0,2 g/ml, H2O)
α = +25 ± 0,2 °
l= 2 dm (20 cm)
c=10 / 50 g/ml
ESEMPIO 1
cioè % di un enatiomero – % altro enantiomero
CALCOLARE ee IN
- UN CAMPIONE CONTENENTE UN SOLO ENANTIOMERO
- UN CAMPIONE CONTENENTE QUANTITA’ UGUALI DI 2 ENANTIOMERI (MISCELA RACEMICA)
- UNA SOLUZIONE CONTENENTE IL 75% DI UN ENANTIOMERO ED IL 25 % DI UN SECONDO ENATIOMERO
Nel primo caso è come se vi fossero 2 enantiomeri di cui il primo costituisce il 100% ed il secondo lo 0%
quindi % ee = 100 – 0 = 100%
nel secondo caso si ha il 50% del primo enentiomero ed il 50% del secondo enantiomero per cui
% ee = 50-50= 0 %
nel terzo caso si ha % ee= 75-25=50%
% ee =( [α] osservato / [α] enantiomero puro ) x 100
una miscela di colesterolo naturale ed il suo enantiomero mostra una rotazione specifica a 20° di – 27° .calcoliamo la % ee della miscela ed anche quale % di colesterolo naturale vi è nella miscela.
dai dati sappiamo che [α] enantiomero puro del colesterolo = -31,5° pertanto
% ee = ( -27°/ -31,5°) = 0,86° x 100 = 86% di colesterolo naturale
la differenza è 100-86 = 14 % di colesterolo naturale ed enantiomero
cioè il 7% di colesterolo naturale e 7% di colesterolo enantiomero
MISCELE RACEMICHE
Le miscele racemiche sono miscele costituite da due enantiomeri di una sostanza. Il primo a scoprire i cristalli detti anche racemati ed a separarli con una pinzetta, fu Pasteur che isolò gli isomeri ottici dell’acido tartarico.Una miscela racemica è indicata con il simbolo (±) che precede il nome della sostanza; ad esempio (±) acido tatrtarico e sta ad indicare quantità uguali di due enantiomeri che fanno deviare la luce polarizzata uno a destra e l’altro sinistra ottenendo (+) acido tartarico ed ( – )acido tartarico. La separazione degli enantiomeri che formano una miscela racemica viene definita risoluzione chirale e si adoperano la cristallizzazione, la cromatografia o gli enzimi.
Se abbiamo una miscela racemica di un composto A (±) A e desideriamo separare i due enantiomeri basta farli reagire con un enentiomero diciamo (-)B per formare un sale cristallino. In tal caso si ottiene una miscela di due sali
(+) -A (-)-B
(-) – A (-)-B
quest due sali sono diastereoisomeri. I diastereoisomeri hanno spesso proprietà diverse quali ad esempio la solubilità (utile per la separazione mediante la cristallizazione frazionata), la densità ed il punto di ebollizione.Diviene quindi più semplice separarli per cristallizzazione frazionata.
Prendiamo ad esempio la miscela racemica dell’acido glicerico
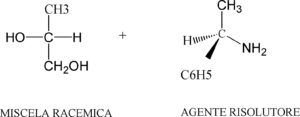
acido glicerico (±) GCOOH (+) -α- feniletilamina (+)PhNH2
Si ottengono i due diastereoisomeri
(+)-GCOO- . (+) -PhNH3+
(-)-GCOO- . (+) -PhNH3+
che si separano per cristallizzazione frazionata cioè si tratta con acqua contenente il 10% di HCl e si ottengono da
(+)-GCOO- . (+) -PhNH3+ ——-> (+)-GCOOH + (+)- PhN3+ Cl‾
e si estrae con un solvente organico come l’acetato di etile. In questo si scioglie (+)-GCOOH mentre
(+)- PhN3+ Cl‾ rimane in soluzione acquosa.
alcuni reattivi risolutori più usati sono mostrati nella figura seguente:
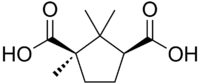
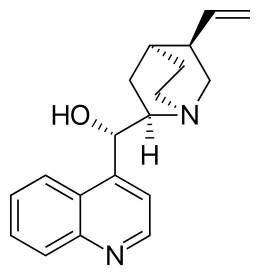
acido tartarico acido canforico cinconina
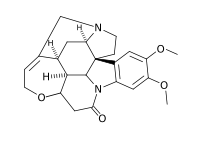
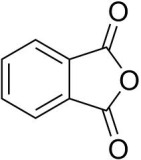
stricnina anidride ftalica
ad esempio il (±) – 2 -Butanolo viene fatto reagire con anidride ftalica per formare
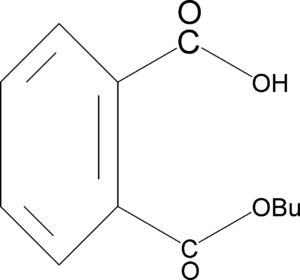
LA BRUCINA A SUA VOLTA FORMA DIASTEREOISOMERI CHE SONO SALI DI AMMONIO CARBOSSILATI UTILI PER LA SUCCESSIVA CRISTALLIZZAZIONE FRAZIONATA.
SINTESI RACEMICHE
I reagenti che producono miscele racemiche sono chiamati STEREOSPECIFICI o STEREOSELETTIVI. E’ comune osservare che specie planari che possiedono un atomo SP2 o un carbocatione intermedio vanno incontro a reazioni nucleofile in cui li reagente ha il 50% di probabilità di entrare da due diverse parti per cui si ottiene sempre una miscela racemica.



Lascia un commento