ESERCIZI FASE NAZIONALE CLASSI A e B
- Indicare la configurazione elettronica del magnesio nel suo stato fondamentale:
- 1 S2 2s2 2p6
- ls2 2s2 2p6 3s1
- l S2 2s2 2p5 3s2
- 1S2 2s2 2p6 3S2
- espandere l’ ottetto
soluzione
il magnesio si trova nel secondo gruppo della tavola periodica e nel terzo periodo e possiede pertanto 12 elettroni che occupano i seguenti orbitali 1S² 2S² 2Px²2Py²2Pz² 3S²
2. Indicare quale tra questi elementi può espandere l’ ottetto:
- azoto
- fosforo
- ossigeno
soluzione
l’azoto ha la seguente struttura elettronica: 1S² 2S² 2Px¹ 2Py¹ 2Pz¹
l’ossigeno ha la seguente struttura 1S² 2S² 2Px² 2Py¹ 2Pz¹
il fosforo ha la seguente struttura 1s² 2s² 2p6 3s² 3p³ quando ha valenza 3
1s² 2s² 2p6 3s1 3p³ 4s¹ quando ha valenza 5
ma si può scrivere anche il suo stato fondamentale nella forma [Ne]3s² 3p³ che significa che nella parte più interna ha una struttura identica al neon oppure [He]2s² 2p6 3s² 3p³ che significa che ha la struttura interna uguale a quella dell’elio.
3. Calcolare quanti mL dì una soluzione di HCI 0,32 M si devono aggiungere a una soluzione acquosa contenente 4,00 g di Na2CO3 per ottenere una soluzione a pH 10. Per H2CO3 si ha:
Ka1 = 4,5 x 10-7
Ka2 = 4,8 _10–10
soluzione
quando si aggiunge HCl in quantità più piccole rispetto al sale Na2CO3 si forma NaHCO3 in presenza ancora di Na2CO3 che non ha reagito ed in tal caso, siamo in presenza di un acido debole NaHCO3 in presenza del sale Na2CO3 cioè di un Tampone e quindi il PH è quello del tampone NaHCO3- Na2CO3 (se invece si aggiungono quantità di HCl uguali a quelle dell’Na2CO3 tutto Na2CO3 si trsforma in H2CO3 quindi il PH è quello di un acido debole).
il PH di un tampone è calcolato da [OH-] = Kw/Ka x Cs/Ca
poichè si desidera un PH=10 allora POH = 4 ed [OH-] = 10-4
pertanto 10-4 = 10-14 /4,8 x 10-¹¹ x Cs/Ca
possiamo calcolare quindi il rapporto Cs/Ca = 10-4 x 4,8 x 10-11 / 10-14
Cs/Ca = 0,48 tuttavia Cs dopo aggiunta dell’acido è 4/106 moli – Ca quindi Cs -Ca/Ca =0,48
cioè 0,038 -Ca = 0,48 Ca da cui si ottiene 0,48 Ca + Ca = 0,038
cioè 1,48 Ca = 0,038 da cui Ca= 0,038 / 1,48 Ca = 0,0257/1000
quindi le moli sono 25,7
poichè sappiamo che Vx M = moli allora X x 0,32 = 25,7 da cui X = Volume di HCl = 25,68/0,32
V = 80,3
la risposta corretta è la n. 3
- 99,4
- 80,3
- 87,5
- 33,9
4. Indicare quale delle seguenti affermazioni sull’azoto è corretta:
- può espandere l’ ottetto
- ha bassa elettronegatività
- forma più di un ossido
- l’azoto molecolare, N2, è presente nell’atmosfera a concentrazioni inferiori al 20%
soluzione
abbiamo visto che non può avere espansione dell’ottetto perchè ha meno di 8 elettroni. Ha però elettronegatività abbastanza elevata essendo 3,04(scala di Pauling ) (il fluoro è 3,98 ), e forma cinque ossidi NO , NO2, (N2O4) , N2O , N2O3, N2O5 e nell’atmosfera è presente al 78,09% (il 20% circa è l’ossigeno).
La risposta esatta quindi è la n.3
5. A 20,0 °C e 1013 mbar, l’ aria secca ha una densità di 1,204 kg/m³. Qual è la densità a 40°C e 1013 mbar? (considerare ideali i gas)
d1 =P1 x PM/R T1
d2 =P2 x PM/R T2 d2 = T1 P2 d1/P1 T2 ma in questo caso P2=P1
pertanto d2= 293 x d1 / 313 = 293 x 1,204 /313 d2= 1,127 Kg/m³
- 1,204 kg/m³
- 1,127 kg/m³
- 0,602 kg/m³
- 0,301 kg/m³
6. Indicare quale tra le seguenti sostanze allo stato elementare ha il punto di fusione più basso:
- Hg
- Fe
- Al
soluzione
Il punto di fusione di un elemento o di una sostanza in genere è la Temperatura in cui la forma liquida e la forma solida sono in equilibrio. Quando si fornisce calore ad un solido esso serve per allentare le forze reticolari del solido fino a che si raggiunge una temperatura in cui si inizia a formare il liquido (punto di fusione). Se continuiamo a fornire calore al solido, questo non viene utilizzato per aumentare la temperatura, ma servirà solo a far fondere il solido completamente cioè ad allentare i legami mentre la temperatura, durante il processo, rimane costante. Quando tutto il solido è fuso, allora il calore ceduto serve ad aumentare nuovamente la temperatura sino a che il liquido non bolle. A questo punto la temperatura rimane costante sino a che tutto il liquido evapora.Tra gli elementi considerati dal presente esercizio, possiamo notare che il mercurio, contrariamente agli altri, è un elemento che si trova allo stato liquido a temperatura ambiente Il punto di fusione di questo elemento è intorno ai −38,83 °C, e ciò perché il mercurio ha una configurazione elettronica in cui gli elettroni riempiono tutti gli orbitali disponibili fino al 6s. Questa configurazione resiste fortemente alla rimozione di un elettrone, perciò il mercurio ha la tendenza a comportarsi quasi come un gas nobile formando legami deboli e fondendo a temperature basse (significa, per l’appunto, che basta una piccola agitazione termica per spezzare i legami. La stabilità dell’orbitale 6s è dovuta alla presenza di orbitali 4f pieni che sono più interni e dunque la loro azione schermante contro la carica nucleare è piuttosto scarsa.
La risposta corretta è quindi Hg
7. Il consumo basale di ossigeno di un individuo normale è dì 16.0 moli pro die. Quale volume di aria (in m³) viene inspirata in un giorno (a 1.013105 Pa e 298.15 K), sapendo che il suo contenuto di ossigeno è 21,0% (v/v)?
soluzione
l’ equazione generale dei gas è:
PV = nRT P =1013105 V= X n=16 R= 8,31 m3 Pa K−1 mol−1 T= 298,15 K
quindi essendo l’ossigeno al 21 % occorre fare la proporzione
se in 100 ve ne sono 21 allora in X ve ne saranno 0, 391
100: 21 = X : 0,391
X = 1,86 m³
- 3,88
- 1,51
- 1,86
- 2,44
risposta corretta n 3
8 – indicare quale tra i seguenti elementi ha maggiore elettronegatività:
- Si
- Al
- S
- P
soluzione
L’elettronegatività di un atomo è la tendenza ad attrarre verso di sé gli elettroni di un legame.
esistono tre scale di elettronegatività 1- di Pauling 2- Mulliken 3-alfred.Rochow. Le formule usate sono: Pauling : ![]()
dove XA ed XB sono le elettronegatività degli atomi A e B.
- Δ è detto “surplus di energia” ed è dato da
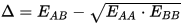
- Dove EAB è l’energia di legame del composto A-B, EAA l’energia di legame del composto A-A,
- EBB l’energia di legame del composto B-B.
La scala di Mulliken è ottenuta da
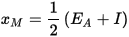 in questo casol’elettronegatività è definita semplicemente come la media aritmetica tra l’energia necessaria a ionizzare un atomo e l’ affinità elettronica
in questo casol’elettronegatività è definita semplicemente come la media aritmetica tra l’energia necessaria a ionizzare un atomo e l’ affinità elettronica- la scala di pauling e quella di Mulliken sono in relazione con la formula
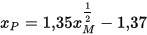 dove xp è il valore di Pauling ed XM ill valore di Mulliken
dove xp è il valore di Pauling ed XM ill valore di Mulliken
- La scala di Alfred-Rochow è ricavata da
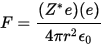
-
Questa scala si basa sulla forza coulombiana con cui un elettrone è attratto dal nucleo
dove Z* è la carica nucleare efficace cioè la carica esercitata dal nucleo sull’ elettrone esterno
L’elettronegatività è proporzionale a questa forza
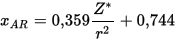 dove r è il raggio covalente dell’atomo cioè il raggio di un atomo legato ad un altro con legame covalente e le costanti numeriche servono a mettere in relazione questa scala con quella di Pauling.
dove r è il raggio covalente dell’atomo cioè il raggio di un atomo legato ad un altro con legame covalente e le costanti numeriche servono a mettere in relazione questa scala con quella di Pauling.Chiarito l’argomento, osserviamo che in un periodo l’ elettronegatività aumenta ed infatti si ha (secondo la scala di Pauling):
9. Se la concentrazione di Pb(II) in un campione di acqua potabile è .2,41 x 10-8 M, tenendo conto che un individuo ingerisce 2,0 L di acqua al giorno, calcolare la massa di Pb(II) ingerita in un mese (30 giorni):
- 0,85 mg
- 1,2 mg
- 0,58 mg
- 0,30 mg
soluzione
La Molarità indica quante moli vi sono in 1000 ml cioè in 1 litro per cui per ottenere i grammi di Pb in 1 litro
M x Peso atomico = grammi
grammi di Pb ingeriti con 1 litro di acqua = 2,41 x 10-8 x 207,2 = 0,499 x 10-5
poiché beve 2 litri di acqua al giorno, allora la quantità è 2 x 0,499 x 10-5 = 0,999 x 10-5= 0,1 g e per 30 giorni 0,30 x 10-5 g
cioè 0,30 mg
10. Un recipiente di 1,00 L, contenente il gas A alla pressione di 1,00 bar, viene connesso ad un altro recipiente di 3,00 L contenente il gas Balla pressione di 3,00 bar. La temperatura viene mantenuta costante, Quale è la pressione totale finale?
- 2,50 bar
- 4,00 bar
- 1,00 bar
- 3,00 bar
soluzione
sappiamo che
P1V1+P2 V2 =9+1 =10 Bar in un volume totale di 4 litri P1+P2/4 = 10/4 = pressione finale =2,5 bar
11 – . Indicare la sola affermazione ERRATA che riguarda gli elementi F, CI, Br:
- sono indicati come “alogeni”
- sono tutti gas a temperatura ambiente
- sono simili dal punto di vista chimico
- sono caratterizzati da notevole elettronegatività
soluzione
Sono tutti definiti alogeni cioè generatori di sali, e si comportano in modo simile dal punto di vista chimico. La loro elettronegatività è notevole in quanto si trovano al VII° gruppo ed è noto che l’elettronegatività aumenta lungo il periodo.
Il Fluoro non esiste libero in natura ma si trova invece combinato con altri elementi sotto forma di fluoruri in particolare nella fluorite e nella fluoroapatite. A temperatura ambiente è un gas di colore giallo pallido, poco più pesante dell’ aria ed è tossico. Il cloro a sua volta è un gas di color verde giallastro, (χλωρός in greco si traduce con verde pallido) è più pesante dell’aria, ha un odore sgradevole ed è molto velenoso.
dei tre alogeni il bromo dal greco βρόμος, bròmos, che significa «puzza». è liquido a temperatura ambiente, pesante, scorrevole e di colore rosso-bruno
quindi la risposta al quesito è la n.2
12 indicare fra le seguenti coppie quale è costituita da ioni isoelettronici
- F- Cl-
- Ca+2 Mg+2
- F- Ca+2
- F- Al+3
soluzione
ricordiamo che uno ione negativo ha uno o più elettroni in più rispetto al suo stato neutro
uno ione positivo ha perso uno o più elettroni rispetto al suo stato neutro
le strutture elettroniche sono :
F [He] 2s² 2Px² 2Py² 2Pz¹ F- [He] 2s² 2Px² 2Py² 2Pz² uguale al Neon (+1 elettrone)
Cl [Ne] 3s² 3Px² 3Py² 3Pz¹ Cl- [Ne] 3s² 3Px² 3Py² 3Pz² uguale all’argo (+1 elettrone)
Ca [Ar] 4s² Ca+2 [Ar] ha perso i 2 elettroni dall’orbitale 4S
Al [Ne] 3S² 3Px¹ Al+3 [Ne] ha perso 3 elettroni dagli orbitali 3PX e 3S
Mg [Ne] 3S² Mg+² [Ne] ha perso 2 elettroni dall’orbitale 3S
si dicono isoelettronici due atomi che possiedono lo stesso numero di elettroni e possiedono la stessa struttura, quindi è isoelettronica la coppia F- e Al+3
dalla struttura si evince che sono isoelettronici Mg+2 F- ed Al+3 e la coppia Ca+2 e Cl-
13- Indicare il pH di una soluzione di NH4CI 0,045 M
- 7.0
- 9.2 .
- 5.3
- 11.4
soluzione
il pH della soluzione di NH4Cl è dovuto all’idrolisi del sale formato da base debole ed acido forte
NH4Cl ![]() NH4+ + Cl-
NH4+ + Cl-
NH4+ + H2O ![]() NH4OH + H+
NH4OH + H+
Kb = [NH4OH] [H+] / [NH4+]
[H+] = ![]()
[H+] = √( 10-14 / 1,8 x 10-5 ) x 0,045
[H+]= √25 x 10-12 = 5 x 10 -6 PH = 6 – log 5 = 5,3
la risposta al quesito è la n. 3
14. Indicare la molecola tetraedrica:
- XeF4
- CF4
- SF4
- TeCl4
soluzione
XeF4 ha l’atomo di Xe con un’ibridazione sp3d2 che porta ad una struttura planare quadrata
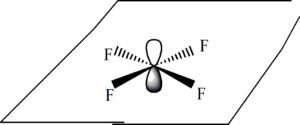
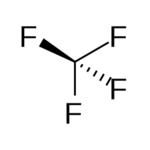
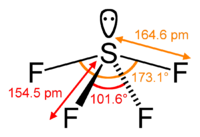
XeF4 CF4 SF4
mentre il cloruro di tellurio che esiste come [TeCl4]4 ed ha la seguente struttura
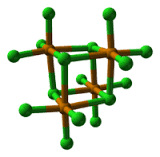
da quanto sopra si evince che la struttura tetraedrica è quella di CF4
15. Indicare in quale specie l’atomo centrale non raggiunge l’ottetto:
- BF3
- CH4
- H2O
- NH3
soluzione
il Boro ha struttura elettronica [He] 2s2 2p1 . Si suppone che un elettrone si portidall’orbitale s su un orbitale P per dare la struttura [He] 2s¹ 2Px¹ Py¹ il che permette agli elettroni del fluoro di accoppiarsi a quelli del Boro.In questo legame, tuttavia, non formano un ottetto infatti vi sono solo 6 elettroni esterni.
Quindi la risposta esatta è la n.1
16. Calcolare il pH di una soluzione di H2SO4 sapendo che da 130 ml. di soluzione si possono precipitare 0.750 g di BaSO4 per aggiunta di un eccesso di BaCl2:
- 3,58
- 0,990
- 2,88
- 1,3
soluzione
per risolvere il problema dobbiamo conoscere la concentrazione dell’acido. Questa può essere calcolata sapendo che si ottengono 0,750 g di BaSO4 che corrispondono a 233: 96 = 0,750 😡 X= grammi di SO4-2 =0,309 g
ma nell’acido H2SO4 l ‘ H+ è 2volte SO4-2 perciò H+ = 2x 0,309 =0,618 g cioè 0,618 /98 = 6,306 moli in 130 ml ma la concentrazione deve essere espressa in moli/l
perciò 130 : 6,306 = 1000 😡 X = 6306/130 =0,0 485 moli [H+] = 0,0485 moli/l PH = – log 4,85 x 10 -²
PH = 2- log 4,8 = 2-0,69 = 1,3
17 -tra le molecole di H2O si instaurano legami a ponte idrogeno assenti nelle molecole di H2S. Un’ evidenza sperimentale si può ottenere dal confronto:
- delle rispettive temperature di ebollizione
- dei rispettivi indici di rifrazione
- dei rispettivi calori specifici
- dei rispettivi coefficienti di dilatazione termica
soluzione
quando si cede calore ad un liquido esso viene utilizzato per vincere le forze di attrazione che possono esistere tra le molecole. Il legame idrogeno è una di quelle forze, per cui più grande è l’attrazione, maggior energia è necessaria per vincere questa forza e quindi maggiore è il punto di ebollizione. Si deduce che la risposta esatta è la n.1
18. Calcolare le moli di Fe metallico necessarie per degradare 1 mol di tricloroetilene secondo la reazione, da bilanciare:
Fe (s) + Cl2C=CHCl (aq) +H2O (l) → Fe+² (aq) + H2C=CH2 (g) + Cl-(aq) + OH-(aq)
la reazione redox è la seguente:
6[ Fe° → Fe+2 +2e
+2 0 -2 -2 in totale da +2 a -4 quindi 6 elettroni scambiati
2[Cl2C = CHCl + 6e + H2O → H2C=CH2 + 3Cl- + 3OH-
e dividendo per 2
_______________________________________________ Fe° + Cl2C = CHCl + 3 H2O → 3 Fe+2 + H2C=CH2 + 3Cl- + 3 OH-
quindi per la reazione in esame la risposta esatta tra quelle fornite sotto è la n.2
- l
- 3
- 1.5
- 4
19. Diamante e grafite sono due forme cristalline di uno stesso elemento:
- silicio
- fosforo
- zolfo
- carbonio
soluzione
Il diamante è uno degli stati allotropici del carbonio è un solido reticolare composto da atomi di carbonio a struttura tetraedrica|. Come tutti i solidi reticolari con legami covalenti il diamante è duro e rigido, cartteristiche proprie dei cristalli reticolari e tra essi è il più duro che si conosca ed occupa il primo posto nella scala di Mohs.della durezza.
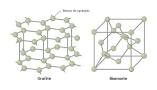
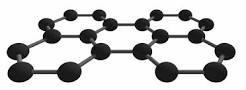 diamante grafite
diamante grafiteNella Grafite il Carbonio è ibrido sp2 a geometria planare triangolare e si formano piani estesi di atomi di C legati tra loro a formare esagoni di legami covalenti come le piastrelle di un pavimento. Ciascun atomo impegna tre elettroni nei legami σ ed il quarto elettrone si trova in un orbitale P e tutti questi formano orbitali molecolari delocalizzati su tutto il cristallo di cu n/2 sono leganti con più bassa energia ed n/2 non leganti, senza elettroni, a più alta energia.Le oscillazioni degli elettroni delocalizzati creano momenti di dipolo momentanei. La sua struttura gli conferisce la cartteristica di essere un lubrificante in quanto piani possono scivolare l’uno sull’altro.
20. Il fosforo elementare ha tre allotropi: bianco, rosso e nero. Di questi, il fosforo bianco, formato da molecole tetraedriche di formula P4, è il più reattivo nei confronti dell’ ossigeno. Indicare il motivo di tale comportamento
-
- per l’elevata tensione dell’angolo di legame che hanno un valore di circa 60°
- perché i prodotti principali di ossidazione sono gli ossidi P 4O6 e P4O 10
- perché è capace di assorbire la luce che ne catalizza le reazioni di ossidazione
- perché gli atomi di fosforo presentano orbitali 3d vuoti
La struttura elettronica del P è [Ne]3S² 3P3 ed ha un orbitale 3 d vuoto. 4 atomi di P si uniscono per formare una molecola di P4
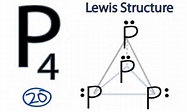
Gli angoli di legame P-P non sono esattamente tetraedrici ,infatti , l’angolo P3-P1-P2 è 59,99° e l’angolo P4-P1-P2 è di 60° . Questi angoli che sono molto differenti dall’angolo tetraedrico di 109° mostrano la grande tensione esistente tra gli atomi di fosforo nella molecola e pertanto in presenza di ossigeno ogni atomo di P della molecola di P4 trasferisce una coppia di elettroni agli orbitali 2 π* di antilegame dell’ossigeno. Questo processo è favorito perché la barriera per la scissione del legame O=O per formare legami O-P viene ridotta da 0,81 eV a 0,59 eV , portando ad una velocità di ossidazione circa 5000 volte superiore rispetto ad un legame senza tensione.
21. Una massa di KNO3 disciolta in acqua viene ridotta secondo la reazione
3 NO3 -(aq) + 8 Al (s) + 5 OH-(‘aq) + 2 H2O (l) → 8 AlO2 -(aq) + 3 NH3 (g)
L’ammoniaca si rimuove per distillazione e reagisce completamente con 12.5 ml. di una soluzione di HCI O.100 M. Calcolare la massa di KNO3 iniziale.
-
- 0,374 g
- 0,126 g
- 0,985 g
- 1,020 g
soluzione 12,5 x 0,1 = 1,25 mmoli di HCl equivalenti a 1,25 mmoli di NH4OH ottento dalla distillazione cioè
1,25 x 35 =43,75 mg di NH4OH corrispondenti a 35:17 =43,75 😡 X = 21,25 mg NH3 perciò
se da KNO3(g) : NH3(g) = X :21,25(g)
101 : 17 = X : 21,25 da cui X = 126,25 mg cioè 0,126 g
22. Stabilire quale di queste affermazioni relative allo ione fosfato, PO4- ³, è ERRATA:
- ha geometrica tetraedrica
- presenta quattro strutture limite di risonanza più rappresentative
- è caratterizzato da legami ionici P-O
- sull’atomo di fosforo non sono presenti coppie solitarie
soluzione
abbiamo visto sopra la struttura del fosforo e del suo ossido, e abbiamo già detto che vi sono legami covalenti quindi la risposta errata è la n. 3
23. Aggiungendo 5,60 g di Na2SO4 solido a 80,0 g di una soluzione dello stesso sale 11.0% (p/p), qual è la concentrazione (% p/p) della soluzione ottenuta?
- 16,8%
- 14,5 %
- 22,3 %
- 34,2 %
soluzione
100: 11 = 80,0 :X X = sale contenuto nelle soluzione = 80 x11 /100 = 8,8 g
in totale dopo l’aggiunta di 5,6 g di sale si hanno 8,8 n+ 5,6 = 14,4 g di sale in 80+5,6 g di soluzione
85,6 :14,4 = 100 : X X = 1440 / 85,6 = 16,8 %
24. Per reazione tra un ossido di un non metallo e l’acqua si può ottenere:
- un idracido
- un sale
- un acido ossigenato
- un idrossido
soluzione
i non metalli formano ossidi che in acqua danno origine ad acidi ossigenati per esempio:
CO2 + H2O → H2CO3
SO3 + H2O → H2SO4
NO2 + H2O → HNO3
pertanto la risposta corretta è la n 3
25 La quantità di NO2 in un campione di aria viene determinata dopo ossidazione ad HNO3 con H2O2• Calcolare la concentrazione in mg/L di NO2 se sono stati consumati 5.1 mL di una soluzione di NaOH 0.0105 M per neutralizzare l’acido formato da 50 L di aria:
- 68.7 mg/L
- 41.8 mg/L
- 49.3 mg/L
- 104.2 mg/
soluzione
5,1 x 0,0105 = mmoli NaOH equivalenti a 0,5355 mmoli NO2 cioè 0,05355 x 46 = 2,463 mg NO2
quindi se in 50 litri vi sono 2,463 mg, in 1 litro ve ne saranno X
X = 2,463/50 =49,3 mg/L
26. Data la reazione di combustione: 2C4H10+13O2 → 8CO2+10H20
Indicare la quantità massima di CO2 ottenibile se 5,00 g di C4H10 reagiscono con 25,0 g di O2:
- 15,1 g
- 20,0 g
- 10,9 g
- 20,9 g
soluzione
se da 2C4H10 si ottengono 8 CO2 da 5 g se ne ottengono X 116:8×44 = 5 :: X
X = 352x 5 /116 = 15,1
27. Un comune metodo di laboratorio per produrre ossigeno gassoso è scaldare il clorato di potassio, KCIO3. La reazione è la seguente: 2 KCIO3 (s)-2 → 2KCl (s) + 3 O2 (g). Calcolare quanti grammi di KCIO3 devono essere decomposti per produrre 10,0 g di O2.
- 4,50 g
- 7,10 g
- 25,5 g
- 39,6 g
soluzione
se da 2KClO3 si producono 3x 32 da X grammi se ne otterranno 10,0 g
245: 96 = X : 10 X= 245×10/96 = 25,5 g
28. Calcolare la costante acida Ka2 di un acido diprotico H2X, che forma un composto poco solubile con il Fe2+, FeX (con prodotto di solubilità 10-10,4), noto il valore della costante di equilibrio della seguente reazione:
FeX (s) + H+(aq) ~ Fe2+(aq) + HX-(aq) K = 10-2,7
k= [Fe+2] [HX-] / [H+] da cui [H+]/[HX-] = [Fe+2] / Kper calcolare Ka2 ricordiamo che
HX- ![]() H+ + X-2 ka2 = [H+][X-2] / [HX-] ma dal precedente equilibrio sappiamo che
H+ + X-2 ka2 = [H+][X-2] / [HX-] ma dal precedente equilibrio sappiamo che
[H+] /[HX-] = [Fe+2] / K perciò Ka2 = [Fe+2] [ X-2]/ K ma dal prodotto di solubilità
Kps = 10-10,4 = [Fe+2] [ X-2] e sostituendo abbiamo Ka2 = Kps / K cioè
Ka2 = 10-10,4 / 10-2.7 = 10 – 7,7
- 10-7,7
- 10-10,1
- 10-4,9
- 10-6,7
29. In un esperimento furono ottenuti 6,00 g di ossido di sodio Na2O (s). dalla reazione di 5,00 g di sodio metallico, Na (s). con un eccesso di ossigeno gassoso, O2. Indicare la resa della reazione
teoricamente da 5 g dovremmo ottenere
2Na : Na2O = 5 :X X = 46 : 61,9 = 5 : X X = 61,9 x 5 / 46 = 6, 74
ne otteniamo invece 6 g quindi i rendimento è ( 6 /6,74)x 100 = 89,0 %
- 82,4%
- 89,0%
- 44,5%
- 4 79,4%
30. Il permanganato di potassio ossida, in ambiente acido, una sostanza X di massa molecolare 100,5 secondo la semireazione: Mn04-+ 8 H’ + 5 e→Mn2+ + 4 H20 Sapendo che 0,500 mol di KMn04 reagiscono con 1,25 mol di X, determinare il numero di elettroni coinvolti nella corrispondente semireazione di ossidazio
- 4
- 1
- 5
- 2
soluzione i rapporti tra le moli sono uguali ai rapporti tra gli elettroni scambiati quindi
1,25 x 0,5 = 5 x X X= 0,5 x5 /1,25 = 2,5 /1,25 = 2
31. Indicare i coefficienti, riportati in ordine casuale, che permettono di bilanciare la reazione:
2MnO4-+ Fe + H+ ~ Mn2+ + Fe3+ +H2O
- 12, 2, 6, 5, 5, 6
- 3, 12, 8, 3, 5, 5
- 3, 24, 5, 5, 12, 3
- 3, 5, 5, 12, 3, 12
soluzione
3 [MnO4- +5e + 8H+ → Mn+2 + 4 H2O
5 [Fe° → Fe+3 +3 e
________________________________
3MnO4- + 5Fe° +24 H+ → 3 Mn2+ + 5 Fe+3 + 12 H2O
la rispost esatta è la n 3
32. Una miscela solida di 1,78 g è costituita da BaCl2 .2H2O e KCl. La miscela viene riscaldata a 160°C per 2 ore, per eliminare tutta l’acqua di cristallizzazione. Il peso finale è l,56 g. Calcolare la percentuale di BaCh’ 2 f’bO nella miscela:
- 87,4 %
- 58,9 %
- 83,7 %
- 44,8 %4
la quantità di H2O è 1,78- 1,56 = 0,22 g
per conoscere quanto BaCl2 vi è nella miscela sappiamo che 1 molecola di BaCl2. 2H2O contiene 2x 18 g di H2O quindi in Xg di BaCl2.2H2O ve ne saranno 0,22
BaCl2.2H2O : 2 H2O = X : 0,22
244,2 : 36 = X : 022 X = 1,49 g quindi in 1,78 g di miscela vi sono 1,49 g di BaCl2.2H2O perciò la percentuale si ottiene da 1,78 :1,49 =100 :X X = 83,7 %.
la risposta corretta è la n.3
33. Indicare in modo inequivocabile la quantità chimica di cloro che bisogna far reagire con 10 mol di ammoniaca, perché la seguente reazione sia completa: NH3 -:-Cl, -~ N2H4 + 2 NH4Cl
- 2,5 mol di cloro molecolare
- 5,0 mal di cloro molecolare
- 2,5 mol di cloro
- 5,0 mol di cloro
soluzione
34. La dose massima assimilabile di metilmercurio per l’uomo è 0,1 ng per kg di peso al giorno. Quanti kg di pesce può mangiare ogni settimana un individuo di 80 kg se il contenuto di metilmercurio nel pesce è 0,3 μg/kg
- 1.,2 kg
- 0,19 kg
- 0,48 kg
- 1,3kg
Soluzione
ogni giorno l’uomo di 80 Kg può assorbire al massimo 0,1 x 80= 8 ng e per 1 settimana 7×8= 56 ng
ogni Kg di pesce contiene 0,3 μg (300 ng infatti 1 μg=1000 ng)
se mangiando 1 Kg di pesce assorbe 300 ng allora per assorbirne al massimo 56 ng potrà mangiare XKg
1 Kg : 300 ng = X : 56 ng X=56/ 300 = 0,186 =0,19Kg
35 – Se si vuole avere un ugual numero di molecole di due sostanze liquide diverse A e B bisogna prendere
- volumi uguali di A e B
- un ugual quantità in grammi di A e B
- quantità in grammi di A e B che stiano tra loro come le rispettive densità
- quantità in grammi di A e B che stiano tra loro come le rispettive masse molari
soluzione
la risposta esatta è la n. 4 in quanto sappiamo che ogni mole di una sostanza qualunque corrisponde alla massa molecolare
36. Calcolare quanti grammi di una soluzione di KCI al 35% (p/p) occorre aggiungere ad una ” soluzione al 12% (p/p) per ottenere 120 g di una soluzione al 20% (p/p) di KCI:
- 54,7
- 41,7
- 32,1
- 22,4
soluzione
utilizziamo il metodo a croce
35 8
20
12 15
_________________
totale 23
quindi per preparare 23 g di soluzione occorre usare 8 g di k<cl al 35 % quindi per preparane 120 g se ne devono usare X 23:8 = 120 😡 X= 120 x 8 / 23 = 41,7
37. Qual è il numero di ossidazione medio del carbonio nella molecola di 1-propanolo CH3CH2CHHOH?
- +2
- -2
- -1,5
- -3
soluzione
cominciamo a calcolare il n.o degli atomi di C da sinistra a destra quindi
C1 è legato a 3 atomi di H che sono meno elettronegativi quindi C ha n.o -3
C2 è legato a 2 atomi di H che sono meno elettronegativi quindi C ha n.o -2 (i legami con lo stesso atomo non contribuiscono al calcolo del n. o)
c3 è legato a 2 atomi di idrogeno quindi il contributo al n.o. è -2 e ad 1 ossigeno che contribuisce con +1 (H legato all’O non si calcola)
in totale il n. o totale per i 3 atomi è -7 + 1 = -6 quindi la media è n.o. medio = – 6/3 = – 2
la risposta corretta è la n.2
38. Indicare il rapporto di reazione stagno/nitrobenzene nella reazione:
C6H5 NO2+Sn + H3O+ → C6H5NH2 + Sn+4 + H2O
- 2
- 1,5
- 2,5
- 3
soluzione
6[Sn° → Sn+4 +4 e
4[Ar- NO2 + 6 e + 6 H+ → Ar-NH2 + 2 H2O
_______________________________________________
6Sn° + 4 ArNO2 +24 H+ →6Sn+4 + 4 ArNH2 + 8H2O
che si può dividere per 2
pertanto il rapporto Sn/ArNO2 = 6/4 = 3/2 = 1,5
39. La capacità termica specifica dell’acqua è 4,18 J K-¹ g -¹. Calcolare quanta energia è richiesta per innalzare a pressione costante la tempera tura di 10,0 moli dì acqua da 20,0 °C a 25,0 “C:
- 209 J
- 209 kJ
- 3,76 kJ
- 3,76 KJ
soluzione
La quantita di energia necessaria per aumentare la temperatura dell’acqua da T1 = 20 ◦C fino alla temperatura T2 = 25 ◦C si calcola ricordando che
∆Q = Cal.specifico H2O x massa H2O (T2-T1) = 4186 J/ kg K (10 moli x 18 pM) ( 25-20)
∆Q = 4,186 x 180 x 5 = 3676 J/Kg K = 3,76 KJ
40. Un campione di aria inquinata da anidride solforosa viene fatta gorgogliare ad un flusso di 1,0 m³/h (in condizioni normali) attraverso una soluzione contenente 50 mL di H2O2 al 5%
H2O2 + SO2→ H2SO4)
Dopo 0.5 h, l’acido solforico viene titolato con 5,6 mL di NaOH 0,0050 M. Calcolare la concentrazione dì SO2 in mg/m³ presente nell’ acqua inquinata.
- 3,6 mg/m³
- 21,4 mg/m³
- 5,41 mg/m³
- 1,8 mg/m³
soluzione
5,6 x 0,005 = 0,028 moli di NaOH consumate che sono uguali a 0,028 moli di H2SO4 cioè
0,028 x 98 = g di H2SO4 = 2,744 g
quindi per calcolare SO2 si ha H2SO4 : SO2 = 2,74: 😡
98 : 64 = 2,744 :X X= 1,8 mg /m³
41 l’Angstrom è:
- un’unità di misura della lunghezza
- un’unità di misura della velocità
- un’unità dì misura del tempo
- un’unità di misura degli angoli dì legame
soluzione
a livello subatomico la lunghezza si esprime in A° angstrom dove 1 A° = 10-8 cm
42. Il simbolo dell’unità di misura della massa atomica è:
- uma
- u
- g
- nessuno dei tre
soluzione
l’unità di misura della massa atomica è l’unità di massa atomica che sinteticamente è espressa da uma.
La risposta corretta è la n. 1
43. Determinare quante moli dì formaldeide reagiscono con 100 ml di CuSO4 0,05 M, secondo la reazione da bilanciare:
Cu2+ + H2CO + H2O → Cu+ + HCOOH + H3O+
- 0,010
- 0,0045
- 0,0025
- 0,0050
soluzione
2[Cu+2 + e → Cu+
n.o O n+2
1[H2CO + 2H2O → HCOOH +2e +4 H+
________________________________________
2 Cu+2 + H2CO + 2H2O → 2Cu+2 + HCOOH + 4H+
le moli di CuSO4 che reagiscono sono 100 x 0,05 = 5 millimoli ed essendo il rapporto 2/1
hanno reagito 2,5 mmoli di H2CO cioè 0,0025 moli
la risposta esatta è la n 3
44. Litio e potassio:
- appartengono allo stesso periodo della tavola periodica
- possiedono lo stesso numero di elettroni nell’ultimo livello energetico
- sono entrambi non metalli
- possiedono lo stesso numero di protoni nel nucleo
45 stabilire in quale intervallo è compreso il PH di una soluzione 0,1 M di formiato di ammonio.
Ka = 1,8 x 10-4 Kb = 1,8 x 10-5
- 6 – 8
- 2 – 5
- 9 – 10
- 11 – 12
soluzione
pH deriva dal sale di acido debole e base debole
46. L’elettronegatività:
- è massima per il fluoro
- è massima per i metalli alcalini
- aumenta lungo un gruppo
- è pari all’energia di legame
soluzione abbiamo già visto che l’elettronegatività aumenta lungo un periodo e diminuisce lungo il gruppo, si osserva quindi che l’elettronegatività calcolata secondo Paulig, o Mulliken oppure Alfred-Rochow
Pauling ![]()
![]() Eab = energia del legame A-B
Eab = energia del legame A-B
Mulliken ![]() Ea = affinità elettronica ed I = potenziale di ionizzazione
Ea = affinità elettronica ed I = potenziale di ionizzazione
Alfred-Rochow ![]() r= raggio covalente dell’atomo
r= raggio covalente dell’atomo
è massima per il fluoro
la risposta esatta è la n 1
47 Indicare l’associazione corretta:
- N gas nobile
- P metallo di transizione
- Mg metallo alcalino
- Cl alogeno
soluzione
la risposta corretta è la n 4 infatti il cloro è un alogeno
48, Indicare quale coppia di formule rappresenta due sostanze differenti:
- Si(OH)4 e H4Si04
- H3BO3 e B(OH)3
- AsH3 e HAsO2
- acido cromico e H2CrO4
soluzione
la risposta corretta è la n 3 infatti si tratta dell’arsina AsH3 e acido ipoarsenioso
49. Indicare quale andamento si osserva spostandosi da sinistra verso destra lungo la Tavola Periodica:
- il raggio atomico tende a diminuire
- il raggio atomico tende ad aumentare
- l’energia di ionìzzazione tende a diminuire
- l’elettronegatività tende a diminuire
soluzione
il raggio atomico tende a diminuire lungo i periodi
50. Il fosforo (P) è un esempio di:
- non metallo
- metallo alcalino
- alogeno
- elemento delle terre rare
soluzione
il fosforo è un non metallo
51. Un composto binario contenente idrogeno e un altro elemento, in soluzione acquosa, ha comportamento:
- basico
- acido
- anfotero
- non è possibile definire a priori le sue proprietà
soluzione
un acido HA in acqua forma H3O+ quindi è un acido
le risposta corretta è la n. 2
52, Indicare la configurazione che descrive uno stato eccitato dell’atomo di ossigeno:
- 1s2 2s2 2p2
- 1 s2 2s2 2p2 3s2
- 1s2 2s2 2p1
- 1s2 2s2 2p4
soluzione
l’ ossigeno possiede 8 elettroni e la distribuzione elettronica è 1 s2 2s2 2p4
quando si ha uno stato eccitato gli elettroni dell’ orbitale 2P vanno ad occupare l’orbitale S con numero quantico maggiore quindi 1s2 2s2 2p2 3s2 è la risposta corretta al quesito.
53. un ossido anfotero è:
- in grado di reagire esclusivamente con basi
- in grado di reagire esclusivamente con acidi
- in grado di reagire sia con basi che con acidi
- non è in grado di reagire, né con basi né con acidi
soluzione
anfotero significa che si può comportare sia come acido che come base pertanto può reagire sia con gli acidi che con le basi. La risposta corretta è la n. 3
54. Indicare l’elemento che non presenta lo stato di ossidazione +6.
- Cr
- Mo
- S
- Ba
soluzione
il Bario Ba che appartiene al secondo gruppo ed ha la struttura [Xe] 6s2 in cui uno degli elettroni può passare nell’orbitale P per dare la struttura con 2 elettroni disponibili e perciò ha n.o +2, lo S ha -2,0,+2,+4,+6, il Cr ha la struttura [Ar] 3d5 4s1 e n.o.+2,+3 +6 il +3 è più stabile, il Molibdeno Mo ha n.o + 6 infatti ha la struttura [Kr] 4d5 5s1
55. Quando il sale NaCl si scioglie in acqua, si verifica:
- l’avvicinamento degli ioni con carica opposta
- l’idratazione degli ioni
- un aumento del pH
- una reazione di ossido-riduzione
soluzione
si ha la solvatazione degli ioni : l’acqua circonda gli ioni Na+ e Cl- che si formano dalla dissoluzione, creando intorno a loro una sfera di acqua orientata con gli atomi di idrogeno verso il cloro e con gli atomi di ossigeno verso il sodio
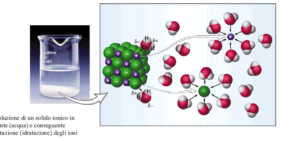
Dobbiamo tener presente che :
1.La dissoluzione di un sale è un equilibrio.
2. Diversi sali hanno diverse solubilità (Kps).
3. La solubilità dipende dall’energia del reticolo ionico (U) e dall’entalpia di idratazione (tenendo conto dei fattori entropici). Le molecole di H2O direttamente coordinate allo ione definiscono la sua prima sfera di coordinazione.
Mn+(g) + H2O(l) [M(H2O)x]n+
Altre molecole di H2O si dispongono attorno a questa prima sfera, formando una seconda sfera poi una terza e così via. La forza di interazione tra lo ione centrale e le molecole di H2O ha natura coulombiana, e quindi decresce rapidamente con la distanza.Il ΔH di idratazione di un catione, cioè la variazione di entalpia H definita come (E+PV) Dipende dalla carica ionica, dal raggio del catione e dalla sua elettronegatività.Secondo Latimer
ΔH = – 60900 Z²/ (r + 50) KJ /mole
Z = carica catione
r = raggio cationico (in picometri) 1 pm = 1 x 10 -¹² m
NaCl: Uret. = -788 KJ mol-1, p.f. = 801 °C, ΔHidr = -405 KJmol-1
56. Indicare il composto ionico del cloro:
- BCl3
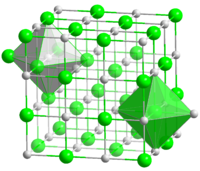
- HCl
- CCl4
- NaCl
Soluzione
NaCl solido cristallino che presenta gli ioni Na e Cl intervallati ai vertici di un cubo.
57. Una reazione chimica si svolge in un recipiente cilindrico, con un’ area di base di 10,0 cm² e dotato di un pistone libero di muoversi senza attrito. Sapendo che la pressione esterna è di 1,013 x 105 Pa e che il lavoro associato alla reazione è -10 1,3 .J. calcolare di quanto si innalza il pistone:
- 10,0 cm
- 100 cm
- 1,01cm
- 0,101 cm
soluzione
Lavoro = P (V2-V1) ΔV = -101,3 /1,013 x 105 la variazione di volume nel cilindro corrisponde a
ΔV = 100 x 10-5 Litri = 1 x 10 -3
l’ area di Base = πr2 = 10 cm²
V=πr2 h V=πr2⋅h h= V /10
- non è direzionale
- può essere polare o non polare
- può essere semplice, doppio e triplo
- è presente nelle molecole degli alcani
soluzione
il legame covalente è sempre direzionale quindi la risposta errata è la n.1
59. Indicare le formule dei composti ionici che sì formano quando il catione Na+ si combina con gli anioni bromuro, carbonato e fosfato:
- NaBr Na2CO3 Na3PO4
- Na2Br Na2C03 Na3P04
- NaBr Na3(C03)2 Na3P04
- NaBr Na2C03 Na2P04
soluzione
Na+ + Br- → NaBr 2 Na+ + CO3-2 → Na2CO3 3Na+ + PO$-3 → Na3PO4
quindi la risposta corretta è la n.1
60. Indicare a quale formula corrisponde il sodio solfito:
- Na2S
- Na2SO3
- NaHSO3
- Na2SO4
soluzione
il solfito di sodio è Na2SO3
infatti Na2S è il solfuro, NaHSO3 il solfito acido di sodio Na2SO4 è il solfato di sodio
Qui riprendono i quesiti della classe B (41-60)
- Calcolare quanti grammi di acqua si possono ottenere dalla decomposizione di 0,100 g di MgCl2 . 6 H20.
- 0,00881 g
- 0,0532 g
- 0,0189 g
- 0,0243 g
soluzione
se da MgCl2.6H2O si ottengono 6 di H2O, da 0,1 g se ne otterranno X
203,3 : 6 x 18 = 0,1 : X X= 108 x 0,1 /233,3 = 0,0532
42. 3,00 g di CaCO3 reagiscono con un eccesso di CH3COOH secondo la reazione, da bilanciare
CaCO3 + 2 CH3COOH → Ca(CH3COO)2 + CO2 + H2O.
Se tutto il carbonato viene consumato nella reazione, calcolare quanta CO2 e Ca(CH3COO)2 si formano:
-
- CO2 = 1,32 g; Ca(CH3COO)2 = 4,74 g
-
- CO2 = 4,74 g; Ca(CH3COO)2 = 1,32 g
- CO2 = 4,74 g; Ca(CH3COO)2 = 4,74 g
- C02 = 1,32 g; Ca(CH3COO)2 = 2,64 g
soluzione
CaCO3 : CO2 = 3.00 g :X X1=44 x3 /100 = 1,32 g CO2
CaCO3 ; Ca(CH3COO)2 = 3,0 :X2 X2 = 158,2 x 3,00 / 100 = 4,74
la risposta esatta è la n.1
43. Un minerale impuro contiene Al2(CO3)3. Per reazione di 2,50 kg di minerale con un eccesso di HCl gassoso si ottengono 0,55 kg di AlCl3 secondo la seguente reazione da bilanciare:
Al2(CO3)3 + HCl →AlCl3 + CO2 + H2O
Calcolare la percentuale in massa di Al2(CO3)3 presente nel minerale impuro:
- 22,0 %
- 11,0 %
- 38,6 %
- 19,3%
soluzione
Al2(CO3)3 + 6 HCl →2 AlCl3 + 3CO2 + 3H2O
Al2(CO3)3 : 2 AlCl3 = X : o,55Kg = 550 g
(53,96+ 120+60 )= X : 550
233,96 :133,3 = X : 550 X= 965,3 g
2500g :965,3 =100 😡 X = 38,61 %
44. Si aggiunga un eccesso di Cd metallico a una sospensione acida contenente AgCl \s), AgBr (s) e Ag2S (s)’ Considerando le semireazioni elencate,
Cd2+ (aq) + 2e →Cd (s) E° = -0,403 V
AgCl (s) + e →Ag(s) + Cl- (aq) E° = 0,222 V
AgBr (s) + e → Ag (s) + Br-(aq) E°= 0.0713 V
Ag2S (s) + 2 e → 2 Ag (s) + S–²(aq) E°= -0.690 V
selezionare l’ affermazione corretta:
-
- reagisce solo AgCl (s)
- reagiscono AgBr (s) e Ag2S (s)
- reagisce solo Ag2S (s)
- reagiscono AgCl (s) e AgBr (s)
soluzione
il valore del potenziale standard del Cadmio è negativo e quindi agisce da riducente nei confronti dell’argento.Tra i composti di argento, AgCl possiede un potenziale standard positivo ed ha un valore superiore a tutti gli altri per cui la riduzione di AgCl è la reazione che si ha nel recipiente mentre contemporaneamente l’Ag agisce da ossidante nei confronti del cadmio che si scioglie formando Cd+2 secondo la reazione Cd + 2e → Cd+2
45. Per una reazione di ordine zero A →B, la costante cinetica ha le dimensioni di:
-
- concentrazione -tempo-¹
- tempo-¹
- concentrazione
- concentrazione -¹ x tempo-¹
soluzione
la velocità di rezione in questo caso è Va = – dCa/dt =k [Ca]° =k
da cui – ∫dCa=k ∫dt + costante
-Ca= kt +Costante
Ca° – Ca = Kt
Ca°- Ca/t = k
cioè le dimensioni sono concentrazione /tempo cioè concentrazione x tempo-¹
La risposta corretta è la n 1
46. Una soluzione acquosa contenente 1,80 g di PbCl2 viene trattata con un eccesso di Na2S secondo la seguente reazione non bilanciata:Si recuperano per filtrazione 1,00 g di PbS.
PbCl2 + Na2S → PbS + NaCl
si recupera per filtrazione 1,00 g di PbS. Calcolare la resa percentuale della reazione.
- 25,0 %
- 50,3 %
- 64,6 %
- 95,0 %
soluzione
PbCl2 + 2Na2S → PbS +2 NaCl
se da PbCl2 si ottiene PbS da X grammi se ne ottengono 1,00 g
278,1: 239,3 = X : 1 X = 1,162
1,80 : 1,162 =100:x X = 64,6
47. Calcolare il pH di un’acqua saturata con aria (con un contenuto di CO2 (g) di 0,035o % (v/v)) alle vecchie condizioni normali (1,013 x 105 Pa e 298,15 K), sapendo che:
CO2(g) → CO2 (aq) Kp= 0,034 x 10-5 moli /L x Pa
CO2(aq) + H2O(l) → HCO3- + H+(aq) K =4,45 x 10 -7
- 6,5
- 5,6
- 4,9
- 7,3
soluzione
[CO2 aq]/[CO2g] = 0,034x 10-5
CO2(aq) + H2O(l) → HCO3- + H+(aq) K =4,45 x 10 -7
dalle seconda equazione
4,45 x 10-7 = [H+] [HCO3-] / [CO2aq] cioè 4,45 x 10-7 x [CO2] = [H+]²
per calcolare [H+] e quindi il PH occorre calcolare [CO2 aq]
possiamo calcolarlo da [CO2 aq]/[CO2g] = 0,034x 10-5
dove [CO2g] è calcolabile a sua volta da PV=nRT infatti P/RT = n/V
ma n/V non è altro che la concentrazione in moli /l perciò
1,013 x 105 / 8,314 x 298,15 = 1,03 x 105 /2,48 x103
= 40,9 moli/l
[CO2 g] = 4o,9 moli/l ma siccome è al 35% allora
[CO2 g] si ottiene da 100 : 35 =40,9 : X X =[CO2 g]= 14,3 moli/l
dalla relazione [CO2 aq]/[CO2g] = 0,034x 10-5
[CO2aq]=14,3 x 34 x 10-8 = 486 x 10-8
[H+]2 = K x [CO2aq] = 4,45 x 10-7 x 4,86x 10- 8 =21,3 x 10-15 =4,6 x 10-8
[H+] = 8- log 4,6 = 8-0,66 = 7,3
48. In base alla teoria VSEPR, indicare quale molecola presenta una geometria a T:
- BCl2
- NCl3
- PCl3
- ICl3
soluzione

49. Quale delle seguenti condizioni è necessaria affinché si verifichi una collisione tra molecole efficace per una reazione chimica:
I ) orientazione favorevole delle molecole nell’urto
II) energia cinetica sufficiente
III) elevato ΔH di reazione
- condizione I
- condizioni I e II
- condizioni II e III
- le tre condizioni
soluzione
perché le molecole possano reagire è necessario che gli orbitali interessati siano orientati in modo da potersi sovrapporre e che la loro energia cinetica sia tale da permettere urti efficaci per cui devono essere verificate sia la condizione I che quella II.
50. Che cosa si osserva se si immerge una barretta di Cu (s) in una soluzione contenente Zn(NO3)2 0,1 M, AgNO3 0,1 M, Cd(NO3)2 0,1 M e HNO3 0,00 l M?
Ag(aq) +e→ Ag(s) E°= 0,799 V
Zn2+(aq) +2e → Zn(s) E°= -0,763
Cd2+ (aq) + 2e →Cd(s) E=-0,403 V
Cu” (aq) + 2 e → Cu (s) E°= 0,337 V
- si deposita Ag (s)
- non si osserva nulla
- si deposita Zn (s)
- si deposita cd(s)
soluzione
La valutazione dei potenziali standard è molto utile per determinare se una reazione redox possa avvenire in condizioni spontanee o meno. Le specie chimiche che possiedono potenziale più basso tendono a ridurre quelle con potenziale più alto mentre quelle a potenziale più alto tendono ad ossidare quelle a potenziale più basso
dai dati di E° si evince che Cu ha potenziale più alto di Zn e Cd per cui dovrebbe agire da ossidante nei loro confronti e contentporaneamente si dovrebbe ridurre. ciò non è possibile perchè sia Zn che Cd sono già ossidati ed il rame è già nello stato ridotto Cu° . Invece il valore di E° dell’Ag+ è più alto di quello del Cu per cui Ag+ agisce da ossidante nei confronti del Cu e contemporaneamente si riduce. Da ciò è evidente che solo l’Ag+ reagisce con la lamina di rame formando Ag°(s) mentre Cu° si ossida a Cu+2. La risposta corretta è la n.1
- Indicare l’ordine medio di legame tra Cl e O nelle .strutture di risonanza più stabili dello ione CI04-:
- l
- 1,25
- 1,75
- 1,5
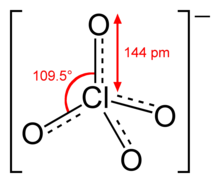
la struttura del clorato ha un atomo centrale (il cloro), quattro atomi di ossigeno legati al cloro con legami pigreco che conferiscono alla molecola un carattere ibrido. Vi sono quindi 3 doppi legami ed un legame singolo quindi 7 elettroni di legame e 4 di non legame per cui l’ ordine di legame è 7-4/2 = 3/2=1,5
52. Cosa si verifica facendo gorgogliare aria in una soluzione contenente HCl 0,1 M, FeCl2 0,005M e CoCl2 0,
05 M
O2 +4H+ +4e → 2H2O E° = 1,229 V
Co+3 +e → Co+2 E°= 1,82 V
Fe+3 + e → Fe+2 E°= 0,771 V
2H+ +2e → H2 E° = 0,000 V
- si forma H2
- non succede nulla
- si forma Fe3+
- si forma C03~
soluzione
La valutazione dei potenziali standard è molto utile per determinare se una reazione redox possa avvenire in condizioni spontanee o meno. Le specie chimiche che possiedono potenziale più basso tendono a ridurre quelle con potenziale più alto mentre quelle a potenziale più alto tendono ad ossidare quelle a potenziale più basso.
dai dati del quesito si evince che il ferro si ossida ad Fe+3 . Nei confronti del Co+2 si comporterebbe dariducente quindi non è possibile avvenga l’ossidazione del Co. L’idrogeno invece non si sviluppa perché reagisce con l’ossigeno dell’aria per produrre H2O.
La risposta corretta è la n.3
53. Quali delle seguenti affermazioni sono esatte per il processo di espansione di un gas ideale nel vuoto I) il processo comporta una variazione di entropia :II) il processo comporta un aumento di entropia III) il processo comporta una diminuzione dell’energia libera di Gibbs IV) il processo può procedere spontaneamente nella direzione inversa
- le quattro affermazioni sono tutte esatte
- sono esatte solo le affermazioni II e III
- sono esatte solo le affermazioni l e IV
- le quattro affermazioni sono tutte errate
soluzione
sappiamo che se un gas si espande nel vuoto il processo è irreversibile.Sappiamo che la variazione di entropia tra due stati A e B è cioè tra lo stato finale e quello iniziale è:
ΔS=0 se A e B sono in equilibrio
ΔS < 0 se la direzione è verso lo stato A
ΔS > 0 se la direzione è verso lo stato B
ovviamente per ΔG irreversibile e quindi dallo stato A passa allo stato finale B e la differenza di entropia è elevata.
L’energia libera o meglio la differenza di energia libera tra i due stati ci indica anch’essa la direzione verso cui avviene il processo essendo
ΔG = ΔH – TΔS dove ΔH = variazione di entalpia e TΔS una parte di energia non utilizzabile per il processo perché serve alla molecola stessa e quindi è una forma di energia interna quindi di natura entropica.
ΔG = 0 se i due stati A e B sono in equilibrio ma ΔG < 0 se il processo dallo stato A a quello B è spontaneo ed il processo di espansione del gas è in effetti un processo spontaneo irreversibile.
La risposta corretta è la n.2
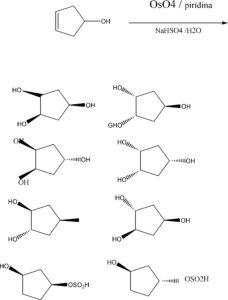
54. Quale dei seguenti composti non dà condensazione aldolica?
- 2,2-dimetilbutanale
- acetofenone
- acetone
- decanale
soluzione
La reazione tra due molecole di aldeide (che possiede un gruppo CHO) o chetone ( che possiede un gruppo CO) che abbiano in posizione α rispetto a carbonile (C=O), e che si combinano tra loro formando una β-idrossialdeide o un β-idrossichetone, viene definita reazione aldolica . Il prodotto della reazione è chiamato aldolo ed è molto instabile per cui può subire l’eliminazione di una molecola di H2O e formare un’aldeide α-β insatura o un chetone α-β insaturo.Pertanto la condizione necessaria perché avvenga una condensazione alcolica è la presenza di un idrogeno in alfa al carbonio che ha il carbossile CO.
si deduce che
CH2–CH2– C(CH3)2—CHO non può subire condensazione alcolica perché in alfa vi sono due gruppi CH3 e nessun Idrogeno
![]()
acetofenone acetone decanale
questi tre composti possiedono l’idrogeno in alfa al gruppo CO e pertanto possono subire condensazione aldolica .
La risposta corretta è la n.1
55. Il pH di una soluzione può essere determinato misurando la concentrazione della forma acida e della forma basica di un indicatore. Sapendo che il blu di bromotimolo ha un valore della K, pari a 10-7,1, determinare il pH di una soluzione in cui il rapporto [forma acida/forma basica] è 1,5:
- 10,2
- 7,90
- 6,90
- 5,80
soluzione
un indicatore è una sostanza debolmente acida che si dissocia Hin == H+ + In- Kin = [H+] [In-] / [HIn]
da cui [H+] = Kin [HIn]/ [In-] pertanto essendo [HIn]/ [In-]=forma acida / forma basica =1,5 si ha
[H+] = 10-7,1 x 1,5 = 1,5 x 10-7 PH = -log[H+] = 7-log 1,5 = 7-0,17= 6,9
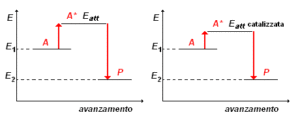
56- Data la reazione esotermica
CH4 (g) + 2 O2 (g) → (g) + 2 H20 (g), indicare quale diagramma rappresenta la relazione tra velocità di reazione e temperatura:
soluzione
- Una soluzione di HCIO 0,1 M e HCI 0,1 M viene titolata con NaOH O,1M, usando metilarancio come indicatore. Quale delle seguenti affermazioni è esatta?
- si titola solo HCI
- si titola solo HCIO
- si tito!a sia HCl che HCIO
- non si titola nessun acido
soluzione
Per quanto riguarda l’ acido HClO essendo un acido debole si ha
HClO ![]() H+ + ClO-
H+ + ClO-
Tuttavia l’ H+ proveniente da HCl che è completamente dissociato e che ha una concentrazione abbastanza elevata (0,1M) fa regredire la dissociazione dell’HClO annullando il contributo di HClO alla concentrazione di H+,per cui in pratica reagisce solo l’ H+ proveniente dalla dissociazione di HCl. .La risposta corretta è la n.1
58. Indicare quale coppia rappresenta il prodotto della seguente reazione:
SOLUZIONE
La prima coppia di prodotti stericamente più stabili
59 La cisteina è un aminoacido che presenta tre costanti acide:
Kai = 10-‘1,70 K~2 = 10-836 Ka3 = 10-108
Indicare a quali gruppi funzionali sono riferite:
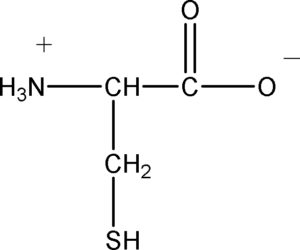
1 ka1 : COOH Ka2 : NH3+ Ka3 : SH
2 Ka1: NH3+ Ka2 : COOH Ka3 : SH
3 ka1 : COOH Ka2 : SH Ka3 : NH3+
4 ka1 : SH Ka2 : COOH Ka3 : NH3+
soluzione
la costante acida più elevata è dovuta all’ acido acetico, la costante basica 10-8,36 è dovuta all’SH mentre quella più basica al gruppo NH3+
la risposta corretta è la n.3
60- se l’Assorbanza di un campione è 0,12 qual è la Trasmittanza ?
soluzione
l’Assorbanza è definita come A= -log T dove T è la Trasmittanza pertanto
T = 10 – 0,12 A T= 10-1 0,88 ma 0,88 è un logaritmo a cui corrisponde il numero 7,59 per cui la trasmittanza è T= 7,59 x 10-1 = 0,76
Giochi della Chimica 2014 Fase nazionale -Classe C
1-Una miscela gassosa di etano e propano occupa un volume di 100 dm³ alle vecchie condizioni normali (298,15 K e 1,013 x 105 Pa). La miscela è bruciata completamente in eccesso di ossigeno (675 dm³ alle stesse condizioni). Dopo la reazione si osserva che i gas residui occupano 500 dm³ (alle stesse condizioni). Determinare la composizione in volume della miscela iniziale di. etano e propano.
-
-
-
-
- etano = 50,0% propano = 50,0%
- etano = 25,0% propano = 75,0%
- etano = 75,0% propano = 25,0%
- etano = 100% propano = 0,
-
-
-
soluzione
Moli di gas iniziali = pV/RT = 1 atm x 100/0.08206 x 298.15=4.09
moli di ossigeno =650/24,4= 27,6
moli di gas alla fine della reazione = 500/24,4 =20,4 moli
le moli rimaste sono la somma di CO2 e di H2O formate nella combustione provenienti sia da C2H6 che da C3H8 che comprendono anche le moli di ossigeno incombuste che sono 27,6 – 20,4 =7,2moli quindi le moli totali di CO2 ed H2O formate sono 20,4 -7,2=13,2 moli di gas presenti alla fine delle reazioni
C2H6 + 3,5O2 ==> 2CO2 + 3 H2O
C3H8 + 5O2 ===> 3CO2 + 4H2O
Le moli residue sono 20,4 – l’ 0ssigeno rimasto incombusto
quindi 2X +3 Y +3X + 4 Y + 27 – 3,5 X – 5 Y = 20,4
5X -3,5 X + 7 Y -5Y +27 =20,4
da questa espressione secondo la traccia fornita si dovrebbe ottenere Y=2 e quindi X=2 con risultato che %(V/V) = 50%
2. Utilizzando un cromatografo ionico con una colonna solfonata in forma acida e HCI 0,05 M come fase mobile, stabilire l’ordine di eluizione di Na + K+ li+ Mg 2+·,
- K+ Na+ li+ Mg+2
- Mg+2 K+ Na+Li+
- Li+ Na+K+ Mg+2
- Na+ K+ Li+ Mg+2
soluzione
l’eluizione avviene prima per gli ioni con massa più piccola quindi l’ordine di eluizione è
Li+ Na+ K+ Mg+2
3. Per la reazione A -+ B, a T = 25,0 “C, ΔH° = -23,99 Kcal/mol ΔG° = -3,0 Kcal/mol
Assumendo che ΔH° e ΔS° rimangano costanti nell’ intervallo di temperatura considerato, calcolare la costante di equilibrio a T = 50,0 °C.
- 5,1
- 6,9
- 158,2
- 79,3
soluzione
la relazione che lega ΔG° a ΔS° è ΔG° = ΔH° – TΔS° per cui possiamo calcolare ΔS° a 298 ° K
-0,3 = -23,99 – 298 x ΔS° da cui ΔS°= -23,99 +3 / 298 = 20,99 / 298 = 7,04 x 10 -²
poichè secondo quanto ci è dato nè ΔS° nè ΔH° variano con la temperatura allora possiamo calcolare
ΔG° alla temperatura di 50 gradi 323 K
ΔG° = ΔH° – TΔS° ΔG°= -23,99 – 323x 7,04 x 10 -² = -1,93 Kcal/mol T
poichè lnK = –ΔG°/ RT allora lnK = 1,93 /(1,984x 10-³x 323) = 1,23 pertanto K = 6,89 =6,9
4. Calcolare quanti grammi di acqua si possono ottenere dalla decomposizione di 0, 100 g di MgCl2- 6 H20.
- 0,00881 g
- 0,0532 g
- 0,0189 g
- 0,0243 g
soluzione
MgCl2.6H2O : 6H2O = 0,1 :X
203,3 : 108 = 0,1 :X X = 108 x 0,1 /203,3 = 0,0532
5. Nella seguente sequenza di reazioni, indicare i reagenti X e Y e il prodotto intermedio A:
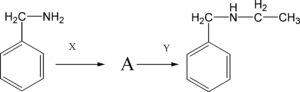
per aggiungere due atomi di carconio usiamo l’aldeide acetica che con l’ammina forma una immina che per successiva
riduzione fornisce il prodotto
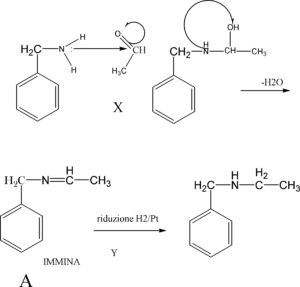
la risposta corretta è la n. 3
- X = formaldeide; A = un amminoalcool; Y=NaBH4
- X = acido acetico; A = un’ammide; Y= 12 MHCI
- X = acetaldeide; A = un’immina; Y = H2/Pt (l atm)
- X = acetone; A = un’amminale; Y = H3P04 a caldo6.
6-Calcolare il pH di un’acqua saturata con aria [con un contenuto di C02(g) di 0,035% (v/v)] alle vecchie condizioni normali (1,013 x Pa e 298,15 K), sapendo che:
-
-
- C02(g) ~ C02(aq) K = 0,034’10-5 mol L-l Pa-1
- C02(aq) + H20(l) ~ HC03 -(aq) + H+(aq) K = 4,45 ’10-7
-
-
- 6,5
- 5,6
- 4,9
- 7,2
soluzione
[CO2 aq]/[CO2g] = 0,034x 10-5
CO2(aq) + H2O(l) → HCO3- + H+(aq) K =4,45 x 10 -7
dalle seconda equazione
4,45 x 10-7 = [H+] [HCO3-] / [CO2aq] cioè 4,45 x 10-7 x [CO2] = [H+]²
per calcolare [H+] e quindi il PH occorre calcolare [CO2 aq]
possiamo calcolarlo da [CO2 aq]/[CO2g] = 0,034x 10-5
dove [CO2g] è calcolabile a sua volta da PV=nRT infatti P/RT = n/V
ma n/V non è altro che la concentrazione in moli /l perciò
1,013 x 105 / 8,314 x 298,15 = 1,03 x 105 /2,48 x103
= 40,9 moli/l
[CO2 g] = 4o,9 moli/l ma siccome è al 35% allora
[CO2 g] si ottiene da 100 : 35 =40,9 : X X =[CO2 g]= 14,3 moli/l
dalla relazione [CO2 aq]/[CO2g] = 0,034x 10-5
[CO2aq]=14,3 x 34 x 10-8 = 486 x 10-8
[H+]2 = K x [CO2aq] = 4,45 x 10-7 x 4,86x 10- 8 =21,3 x 10-15 =4,6 x 10-8
[H+] = 8- log 4,6 = 8-0,66 = 7,3
7-Gli ioni dei metalli di transizione sono spesso colorati in soluzione acquosa:
- perché i raggi ionici sono compresi tra 140 e 210 pm
- perché sono idratati solo debolmente
- perché presentano orbitali d semipieni
- nessuna delle tre
soluzione
I colori dei metalli di transizione sono i colori complementari delle radiazioni assorbite. Ad esempio,le soluzioni acquose di [Cu(H2O)6] 2+ appaiono di colore blu, a causa dell’assorbimento di una radiazione tra ca. 600 e 1000 nm (λmax 800 nm) nella regione che va dal giallo all’IR dello spettro visibile. Ciò avviene perchè i metalli di transizione possiedono orbitali d semipieni che possono coordinare l’H2O e dare colori caratteristici.
8. Per la reazione A → B, a T = 25,0°C,
Assumendo che ΔH° e ΔS° rimangano costanti nell’ intervallo di temperatura considerato calcolare, se la [B] iniziale è nulla,la % di conversione di A in B a T= 50°C
- 87,3
- 79,1
- 67,2
- 98,9.
soluzione (vedi esercizio 3)
la relazione che lega ΔG° a ΔS° è ΔG° = ΔH° – TΔS° per cui possiamo calcolare ΔS° a 298 ° K
-0,3 = -23,99 – 298 x ΔS° da cui ΔS°= -23,99 +3 / 298 = 20,99 / 298 = 7,04 x 10 -²
poichè secondo quanto ci è dato nè ΔS° nè ΔH° variano con la temperatura allora possiamo calcolare
ΔG° alla temperatura di 50 gradi 323 K
ΔG° = ΔH° – TΔS° ΔG°= -23,99 – 323x 7,04 x 10 -² = -1,93 Kcal/mol T
poichè lnK = –ΔG°/ RT allora lnK = 1,93 /(1,984x 10-³x 323) = 1,23 pertanto K = 6,89 =6,9
9 – 3,00 g di CaC03 reagiscono con un eccesso di CH3COOH secondo la reazione, da bilanciare:
CaC03 + CH3COOH→ Ca(CH3COO)2 + CO2 + H2O
Se tutto il carbonato viene consumato nella reazione, calcolare quanta CO2 e Ca(CH3COO)2 si formano:
- CO2 = 1,32 g; Ca(CH3COO)2 = 4,74 g
- CO2 = 4,74 g; Ca(CH3COO)2 = 1,32 g
- CO2 = 4,74 g; Ca(CH3COO)2 = 4,74 g
- CO2 = 1,32 g Ca(CH3COO)2 = 2,64 g
soluzione (vedi esercizio 42)
CaCO3 : CO2 = 3.00 g :X X1=44 x3 /100 = 1,32 g CO2
CaCO3 ; Ca(CH3COO)2 = 3,0 :X2 X2 = 158,2 x 3,00 / 100 = 4,74
risposta corretta n. 1
10 Calcolare la concentrazione molare di una soluzione di Na3P04 sapendo che 23,5 mL sono titolati con 12,0 mL di HCI 0,120 M, utilizzando come indicatore fenolftaleina:
- 0,089
- 0,183
- 0,061
- 0,122
soluzione
12,0 x 0,120 = 1,44 mmoli di HCl
quindi
1,44 = 23,5 x M olarità di Na3PO4 cioè M= 1,44 / 23,5 = 0,061
la risposta corretta è la 3
11 indicare quale composto si forma dalla reazione
CH3COCH3 + CH3 CH2CNHCH2CH3 +H+
12. Per una reazione di ordine zero A ~ B, la costante cinetica ha le dimensioni di:
- concentrazione’ tempo-1
- tempo-1
- concentrazione
- concentrazione-1. tempo-1
soluzione (vedi eserc 45)
la velocità di rezione in questo caso è Va = – dCa/dt =k [Ca]° =k
da cui – ∫dCa=k ∫dt + costante
-Ca= kt +Costante
Ca° – Ca = Kt
Ca°- Ca/t = k
cioè le dimensioni sono concentrazione /tempo cioè concentrazione x tempo-¹
13. la reazione: CaC03 (s)→ CaO (s) + CO2 (g) è completamente spostata a destra . In un recipiente da 1 litro vengono aggiunti 0,55 g di CaCO3 e la temperatura è potata a 900 °C . Calcolare la pressione dell’anidride carbonica nel recipiente.
- 1,040 atm
- 0,529 atm
- 0,265 atm
- 0,0529 atm
soluzione
CaCO3: CO2 = 0,55: X X= 0,55 x 44 / 100 = 0,242g di CO2 provenienti da 0,55 g di CaCO3
la pressione P della CO2 in un volume di 1 litro si calcola dalla equazione di stato dei gas PV = nRT perciò n=moli R= costante dei gas T temperatura K° P= pressione dove V=1 litro T = (273+900)= 1173 n=0,242 /44 =0.0055 moli CO2
P= 0,00055 x 0,0821 x 900(+273)/1 = 0,529
14. Si aggiunga un eccesso di Cd metallico a una sospensione acida contenente AgCI (s), AgBr (5) e Ag2S (5)’ Considerando le semireazioni elencate, selezionare l’affermazione corretta:
- Cd+2(aq) + 2e→ Cd (s) E° = -0,403 V
- AgCl(s)+ e → Ag(s) + Cl-(aq) E°= 0,222 V
- AgBr (s) + e→ Ag (s) + Br-(aq) E° = 0.0713 V
- Ag2S (s) + 2 e → 2 Ag (s) + S-2 (aq) E °= -0.690
- si scioglie solo AgCI (s)
- si scioglie AgBr (5) e Ag2S (s)
- si scioglie solo Ag2S(s)
- si scioglie AgCI (s) e AgBr (s)
soluzione
il valore del potenziale standard del Cadmio è negativo e quindi agisce da riducente nei confronti dell’argento.Tra i composti di argento, AgCl possiede un potenziale standard positivo ed ha un valore superiore a tutti gli altri per cui la riduzione di AgCl è la reazione che avviene mentre contemporaneamente l’Ag agisce da ossidante nei confronti del cadmio Cd + 2e → Cd+2
la risposta corretta è la n.1
15. Per un sistema in equilibrio termico. la probabilità p, che la singola molecola si trovi nello stato i-esimo, di energia Ei, corrisponde
- Pi = Ei/ kT
- Pi= 1-e-ki/KT
- Pi=(e-ki/KT)
- Pi =e-ki/KT / ∑e-ki/KT
soluzione
le prime tre formule si riferiscono alla distribuzione statistica dell’energia ma non tengono conto che la molecola iesima si trovi assieme alle altre molecole quindi la probabilità di distribuzione dell’energia in una molecola dipende anche dalle molecole totali e quindi la distribuzione di una singola particella cioè dell’energia dell’iesima particella è una distribuzione relativa ed è data dall’ equazione 4
16 Un minerale impuro contiene Al2(C03)3 Per reazione di 2,50 kg di minerale con un eccesso di HCl gassoso si ottengono 0,55 kg AlCI3, secondo la seguente reazione da bilanciare AL2(C03)3 + HCl → AlCl3+ CO2 + H2O.
Calcolare la percentuale in massa di Al2((CO3)3 presente nel minerale impuro.
- 22,0%
- 11,0 %
- 38,6 %
- 19,3%
soluzione
Al2(CO3)3 + 6 HCl →2 AlCl3 + 3CO2 + 3H2O
Al2(CO3)3 : 2 AlCl3 = X : o,55Kg = 550 g
(53,96+ 120+60 )= X : 550
233,96 :133,3 = X : 550 X= 965,3 g
2500g :965,3 =100 😡 X = 38,61 %
17. Un estratto di tè è stato analizzato mediante HPLC, con rivelatore spettrofotometrico, colonna di silice derivatizzata con gruppi C8(ottile) e fase mobile tampone (pH 8)/acetonitrile (90:10 v/v). Il cromatogramma mostra la presenza di teofillina (Ka= 10-8,81), caffeina( Ka = 10-10,4) , teobromina (Ka = 10-7,89). Indicare l’ordine d eluizione:
- teofillina, caffeina, teobromina
- caffeina, teofillina, teobromina
- teobromina ,caffeina, teofillina
- teobromina, teofillina, caffeina
soluzione
il cromatogramma che si ottiene ha la seguente forma:
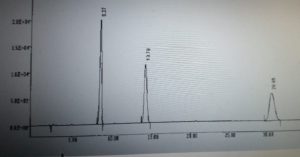
teobromina (8,27 min), teofilina (13,79 min) e caffeína (29,96 min).in una colonna Inertsil ODS-3 (150×4 mm, 5 μm), fase mobile acido acetico 1% + acetonitrile a pH8
(95:5, v/v), flusso di 1 mL/min rivelatore Uv 273 nm.
Se confrontiamo i valori di Ka in senso decrescente notiamo la sequenza Teobromina,teofillina,caffeina. Ciò significa che la caffeina ha un coefficiente di distribuzione fase fissa-fase mobile più elevata degli altri a causa del tipo di colonna e del valore di Ka della caffeina. Ovviamente la teobromina con Ka più elevato viene trattenuto di meno ed eluisce prima poi viene eluita la teofillina con Ka più basso di quello della teobromina ma più alto della caffeina che viene eluita per ultima. Le altezze dei picchi sono proporzionali alla quantità.
18. Indicare la lunghezza d’onda di un fotone con energia 5,25 ’10-19 J
velocità della luce c = 2,997925 x 108 cm/s costante di Planck. h = 6,62607 ’10-34 J-s
- 3,78 x 10– 7 m
- 2,64 x 106m
- 2,3 8 x 1023 m
- 4,21 x 10-24 m
soluzione
L’energia di un fotone è data dall’equazione di Einstein E= h ν dove ν è la frequenza della radiazione
pari a C/λ dove λ è la lunghezza d’onda pertanto
5,25 x 10-19 J = 6,62607 x 10-34 x 2,9997925 x 108 / λ da cui
λ = 6,62607 x 10-34 x 2,9997925 x 108/5,25 x 10-19 λ = 3,78 x 10-7 m
la risposta esatta è la n.1
- Una soluzione di HCIO 0,1 M e HCl 0,1 M
viene titolata con NaOH 0,1 M, usando merilarancio come indicatore. Quale delle seguenti affermazioni è esatta?
- si titola solo HCI
- si titola solo HCIO
- si titola sia HCI che HCIO
- non si titola nessun acido
soluzione
Sappiamo che la titolazione di un acido è una procedura che misura la quantità di H+ in soluzione. HClO è un acido debole e manda in soluzione una piccola quantità di ioni H+. L’acido cloridrico è invece un acido forte e quiì ha una concentrazione abbastanza alte, per cui l’H+ provenienta da questo acido fa regredire la dissociazione di HClO e pertanto l’H+ in soluzione proviene esclusivamente da HCl.
La risposta corretta è la n 1
20. Analizzando le seguenti coppie di composti indicare quali delle relazioni di isomeria indicate nelle risposte (in maniera non ordinata) è corretta:
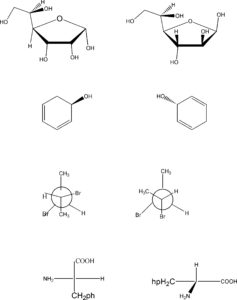
- isomeri costituzionali; diastereoisomeri; enantiorneri; isomeri conformazionali
- stessa molecola; isomeri cis-trans; isomeri costituzionali; enantiomeri
- diastereoisomeri; diastereoisomeri; isomeri costituzionali; enantiomeri
- enantiomeri; isomeri conformazionali diastereoisomeri; enantiomeri
soluzione
( per una spiegazione vedi la lezione sulla stereoisomeria)
sono isomeri costituzionali diastereoisomeri,enantiomeri,isomeri conformazionali
la risposta corretta è la n. 1
21 L’assorbanza di un campione è 0.12. Qual è la sua trasmittanza?
- 0,76
- 1,32
- 1,13
- -0.12
soluzione
l’Assorbanza è definita come A= -log T dove T è la Trasmittanza pertanto
T =10-12 A
T= 10-¹ 0,88 ma 0,88 è un logaritmo a cui corrisponde il numero 7,59 per cui la trasmittanza è T= 7,59 x 10-¹ = 0,76
22, Che cosa si osserva se immerge una barretta di Cu (S) in una soluzione contenente ZnCl2 o.i M, AgN03 0,1 M, Cd(NO3)2 o.1M e HO3 0,001 M?
Ag(aq) +e→ Ag(s) E°= 0,799 V
Zn2+(aq) +2e → Zn(s) E°= -0,763
Cd2+ (aq) + 2e →Cd(s) E°=-0,403 V
C+2 (aq) + 2 e → Cu (s) E°= 0,337 V
- si deposita Ag (s)
- non si osserva nulla
- si deposita Zn (s)
- si deposita Cd (s)
soluzione
La valutazione dei potenziali standard è molto utile per determinare se una reazione redox possa avvenire in condizioni spontanee o meno. Le specie chimiche che possiedono potenziale più basso tendono a ridurre quelle con potenziale più alto mentre quelle a potenziale più alto tendono ad ossidare quelle a potenziale più basso
dai dati di E° si evince che Cu ha potenziale più alto di Zn e Cd per cui dovrebbe agire da ossidante nei loro confronti e contentporaneamente si dovrebbe ridurre. ciò non è possibile perchè sia Zn che Cd sono già ossidati ed il rame è già nello stato ridotto Cu° . Invece il valore di E° dell’Ag+ è più alto di quello del Cu per cui Ag+ agisce da ossidante nei confronti del Cu e contemporaneamente si riduce. Da ciò è evidente che solo l’Ag+ reagisce con la lamina di rame formando Ag°(s) mentre Cu° si ossida a Cu+2. La risposta corretta è la n.1
23. Quale dei seguenti composti non dà condensazione aldolica?
- 2,2-dimetilbutanale
- acetofenone
- acetone
- decanale
soluzione
La reazione tra due molecole di aldeide (che possiede un gruppo CHO) o chetone ( che possiede un gruppo CO) che abbiano in posizione α rispetto a carbonile (C=O), e che si combinano tra loro formando una β-idrossialdeide o un β-idrossichetone, viene definita reazione aldolica . Il prodotto della reazione è chiamato aldolo ed è molto instabile per cui può subire l’eliminazione di una molecola di H2O e formare un’aldeide α-β insatura o un chetone α-β insaturo.Pertanto la condizione necessaria perché avvenga una condensazione alcolica è la presenza di un idrogeno in alfa al carbonio che ha il carbossile CO.
si deduce che
CH3–CH2– C(CH3)2—CHO non può subire condensazione alcolica perché in alfa vi sono due gruppi CH3 e nessun Idrogeno


![]()
acetofenone acetone
questi tre composti possiedono l’idrogeno in alfa al gruppo CO e pertanto possono subire condensazione aldolica .
La risposta corretta è la n.1
24. La reazione 2N02 (g) →2NO (g) + O2 (g) è del seconda ordine rispetto a NO2 e la costante di velocità a 300°C è 0,543 / M S. Indicare il tempo di dimezzamento della reazione quando la concentrazione iniziale di NO2 è 0,450 M (alla stessa temperatura):
- 4,09 s
- 26 s
- 87 s
- 280 s
soluzione
Una reazione chimica ha una cinetica del secondo ordine quando la somma degli esponenti delle concentrazioni delle specie che partecipano alla reazione è due.Possiemo distinguer 2 casi: il primo quando i reagenti sono identici, come nel caso di NO2 cioè A+A → P o 2A→ P la velocità di reazione si può scrivere
d[A]dt =−k[A][B] d[A]dt=−k[A][B]
dove l’ordine di reazione rispetto ad ogni specie reagente è 1.Ciò vuol dire che se raddoppiamo la concentrazione di A senza modificare B allora la velocità raddoppia. Se raddoppiamo la velocità sia di A che di B la velocità diventa quadrupla e se raddoppiamo A e quadruplichiamo B allora la velocità viene aumentata di un fattore 2 x 4 =8.
Il tempo di dimezzamento è il tempo nel momento in cui la [A] cioè [NO2 ] diviene la metà di quella iniziale.
t1/2 = 1/ k [A]0
pertanto
t1/2 = 1/ 0,543 x 0,450
t1/2 = 4,09 s
25. Una miscela di AgI e AgCI pesa 2,50 g. Sapendo che il contenuto di Ag nella miscela è 1,44 g, calcolare la composizione della miscela.
- AgI = 39,2% AgCl = 60,8%
- AgI = 50,0% AgCl = 50,0%
- AgI ,,:o 75,5% AgCl = 24,5%
- AgI = 60,8% AgCl = 39,2%A
soluzione
per risolvere questo quesito occorre impostare un sistema di 2 equazioni a 2 incognite infatti
X + Y = 2,50
la seconda equazione si ricava ricordando che da 1 di AgI si ottiene Ag quindi dalla quantità X iniziale se ne otiene una quantità sconosciuta perciò
AgI : Ag = X : quantità sconosciuta da cui quantità sconosciuta è data da X x Ag / AgI
analogo ragionamento seguiamo per Y e si ottiene Y x Ag / AgCl
Xx Ag / AgI (quantità di Ag che si ottiene da X di AgI)
X x 107,8 / 2347
Xx Ag / AgCl (quantità di Ag che si ottiene da Y di AgCl)
quindi Xx Ag/AgI + Y x Ag / AgCl = 1,44 g
passando ai numeri si ha
X x 107,8 / 234,7 + Y x 107,8 / 143,3 = 1,44
da cui X x 107,8 x 143,3+ Y x 107,8 x 234,7 = 1,44 x 234,7 x 143,3 =48308
X x 15447,74 + Y x 25300,6 =48308e dividendo per 15447,74
X + 1,6378 Y = 3,127
ma X = 2,5 – Y 2,5 – Y + 1.6378 Y = 3,127 2,5 + ( 1,6378 -1 ) Y = 3,127
2,5 + 0,6378 Y = 3,127 Y = 3,127- 2,5 /0,6378 = 0, X= 0,627 /0,6378=0,98
Y= 0,98 g
X= 1,52 g
quindi la percentuale di AgI nella miscela è 2,5 : 1,52 = 100 :X X= 60,8 %
2,5 : 0,98 = 100 : X X = 39,2
risposta esatta la n.4
26. A quale velocità (m/s) si deve muovere un oggetto di massa 10,0 mg per avere una lunghezza d’onda di de Broglie di 3,3 x 10-31m? (costante di Planck, h = 6,62607 ’10-34 J-s)
- 4,1
- 1,9 x 10-¹¹
- 2 x 10²
- 3,3 x 10-42
soluzione
λ = h/ mv dove h = costante di Plank m = massa del corpo in movimento e V = velocità di moto
quindi 3,3 x 10-31 = 6,62607 x 10-34 / 10 x V V= 2,0 x 10² m/s
l’equazione di de Broglie mette in relazione la lunghezza d’onda al moto di un corpo .
27 Il pH di una soluzione può essere determinato misurando la concentrazione della forma acida e della forma basica di un indicatore. Sapendo che il blu di bromotimolo ha un valore della K, pari a 10-7,1, determinare il pH di una soluzione in cui il rapporto [forma acida]/[forma basica] è 1,5.
- 10,2
- 7,90
- 6,90
- 5,803
soluzione
un indicatore è una sostanza debolmente acida che si dissocia Hin == H+ + In- Kin = [H+] [In-] / [HIn]
da cui [H+] = Kin [HIn]/ [In-] pertanto essendo [HIn]/ [In-]=forma acida / forma basica =1,5 si ha
[H+] = 10-7,1 x 1,5 = 1,5 x 10-7 PH = -log[H+] = 7-log 1,5 = 7-0,17= 6,9
- Quanti prodotti di diclorurazione sono possibili per il n-butano (considerando anche i possibili stereoisomeri)?
- 16
- 11
- 12
- 10
soluzione
le posizioni del cloro dopo diclorurazione sono : 1-2 1-3 1-4 2-3 2-4 ovviamante essendo possibili per ogni molecola diclorurata sia l’isomero cis che l’isomero trans i prodotti diclorurati sono in tutto 10.
risposta esatta n. 4
29 Data la reazione CH4 + 2 O2 → CO2+ H2O indicare quale dei seguenti diagrammi rappresenta la relazione tra velocità di reazione e temperatura.
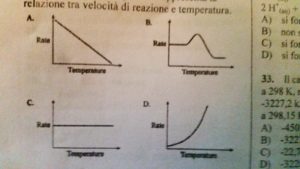
soluzione
dai dati della reazione si evince che un aumento di temperatura fa aumentare la velocità di reazione in modo esponenziale come ci mostra la relazione di Arrhenius k = Ae-Ei/RT.
30. Calcolare la massima quantità di miscela di cloruro di sodio e ioduro di sodio al 12,0% in sodio, che si può ottenere avendo a disposizione 10,0 g del primo e 20,0 g del secondo:
- 25,0 g
- 30,0 g
- 15,0 g
- non è possibile ottenere una miscela con questa percentuale
31. Indicare quale coppia rappresenta il prodotto della seguente reazione:
soluzione
per motivi sterici i prodotti che si ottengono sono indicati nella soluzione A
32 Cosa si verifica facendo gorgogliare aria in una soluzione contenente HCl 0, 1 M, FeCl2 0,005M CoCl2 0,005M
O2(g) + 4H+(aq) + 4e → 2H2O E°= 1,299 V
Co+3 (aq)+ e → Co+2(aq) E° = 1,82 V
Fe+3(aq) + e → Fe+2(aq) E° = 0,771 V
2H+(aq) + e → H2(g) E° = 0,000
- si forma H2
- non succede nulla
- si forma Fe3+
- si forma Co3+
soluzione
dai valori di E° si evince che si ossida il Fe+2
infatti le ossidazioni possibili sono Fe+2 → Fe+3 + e E°= – 0,771 V
Co+2 → Cò+3 +e E°= – 1,82 V
H2 → 2 H+ + 2 e E°= 0.000 V
ed è chiaro che l’ossidante ossigeno E° = 1,299 ossida prima il Ferro poi il cobalto poi l’idrogeno
33. Il calore di combustione dell’acido benzoico a 298 K, misurato in una bomba calorimetrica, è -3227,2 kJ moli-¹, Calcolare il ΔH di combustione a 298,15 K (considerare ideali i gas):
soluzione
sappiamo che la reazione tra H e T è dta da Q= Cp ( T2-T1)
pertanto alla temperatura di 298,15 K si ha Cp= – 3227,2 / 298,15 =-10,82
-10,82 x 0,15 = -1,62 quindi essendo Q=ΔH ΔH2=ΔH1+ Cp(T2-T1)=- 3227,2 – 1,62 = -3228,8
34 Indicare quale tra le seguenti specie NON è aromatica:
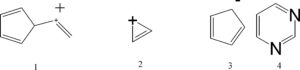
soluzione
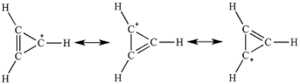 analogo discorso si può fare con lo ione 4 che è l’anione ciclopentadienilico in cui gli elettroni si delocalizzano come si vede in figura.
analogo discorso si può fare con lo ione 4 che è l’anione ciclopentadienilico in cui gli elettroni si delocalizzano come si vede in figura.- In base alla teoria VSEPR, indicare quale molecola presenta una geometria a T.
- BCl3
- NCl3
- PCl3
- ICl3
soluzione

36. Calcolare il potenziale elettrico a 25°C della cella galvanica a concentrazione:
Ag/AgN03 (aq. 0,0200 mol kg-l) // AgN03 (aq. 0,200 mol kg-ì) / Ag (considerare ideali le soluzioni)
Ag+ +e → Ag(s) E° = 0,799 V
- il potenziale è nullo
- 59,2 mV
- 29,5 mV
- 592 mV4rg
soluzione
Lf.e.m. di una cella galvanica è ΔE = ΔE° +RT/nF log [ione elettrodo +] / [ ione elettrodo negativo]
Nel caso specifico ΔE° =0 pertanto
ΔE = RT/nF log [ione elettrodo +] / [ ione elettrodo -]
l’elettrodo a potenziale più alto, ovvero l’elettrodo positivo è quello con concentrazione più elevata perciò
essendo RT/nF a temperatura di 273K = 0,05915 si può scrivere
ΔE =0,05915 log [0,2] / [ 0,02] ΔE = 0,05915 x log 10 = 0,05915 V = 59,15 mV
37. Una soluzione acquosa contenente 1,80 g di PbCl2 viene trattata con un eccesso di Na2S secondo la seguente reazione non bilanciata:
PbCl2 + Na2S -+ PbS + NaCl
Si recuperano per filtrazione 1,00 g di PbS. Calcolare la resa percentuale della reazione:
- 25,0%
- 50,3%
- 64,6%
- 95,0%
soluzione
la reazione bilanciata è PbCl2 + Na2S -+ PbS +2 NaCl
se da PbCl2 si otiene PbS da 1,8 g se ne ottengono X g di PbS
278,1 : 239,3 = 1,8 :X X = 1,549 g
In teoria avremmo dovuto ottenere 1,549 g di PbS ma invece ne otteniamo 1 g quindi la resa in % è calcolata da 1,549 g :1,000 = 100 : X X= 64,56
La resa è del 64,56%
38. Quale delle seguenti condizioni è necessaria affinché si verifichi una collisione tra molecole efficace per una reazione chimica:
I) orientazione favorevole delle molecole nell’urto
II) energia cinetica sufficiente
III) elevato ΔH di reazione
- condizione I
- condizioni I e II
- condizioni II e III
- le tre condizioni
soluzione
perché le molecole possano reagire è necessario che gli orbitali interessati siano orientati in modo da potersi sovrapporre e che la loro energia cinetica sia tale da permettere urti efficaci per cui devono essere verificate sia la condizione I che quella II.
39. Calcolare il potenziale standard della coppia Au +3 (aq) + 2 e–+ Au +1(aq) utilizzando le seguenti semireazioni
Au +3 (aq) + 3 e–+ Au(s) E° = 1,50 V
Au + (aq) + e–+ Au(s) E° = 1,68 V
- 1.41 V
- 0.78 V
- -0.69 V
- 1,21 V
soluzione
le reazioni da considerare sono :
Au +3 (aq) + 3 e–+ Au(s) E° = 1,50 V
Au(s) → Au + (aq) + e– E° = – 1,68 V
__________________________ sommando e semplificando
Au +3 (aq) + 2e →Au + (aq) E° = da calcolare
sapendo che per ogni semireazione l’energia in gioco è nFE° si ha
n1FE°1 + n2FE°2 = nFE°reazione finale dividendo tuto per F si ha n1E°1 + n2 E°2 =n E°finale
3 x 1,50 – 1,68 = 2 E° da cui E° = 4,5 – 1,68 /2 = 1,41 V
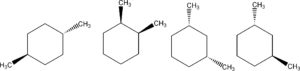
40. Quale tra le seguenti molecole è chirale?
1 2 3 4
soluzione
sono dette chirali quelle molecole che non sono sovrapponibili alla propria immagine speculare mediante rotazioni e/o traslazioni per esempio la molecola in figura

è chirale. Infatti il C centrale è legato con i 4 legami ad atomi e un gruppo atomico diversi tra loro. Quindi ricordando che è chirale una molecola che presenta un atomo chirale, cioè legato a 4 atomi o gruppi atomici diversi ed osservando le molecole indicate sopra, possiamo notare che la molecola n.4 è la sola ad essere chirale, infatti la n.1 non ha alcun atomo di C chirale, e la n2 e la n.3 che sembrano uguali alla n.4 non possiedono un C chirale perché i 2 gruppi CH3 stanno dalla stessa parte cioè sopra e sotto il piano mentre la n. 4 possiede i 2 gruppi CH3 uno sopra ed uno sotto il piano come indicato dalla scrittura dei legami.
41 tra le molecole seguenti:
I) metano II) acetone III) acqua IV) anidride carbonica
quali possiedono un momento di dipolo permanente nullo?
- tutte
- metano e anidride carbonica
- solo il metano
- nessuna
soluzione
Si ha un momento dipolare quando si ha una separazione di cariche. Le possiamo osservare sia in un legame ionico che in uno covalente. Il momento dipolare ha origine dalle differenti elettronegatività degli atomi e più grande è la differenza più grande è il momento dipolare, tuttavia anche la distanza tra gli atomi è uno dei fattori che determinano l’entità del momento dipolare.
μ =∑i qi ri dove μ→ è il vettore momento dipolare, q la quantità di carica dell’iesimo ione e r la distanza tra i centri di carica
il momento dipolare si esprime i Debay
nel caso in esame CO2 non presenta momento di dipolo, anche se le cariche elettriche del legame CO sono spostate verso l’ossigeno in quanto i vettori sono uguali e diretti in senso opposto. L’acqua invece è una molecola polare con un momento dipolare abbastanza netto, infatti i due vettori sono orientati nella stessa direzione.
per quanto riguarda il metano dobbiamo dire che vi sono geometrie molecolari simmetriche, mostrate nella seguente figura che non possono avere momento dipolare e
la struttura tetraedri del metano è una di queste quindi il metano NON possiede momento dipolare.
Si deduce che la risposta al quesito è la n. 2
42. In gascromatografia la risoluzione tra due picchi si definisce come R = (√N /4 ) (γ-1) dove N è il numero di piatti teorici e γ è il rapporto delle velocità dei due componenti. Per aumentare R da 1 a 1,5 di quanto deve essere aumentato N?
- 4,00
- 2,25
- 2,00
- 3,00
soluzione
rimanendo costanti gli altri parametri si ha
R2 = √N2 da cui
(1,5)2 = N N= 2,25
43. Indicare l’ordine medio di legame tra Cl e O nelle strutture di risonanza più stabili dello i on e CIO4- :
- 1
- 1,25
- 1,75
- 1,5
soluzione

la struttura del clorato ha un atomo centrale (il cloro), quattro atomi di ossigeno legati al cloro con legami pigreco che conferiscono alla molecola un carattere ibrido. Vi sono quindi 3 doppi legami ed un legame singolo quindi 7 elettroni di legame e 4 di non legame per cui l’ ordine di legame è 7-4/2 = 3/2=1,5
44. Dato il seguente composto, indicare quale delle strutture a separazione di carica riportate sotto N0n rappresenta una sua formula di risonanza
1 2 3 4
soluzione
la struttura n. 2 non può essere una struttura di risonanza perché la carica negativa sul C1 non è compatibile col doppio legame
45- Qual è la variazione di potenziale chimico nella compressione dell’azoto da 50,0 L a 20,0 L, alla temperatura di 25°C? (considerare ideale il gas)
- 2,27 kJ/ m
- 0,0227 kJ/ m
- 12,2 kJ /mol
- 122 kJ /mol
soluzione
sappiamo che il potenziale chimico di un gas ideale è
μi= μ0+RTln (Pi /P0)
Δμi = Δμ0 + RT [ln(pi/po) – ln(pi/p0)= Δμ0 + RT [ln(pi/po) + ln(pi/p0)]
Δμi = RT 1,7509 = 2250 j /mol = 22,51 KJ/mol
46. L’idrogeno legato a un atomo di carbonio, in particolare se ibridato Sp3, ha in genere una bassa acidità. Disporre i seguenti composti carbonilici in ordine di acidità crescente rispetto agli idrogeni indicati:
1 2 3 4
soluzione
l’atomo di idrogeno più facilmente mobile, e quindi più acido, è l’idrogeno in alfa al carbonile . Pertanto in ordine di acidità crescente. il meno acido è il n.3 che è in beta rispetto al CO, poi il n.4 a causa della presenza dell’ossigeno legato al CH3 che influenza l’apertura dell’anello, e quindi il n 1 che ha un’acidità inferiore al n.2 che è in alfa a 2 gruppi CO Pertanto l’idrogeno più acido è quello presente nella formula n 2.
- Sapendo che, alla temperatura di 100°C, la tensione di vapore dell’acqua è 1,013 bar e il ΔHvap 40,8 kJ /mol, la tensione di vapore a 50° C si può stimare pari a:
- 1,130 bar
- 0,130 bar
- 0,026 bar
- 0,260 bar
soluzione
T1= 273+100= 373 T2 = 273+50 =323 ΔHvap 40,8 kJ /mol, = 40800 J P1= 1,013 bar pertanto essendo ln P2/ P1 = ΔH°vap/ R ( 1/T1 – 1 /T2)
lnP2 /P1= ΔH°vap /R (1/T1-1/T2) = 40800 /8,314(1/ 373 – 1/ 328) = -2,03 p2/p1 = e-2,03 =0,1313
P2 = P1 x 0,1313= 1,013 x 0,1313 =0,133
48. A quale dei seguenti valori si avvicina di più la temperatura di ebollizione dell’acqua in una pentola a pressione che opera alla pressione di 2,0 bar? (Usare i dati del quesito precedente)
- 100°C
- 104 °C
- 120°C
- 170 °C
soluzione
in questo quesito occorre calcolare T2 dai dati P= 2 bar T1=100°C =373 K P1 =1 Bar e T2=X per cui
applicando la formula lnP2/P1 = ΔH°vap /R (1/T1-1/T2) dove ΔH°vap= 40,80KJ/mole
T2=170°
49. La reazione di addizione di Michael seguita da una condensazione aldolica intrarnolecolare prende il nome di anellazione di Robinson, e può essere sfruttata per la formazione di sistemi biciclici. Individuare il prodotto della seguente reazione di anellazione di Robinson:
soluzione
composto n.2
50 la reazione di addizione elettrofila di HCl a 3,3-dimetilbutene produce:

- l-cloro-3,3-dimetilbutano
- 3-cloro-2,2-dimetilbutano
- 2-cloro-2,3-dimetilbutano
- 1,2-dicloro-3,3-dimetilbutano
soluzione

51. Trattando l’acetato di propile con un eccesso di bromuro di etilmagnesio, dopo idrolisi con cloruro di ammonio acquoso, si ottiene:
- 3-metil-3-pentanolo
- 2-butanone
- acetato di etile
- 3-metil-3-esanolo 2
soluzione
si tratta della reazione di un estere con un reattivo di grignard e si produce un alcool terziario:
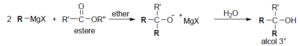 ·
·
si forma quindi l’alcool terziario 3 metil 3 pentanolo
52. Nella molecola di HCl la costante di forza è 4,84 x 10² N m-¹. Calcolare il numero d’onda vibrazione per l’ isotopomero 1H35Cl: l’unità di massa atomica è 1,66054 x 10 -27 Kg e la velocità della luce c è 2,997925 x 108 m/s
- 2,90.103 cm-¹
- 4,02·j 03 cm-1
- 2,90 ·10~ cm-1
- 40,2 cm-1
soluzione
il numero d’onda è in relazione alla costante di forza secondo la legge di Hook
ν= 1/2 πc √k/μ
v =numero d’onda C= velocità della luce K=costante di forza e μ =massa ridotta cioè m1xm2/m1+m2
sostituendo
ν= 5,31 x 10-10 √484/(1,66054 x10-27 x 35x 1,66054 x10-27)=/ 1×1,66054 x 10-27 + 35 x 1,66 x 10-27
v=2,9 x 10 ³ cm-¹
53- nel disaccaride saccarosio i due monosaccaridi sono presenti come:
- β-glucopiranosio e α-fruttofuranosio
- α-glucopiranosio e β-fruttofuranosic
- α-glucopiranosio e α-fruttofuranosio
- β-glucopiranosio e β-fruttofuranosio
soluzione
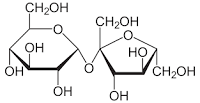
le posizioni alfa o beta si riferiscono alla posizione al dei sotto o al di sopra del piano dell’ossidrile al C legato all’ossigeno
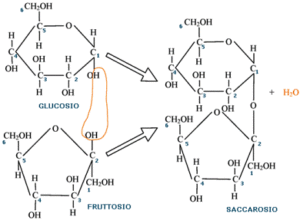
54. Il legame C-D è più difficile da rompere rispetto allegarne C-H. Tenendo conto di questa evidenza, quale delle seguenti affermazioni può spiegare l’osservazione che il benzene perdeuterato, C6D6, è nitrato con la stessa velocità del benzene C6H6′?
A) la scissione del legame C-D non avviene nello stato di transizione dello stadio determinante la velocità di reazione di nitrazione delC6D6
B) la scissione del legame C-D avviene nello stato di transizione dello stadio determinante la velocità di reazione di nitrazione del C6D6
C) nella reazione di nitrazione del C6D6 non si verifica la scissione del legame C-D
D) nessuna delle precedenti affermazioni
soluzione
la nitrazione del benzene avviene col seguente meccanismo
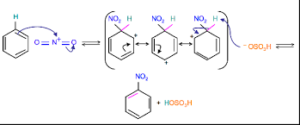
lo step limiting è la formazione dell’intermedio che è mostrato in figura tra le parentesi quindi l”eliminazione dell’H o del Deuterio non influenza la velocità nei reazione.
- A 300 K la tensione di vapore del benzene puro è 1,603 .104 Pa, quella del toluene puro 0,489 .104 Pa. Qual è la composizione (in frazioni molari) della fase vapore in equilibrio con una miscela costituita da 3,0 mol di benzene e 7,0 mol di toluene? (considerare ideale la miscela).
A) benzene = 0,42 toluene = 0,58
B) benzene = 0,58 toluene = 0,42
C) benzene = 0,30 toluene =: 0,70
D) il vapore è composto da benzene puro
soluzione
la regola di Konowaloff dice che il vapore in equilibrio col liquido in una miscela è più ricco del componente più volatile, se confrontato con la composizione della miscela liquida con cui è in equilibrio. Il componente più volatile, come è intuibile, è quello che ha la tensione di vapore più elevata alla stessa temperatura quando si trova allo stato puro.Nel caso specifico
frazione molare del Benzene = tensione di vapore benzene x moli = 3 x 1,603 x 104 = 4,81 x 104 Pa
frazione molare deel toluene = tensione di vapore toluene x moli = 7 x 0,489 x 104 =3,42 x 104 Pa
la somma delle frazioni molari è (4,81+3,42) x 104 = 8,23 x 104 Pa
pertanto
Xbenzene = 4,81/8,23= 0,58
Xtoluene = 1- Xbenzene = 0,42
56 Nel miscelamento dei liquidi puri per formare la miscela del quesito precedente, le variazioni di entalpia e di energia libera di Gibbs valgono, rispettivamente:
- 0 -15,2 kJ
- 50,8 J -15,2kJ
- 0 50,8 kJ
- 0 15,2kJ
soluzione
nel miscelare due soluzioni l’entalpia della miscela è pari alla somma delle entalpie dei singoli componenti e quindi non vi è alcuna variazione di entalpia.
ΔH=0 mentre ΔGmiscela = RT (xA ln xA + + XB ln xB)
57- La cisteina è un amminoacido che presenta tre costanti acide:

K -10-1.70 K -10-8.36 K -10-10
Indicare a quali gruppi funzionali sono riferite:
1 ka1 : COOH Ka2 : NH3+ Ka3 : SH
2 Ka1: NH3+ Ka2 : COOH Ka3 : SH
3 ka1 : COOH Ka2 : SH Ka3 : NH3+
4 ka1 : SH Ka2 : COOH Ka3 : NH3+
la costante acida più elevata è dovuta al gruppo acetato, la costante basica 10-8,36 è dovuta all’SH mentre quella più basica al gruppo NH3+
la risposta corretta è la n.3
58.Indicare il prodotto della seguente reazione:
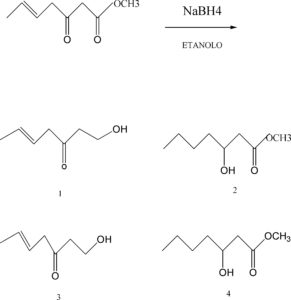
SOLUZIONE
Una delle caratteristiche del boroidruro di sodio è quella di non attaccare il doppio legame carbonio-carbonio, se è presente un gruppo carbonilico. Ciò perchè agisce attraverso lo ione idruro fortemente nucleofilo, infatti lo ione BH4– si dissocia in BH3 e H– che agisce da nucleofilo attaccando il carbonio carbonilico che ha una parziale carica positiva perché gli elettroni del legame pigreco si orientano di più verso l’ossigeno del carbonile. L’H- quindi forma col C un legame carbonio-idrogeno. A questo punto il C cambia la sua struttura da SP2 ad SP3 poichè il legame CO si rompe e l’ossigeno assume carica negativa netta che reagisce con una molecola di acqua formando un alcol ed uno ione OH–.
si deduce che la molecola che si forma è la n.
59-Il mircene è un composto profumato isolato dalla cera della mirica e ha formula C10H16.
L’ ozonolisì del mircene seguita da trattamento con zinco e acido acetico fornisce due moli di formaldeide, una mole di acetone e un terzo composto con formula C5H6O3. Indiyiduare la struttura del mircene:
soluzione
L’ozono attacca il doppio legame formano aldeidi chetoni o acidi . se si formano 2 molecole uguali il doppio legame unisce due parti uguali mentre il terzo composto deve essere probabilmente un cheto acido. la struttura del mircene deve essere perciò il mircene deve avere la seguente struttura
60. Quali delle seguenti affermazioni sono esatte per il processo di espansione di un gas ideale nel vuoto:
I) il processo comporta una variazione di entalpia
Il) il processo comporta un aumento di entropia
III) il processo comporta una diminuzione dell’energia libera di Gibbs
IV) il processo può procedere spontaneamente nella direzione inversa
- le quattro affermazioni sono tutte esatte
- sono esatte solo le affermazioni II e Ill
- sono esatte solo le affermazioni I e IV
- le quattro affermazioni sono tutte errate
soluzione
sappiamo che se un gas si espande nel vuoto il processo è irreversibile.Sappiamo che la variazione di entropia tra due stati A e B è cioè tra lo stato finale e quello iniziale è:
ΔS=0 se A e B sono in equilibrio
ΔS < 0 se la direzione è verso lo stato A
ΔS > 0 se la direzione è verso lo stato B
ovviamente per ΔG irreversibile e quindi dallo stato A passa allo stato finale B e la differenza di entropia è elevata.
L’energia libera o meglio la differenza di energia libera tra i due stati ci indica anch’essa la direzione verso cui avviene il processo essendo
ΔG = ΔH – TΔS dove ΔH = variazione di entalpia e TΔS una parte di energia non utilizzabile per il processo perché serve alla molecola stessa e quindi è una forma di energia interna quindi di natura entropica.
ΔG = 0 se i due stati A e B sono in equilibrio ma ΔG < 0 se il processo dallo stato A a quello B è spontaneo ed il processo di espansione del gas è in effetti un processo spontaneo irreversibile.
La risposta corretta è la n.2
Lascia un commento