GIOCHI DELLA CHIMICA 2017 CLASSE C
I. Sciogliendo 120 g di un composto incognito non volatile in 4 kg dì acqua si ottiene una soluzione che, raffreddando, comincia a congelare a -0,25 ·C. Qual è la massa molare del composto? La costante crioscopica dell’acqua. a 25·C è 1,86 K Kg/mol
A) 223 g/mol
B) 260 g/mol
C) 280 g/mol
D)300 g/mol
soluzione
120 grammi di sostanza sono aggiunti a 4 Kg quindi in 1 Kg vi sono 120/4 =30 g di sostanza. Poiché l’abbassamento crioscopico è direttamente proporzionale alla concentrazione molale del soluto, più precisamente:
2. Un sistema si espande da 1,00 a 1,50 m³ contro una pressione costante pari a 100 kPa Quanto calore deve scambiare con l’ambiente circostante affinché la sua temperatura rimanga costante?
A) 50 cal
B) -50 cal
C) -50 kJ
D) 50 kJ
soluzione
sappiamo dal primo principio della termodinamica che ΔT = Q -PΔV e se la temperatura rimane costante non vi è variazione di temperatura ed allora ΔT =0. Pertanto
Q = PΔV
Q= 100 x 500 = 50000 J = 50 KJ
3. A 20 °C la costante cinetica di una data reazione del primo ordine, è 8,0 x 10-3 s-1. Sapendo che l’energia di attivazione è 32 kJ /mol, calcolare il valore della costante cinetica a 40 ·C
A) 1,8 X 10-2 s-1
B) 8,0 x 10-3 s.1
C) 8,0 X 10-2 s-1
D) 1,3 X 10-2 s-1
soluzione
sappiamo che la relazione tra velocità di reazione K , energia di attivazione E e temperatura T è espressa all’ equazione di Arrhenius :
k = A e-E/RT
dove k = velocità di reazione A= costante sperimentale E= energia di attivazione R= costante dei gas
T= temperatura in gradi K
In forma logaritmica si ha l’equazione di A
lnk= lnA – E/RT
le costanti di velocità a due diverse temperature sono fornite dalla relazione
lnk2/k1 = (E/R) ( 1/T1-1/T2)
questa equazione permette di calcolare la costante cinetica di reazione ad una certa temperatura se è nota la costante per un’altra temperatura e l’energia di attivazione della reazione.
T1= 20°C= 293 K K1= 8 x 10-3 s-1
T2=40°C= 313 K K2= X
E= 32 KJ
ln (K2/ 8 x 10-3 ) = (32000/8314) ( 1/293- 1/313)= 32000/8314 x 0,00022 = 0,846
2,33 =K2/ 8 x 10-3
K2 = 18,64 x10-3 =1,864 x 10-2 s-1
risposta corretta A
4. Se x è la velocità con cui si consuma l’ammoniaca nel corso della reazione:
2 NH3(g) +z N2(s) +3 H2(g).
Quale sarà la velocità con cui si produce idrogeno?
A) 3/2x
B) x
C) 2x
D) 3x
soluzione
poichè da 2 moli di NH3 si ottengono 3 moli di H2 la velocità di formazione di H2 rispetto al consumo di NH3 è 3/2 della velocità di consumo di NH3.
risposta corretta A
5. il ΔΗ° della reazione PCl5(g)→ PCl3(g) + Cl2 è positivo. Come si può spostare l’equilibrio verso la formazione dei prodotti?
A) non si può influire sull’equilibrio termodinamico di una reazione
B) aumentando la temperatura e/o diminuendo la pressione
C) diminuendo la temperatura
D) aggiungendo un catalizzatore
soluzione
se ΔΗ° della reazione è positivo significa che la reazione è endotermica (ΔΗ° = Q)
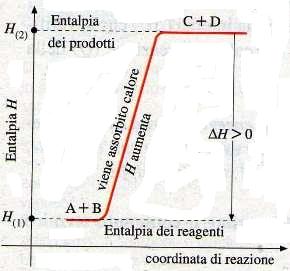
nelle reazioni endotermiche il ΔΗ° = ∑Hprodotti – ∑Hreagenti > 0
questo significa che la reazione e PCl5(g)+ Q → PCl3(g) + Cl2
che possiamo scrivere anche PCl5(g) → PCl3(g) + Cl2 -Q
Se supponiamo di aumentare la temperatura fornendo calore al recipiente di reazione, per ridurre al minimo l’effetto del calore la reazione tende a spostarsi nel verso in cui il calore viene assorbito ovvero verso destra se la reazione è endotermica come in questo caso.Ciò significa che la reazione acquista calore dall’esterno per formare i prodotti e quindi più calore acquista più sono favoriti i prodotti.
Per quanto riguarda la pressione, se la reazione avviene con un aumento del numero di moli gassose , come nel nostro caso , una diminuzione della pressione comporta uno spostamento della reazione nel verso in cui si formano più moli e quindi si ha una maggior formazione di prodotti.
Da quanto esposto la risposta corretta è B
6. L’anidride carbonica prodotta dall’attività umana è la causa principale dell’effetto serra. Chimici di tutto il mondo stanno cercando metodi che ne diminuiscano il contenuto nell’atmosfera. Uno di questi è utilizzare tale gas per produrre metanolo (CH3OH) tramite la reazione, catalizzata, da bilanciare:
CO2 + H2-> CH3OH + H2O
Indicare quanti litri di CO2 (considerare un comportamento ideale del gas in condizioni. standard STP: T 273,15 K, 101,3 KPa) si consumano per ogni tonnellata (1,00 x 10³ kg) di metanolo prodotto.
A) 7 x 10³L
B) 70x 10³L
C) 700 x 10³L
D) 7000 x 10³ L
soluzione
Il n,ossidazione del C in CH4 è +4 mentre in CH3OH è calcolato da -3 per il legame con i 3 atomi di H che è meno elettronegativo e + 1 per il legame con l’ O più elettronegativo quindi il n.o.= -2
2[C4+ + 6 e‒ → C2‒
6[2 H → 2 H+ + 2e‒
quindi semplificando il 2 ed il 6 avremo C4+ + 6 H → C2‒ +6 H+ ma
6H = 3 H2 quindi
la reazione bilanciata è CO2 +3 H2-> CH3OH + H2O
da 44 g diCO2 si ottengono 32 g di CH3OH quindi X g forniranno 1,00 x 106 g
44:32 =X :1,00 x 106 X = 44 x 106 / 32
X=1,375 x10 6 g cioè 0,03125 x 106 moli di CO2
il volume corrispondente si calcola ricordando che a condizioni normali
1 mole di un qualunque gas occupa 22,414 a c.n. quindi 0,003125 x 106 moli occuperanno un volume X
Ricordiamo infatti che a c,n, T=273 P = 1 atm quindi
( V= n/P RT = 1/1x 0,0821x 273= 22,414 litri)
X= 22,414 x 0,03125 x 106 = 0,700 x 106 = 700 x 10³ L
( V= n/P RT = 1/1x 0,0821x 273= 22,414 litri)
7. Nella struttura di Lewìs dello ione BF4- quante sono le cariche formali sul boro:
A) -2
B) -1
C) O
D) +1
soluzione
La carica formale (FC) di un atomo in una molecola, è la carica assegnata assumendo che gli elettroni di legame siano equamente condivisi tra gli atomi indipendentemente dalla loro elettronegatività. ..
F= V-N -B
V è il numero di elettroni di valenza dell’atomo isolato nello stato fondamentale
N il numero di elettroni di non legame
B è il numero totale di legami
BF4- 3- 0 -4 =-1
8 Indicare, sulla base della teoria VSEPR, la coppia che presenta la stessa geometria:
A) l’H2O e CO2
B) CO2e CH3-
C) H2O e Cl2O
D) CH3-e Cl2O
soluzione
Valence-Shell Electron-Pair Repulsion significa repulsione delle coppie di elettroni del guscio di valenza. Questo metodo permette di ricavare la geometria di una molecola da semplici considerazioni sulla quantità dei legami tra gli atomi e sul numero di coppie solitarie di elettroni.A tal fine si adopera il cosiddetto metodo AXE . La sigla AXE indica con la lettera A l’atomo centrale, X rappresenta il numero di legami tra l’atomo centrale e gli atomi ad esso legati. E è invece il numero di coppie di elettroni solitari (lone pair) dell’atomo centrale. La somma di X ed E, è definita NUMERO STERICO che non è altro che un numero che tiene conto dei legami tra gli atomi. Per esempio per la CO2 la struttura di lewis è la seguente:
![]()
per calcolare il numero sterico si considerano i legami doppi o tripli come se fossero legami semplici, il numero di doppietti elettronici liberi sull’atomo centrale e si considera il numero di legami tra gli atomi. In questo caso il numero sterico è 2 perchè il Carbonio si lega ai due atomi di ossigeno con 2 legami e non possiede doppietti liberi.
Il numero sterico è in relazione all’ibridizzazione dell’atomo CENTRALE : per esempio la CO2 sopra descritta ha un Carbonio ibrido SP, se l’atomo centrale ha n.sterico 3 è ibrido SP2 se è 4 è ibrido SP3 se è 5 è ibrido SP3d e se è 6 è ibrido SP3d2 se è 7 è ibrido SP3d3.
| Numero sterico | Geometria molecolare con 0 coppie solitarie di elettroni |
1 coppia solitaria | 2 coppie solitarie | 3 coppie solitarie |
|---|---|---|---|---|
| 2 | Lineare |
|||
| 3 |  Triangolare (piana) |
 Angolare |
||
| 4 |  Tetraedrica |
 Piramide triangolare |
 Angolare |
|
| 5 |  Bipiramide triangolare |
 Seesaw (ad altalena) |
 a forma di T (T-shaped) |
 Lineare |
| 6 |  Ottaedrica |
 Piramide a base quadrata |
 Quadrata (piana) |
|
| 7 |  Bipiramide a base pentagonale |
 Piramide a base pentagonale |
 Pentagonale |
| Tipo di molecola | Forma | disposizione degli elettroni† | Geometria‡ | Esempi |
|---|---|---|---|---|
| AX1En | Diatomica | HF, O2 | ||
| AX2E0 | Lineare | BeCl2, HgCl2, CO2 | ||
| AX2E1 | Angolare |  |
 |
NO2−, SO2, O3 |
| AX2E2 | Angolare |  |
 |
H2O, OF2 |
| AX2E3 | Lineare |  |
XeF2, I3− | |
| AX3E0 | Triangolare (piana) |  |
 |
BF3, CO32−, NO3−, SO3 |
| AX3E1 | Piramide trigonale |  |
 |
NH3, PCl3 |
| AX3E2 | a forma di T |  |
 |
ClF3, BrF3 |
| AX4E0 | Tetraedrica |  |
 |
CH4, PO43−, SO42−, ClO4− |
| AX4E1 | Seesaw (ad altalena) |  |
 |
SF4 |
| AX4E2 | Quadrato (piana) |  |
 |
XeF4 |
| AX5E0 | Bipiramide trigonale |  |
 |
PCl5 |
| AX5E1 | Piramide a base quadrata |  |
 |
ClF5, BrF5 |
| AX5E2 | Pentagonale |  |
 |
XeF5– |
| AX6E0 | Ottaedrica |  |
 |
SF6 |
| AX6E1 | Piramide a base pentagonale |  |
 |
XeF6 |
| AX7E0 | Bipiramide a base pentagonale |  |
 |
IF7 |
Nella molecola di H2O l’ossigeno ha numero sterico 2+2 = 4 e da quanto detto ha un’ibridazione SP3 . L’angolo di legame HOH è tuttavia inferiore ai 109° di un tertraedro perchè i due doppietti solitari tendono a respingersi sino a trovare una posizione di equilibrio
l’acqua ha quindi la seguente struttura

anche in questo caso il numero sterico dell’ossigeno è 4 e quindi è ibrido SP3 co struttura tetraedrica ma con l’angolo ClOCl di 110°,9′ cioè maggiore di 109° perchè gli atomio di Cl si respingo essendo molto elettronegativi .
Il gruppo CH3- ha struttura triangolare piana in quanto il numero sterico è 3
Da quanto abbiamo esposto è evidente che la struttura simile è quella tra le coppie H2O e CL2O.
9. A 728 K il fosgene (COCl2) si decompone termicamente secondo la
reazione: COCl2 <==> CO(g) + Cl2(g)
Se in un recipiente chiuso del volume di 1,0 L vengono introdotti. 2.451 g di fosgene la sua pressione parziale ad equilibrio raggiunto è il 50,0% della pressione totale Calcolare la costante di equilibrio (Kp). Considerare il comportamento dei gas ideale ed esprimere le pressioni in kPa.
A) 25,0
B) 12,5
C) 0,242
D) 0,125
soluzione
Moli di COCl2= 2.451/98.92=0.02478
la pressione iniziale è calcolata dall’equazione di stato dei gas
Ptot =( n/v ) RT =( 0,02478/1 )x 0,0821 x 728 =1,480 atm
All’equilibrio per la reazione
COCl2(s) ⇄ CO(g) + O2{g)
1,480-x x x
per cui otteniamo
P COCl2 = 1.480-x
P CO = P Cl2 = x
Sappiamo inoltre che la pressione totale all’equilibrio è la somma delle pressioni parziali
P=P COCl2 + P CO + P Cl2
P = 1.480-x+x+x
Pt= 1.480+x
sappiamo inoltre che Ppcocl2 = 50 %Pt cioè COCl2 ha una pressione parziale pari al 50% di quella totale pertanto sia CO che Cl2 hanno rispettivamente una pressione parziale del 25%
Quindi x = 0.25 P
Da cui Pt = x/0.25
poichè però Pt= 1,480 +x possiamo scrivere
1.480+x = x/0.25 da cui
0.370 + 0.25x=x
0.370 = 1-0,25 x = 0.75 x
quindi possiamo calcolare x
x = 0.493 atm
P COCl2 = 1.480-x = 1.480 – 0.493 = 0.987 atm = 100,008 kPa
P CO = P Cl2 = x = 0.49333 atm = 49,987 kPa
Kp = (49,987)²/ 100,008=24,99 =25
risposta corretta A
10- 52,42 g di un carbonato di formula X2CO3 sono trasformati quantitativamente in 101,78 g del corrispondente bromuro. Di quale carbonato si tratta?
A) Li2CO3
B) Na2CO3
C) K2CO3
D) Rb2CO3
soluzione
se da CO3+2X si ottiene 2X+2Br = 52,42 : 101,78
CO3+2X/2X+2Br = 52,42/101,78
0,515= 60 +2X / 2X+160
0,515 (2X+160 ) = 60 + 2 X
1,03 X +82,4 = 60 + 2X
X = 23,0
Il peso atomico di X è pari a 23 g e questo peso corrisponde al peso atomico del sodio (22,98) quindi il composto iniziale è Na2CO3
11. Quanti grammi di PbO e di SO2 si possono ottenere mettendo a reagire 478 g di PbS e 192 g di O2 secondo la reazione da bilanciare
PbS + O2 -+ PbO + SO2
A) 1328 g di PbO e 384 g di SO2
B) 669 g di PbO e 192 g di SO2
C) 446 g di PbO e 223 g di SO2
D) 446 g di PbO e 128 g di SO2
soluzione
la reazione bilanciata è
2PbS +3 O2 → 2PbO + 2SO2
2x 239,3 3×16 2x 223,2 2x 64
478,4 48 446,4 128
come si può osservare da 478,4 g di PbS si ottengono 446,4 g di PbO e 128 g di SO2
pertanto la risposta corretta è D
12. L’anione X di un acido debole HX forma un composto poco solubile con il calcio, CaX2(s) con costante di solubilità pari a 10-10,4 .Calcolare la costante di ionizzazione di HX sapendo che il valore della costante di equilibrio della reazione che segue è K=10-4.0
CaX2 + 2H+ -> Ca2+ + 2HX
A) 10-3.2
B) 10-4,6
C) 10-7,1
D) 10-8,3
soluzione
HX<==> H+ + X-
Kion= [H+] [X-] / [HX]
dalla reazione CaX2 + 2H+ -> Ca2+ + 2HX
Keq= [Ca+2] [HX]²/ [H+]²
Kps= [Ca+2] [X-]²
[Ca+2]= Kps/[X-]²
Keq = Kps [HX]²/[H+]²[X-]²
sappiamo inoltre che Kion= [H+] [X-] / [HX] da cui elevando al quadrato otteniamo
Kion² = [H+]²[X-]²/[HX]² da cui [H+]²[X-]²= Kion² [HX]² pertanto sostituendo nella Keq
avremo Keq= Kps[HX]²/ Kion² [ HX]² da cui si ottiene Keq= Kps/ Kion² cioè
Kion² = Kps/Keq = 10-10,4 /10-4 = 10-6,4
da cui Kion= √ 10-6,4 = 10-3,2
risposta corretta A
13- 25,00 mL di una soluzione acquosa di acido formico (HCOOH) 0,0500 M sono titolatì con una soluzione acquosa di NaOH 0,0200 M. Calcolare il pH del punto di equivalenza.
A)7,5
B) 6,32
C) 10,21
D) 9,73
soluzione
al punto di equivalenza tutto l’acido è trasformato in sale cioè
HCOOH + NaOH→ HCOONa
essendo questo sale in ambiente acquoso, reagisce con l’acqua subendo idrolisi
HCOO- + H2O → HCOOH +OH- con una costante di idrolisi Ki =[OH-]² [HCOO-] = [OH-]² Cs
dove con Cs si indica la concentrazione del sale quindi [OH-]=√ Kw/Ka x Cs infatti Ki= Kw/ka
Al punto di equivalenza gli equivalenti di sale sono uguali agli equivalenti di base aggiunti e sono calcolati da
V x N= 25 x 0,05 = 1,25 mequiv.(in questo caso uguali alle mmoli)
il volume di NaOH utilizzato per la neutralizzazione completa è calcolato da V x N=V x N quindi
25 x 0,05 = V x 0,02
25 x 0,05 /0,02 = 62,5 ml
il volume totale = 25+ 62,5 = 87,5 ml
La molarità del sale è data da Moli sale /litro pertanto se in 87,5ml vi sono 1,25 mmoli cioè 0,00125 moli in 1000 ve ne sono X
X= Cs= 1,250/87,5=0,0143 M pertanto calcoliamo [OH-]
[OH-]=√10-14/ 1,8 x 10-4 x 0,0143= √0,555 x 10-10 x 0,0143 = √0,00793 x 10-10 =√79,3 x 10- 14
[OH-]= 8,9 x 10-7
POH = 7- log 8,9 = 7- 0,95 =6,05
PH =14 -6,05 =7,95
risposta corretta A
14. Immergendo una barretta di Fe(s) in una soluzione acquosa 0,1 M in PbCl2, 0,1 M in MnCl2, 0,1 M in MgCl2 e 0,001 M in HCl che cosa si osserva?
A) Si deposita Mn
B) Non si osserva nulla
C) Si deposita Mg
D) Si deposita Pb
soluzione
Il potenziale di riduzione di una specie chimica è la tendenza a perdere o acquistare elettroni quando nella soluzione in cui si trova si aggiunge una specie chimica diversa. Una soluzione con un potenziale di riduzione più positivo o meno negativorispetto alla specie aggiunta tenderà a ricevere da questa degli elettroni, mentre una soluzione con un potenziale di riduzione meno positivo o più negativo tenderà a perdere elettroni, cioè sarà ossidata riducendo le nuove specie.
il potenziale di riduzione standard E° per gli ioni in esame è:
Fe2+(aq) + 2 e- ==> Fe(s) -0,44 V
Pb2+(aq) + 2 e- ==> Pb(s) -0,126 V
Mn2+(aq) + 2 e- ==> Mn(s) -1,18 V
Mg2+(aq) + 2 e- ==> Mg(s) -2,37 V
2H+ +2 e ==> H2 0,0 V
Cl2(g) + 2 e- ==> 2 Cl-(aq) 1,36
sappiamo inoltre che il potenziale di una coppia redox è
E=E° + RT/nF x log [ forma ossidata]/ [forma ridotta]
per gli elementi in esame si ha
Epb = -0,126 + 0,06 / 2 log [Pb+2] = -0,126 + 0,03 x log 10-1 = -0.126 + o,03 x -1 = – 0,156 V
EMg = -2,37 + 0,06/2 log[Mg+2] = -2,37 + 0,03 log 10-2 = -2,37 + 0,03 x -2 = -2,43 V
EMn = -1,18 +0,06/2 log [Mn+2] = – 1,18 + 0,03 x log 10-1 = -1,18 + 0,03 x -1 = -1,21 V
EH2 =0 +0,03 log 10-3 = –0,09 V
ECl2 = 1,36 +0,03 log 10-3 = 1,27 V
la reazione principale da considerare è:
Fe(s) ==> Fe2+(aq) + 2 e E°=+0,44 V
è evidente che il Fe(s) si scioglie nella soluzione formando Fe+2 agisce da riducente nei confronti degli altri ioni e quello che si riduce per primo è quella specie con valore di E meno negativo che in questo caso è il Pb +2 che ha un valore di E= -0,156 V
risposta corretta D
15. Conoscendo le costanti di solubilità di AgCl e AgSCN Calcolare la costante di equilibrio della reazione:
AgCI(S) + SCN’coq) -+AgSCN(s) + a-coq)
A) 871
B) 180
C) 288
D) 543
soluzione
K eq = [AgSCN(s)] x [ Cl-(aq)] / [Ag(s)] x [SCN- (aq)]
ma i composti allo stato solido non si considerano quindi
Keq = [ Cl-(aq)] / [SCN- (aq)]
conoscendo i valori del KPs di AgCl e AgSCN è possibile calcolare i valori di
[ Cl-(aq)] e di [SCN- (aq)]
infatti KPs1 /[Ag+] = [ Cl-(aq)] e KPs2/[Ag+] = [SCN- (aq)]
quindi Keq= KPs1/[Ag+] / Kps2 /[Ag+]= KPs1/[Ag+] x [Ag+] /Kps2 =Kps1/Kps2 =1,8 x 10-10 / 1,0 x 10-12 = 1,8 x 102
Keq = 180
risposta corretta B
16. Ad una soluzione acquosa 0,0 1 M in Na2CrO4 e 0,020 M in NaCl si
aggiunge lentamente AgNO3(s). Si verificano le seguenti reazioni:
Cl-(aq) + Ag+(aq) —–> AgCl(s)
CrO4-2(aq) + 2Ag+(aq) —-> Ag2CrO4(s)
Calcolare la concentrazione di Cl- quando inizia la precipitazione di Ag2CrO4(s).
A) 2,9x 10-7M
B)2,7x 10-5 M
C) 6 ,0 X 10-6 M
D) 4,2 X 10-8 M
soluzione
essendo [Cl-]= 0,02 M la [Ag+] necessaria alla precipitazione è 1,8 x 10-10 / 0,02 = 1,8 x 10-8
se Ag2 CrO4 comincia precipitare significa che viene raggiunto il valore del Kps di Ag2CrO4 , ed in questo caso si ha:
Kps Ag2CrO4 = [Ag+]² x [CrO4-2] da cui possiamo conoscere la [Ag+] al momento della precipitazione
[Ag+] =√ Kps / [CrO4-2]
ma Ag+ ha reagito prima con Cl- facendo precipitare AgCl quindi Kps AgCl = [Ag+] x [Cl-]
e sostituendo ad [Ag+] il valore trovato sopra cioè √ Kps / [CrO4-2] avremo KpsAgCl=√ Kps / [CrO4-2] x [Cl-]
dalle tavole dei Kps sappiamo che Kps AgCl = 1,8 x 10-10 e Kps Ag2CrO4 = 9 x 10-12
1,8 x 10-10= √9 x 10-12 /0,02 x[ Cl-]
1,8 x 10- 10= 3 x 10 -5 x Cl Cl= 0,6 x 10 -5 =6 x 10-6
quindi quando comincia a precipitare Ag2CrO4
[Cl-] = 6,0 x 10 -6 moli /L
risposta corretta C
17. Una soluzione contenente lo ione Pb2+ in concentrazione 0,0010 M; lo ione Mn2+ in concentrazione 0,50 M e lo ione Mg2+ in concentrazione 0,050 M viene alcalinizzata gradualmente per aggiunta di NaOH(,). Indicare l’ordine di precipitazione dei metalli sotto forma di idrossidi. A)Pb,Mg,Mn
B) Mg,Pb,Mn
C) Pb, Mn, Mg
D) Mn,Pb,Mg
soluzione
per rispondere al quesito è necessario conoscere i valori di Kps per gli idrossidi.
KPSPb(OH)2 = 2,8 10-16
KPSMn(OH)2 = 4,6 10-14
KPS Mg(OH)2 = 1,5 10-11
ricordiamo che precipita prima lo ione che richiede minor quantità di reattivo e la quantità di OH– richiesta nei tre casi è:
[OH-] = √ KPS/ [Pb+2 ] = 2,8 x 10 -16 / 0,001 = √2,8 xx 10 -13 = 5,29 x 10-7 moli /L
[OH-] = √ KPS/ [Mn+2 ] =√ 4,6 x 10 -14 / 0,5 = √ 9,2 x 10 -14 = 3,0 x 10- 7 moli/L
[OH-] = √ KPS/ [Mg+2 ] = √ 1,5 x 10-11 / 0,05 =√3,0 x 10 -10 = 1,7 x 10- 5 moli / L
la minore quantità di [OH-] è richiesta dallo ione Mn+2 seguito dal Pb+2 e quindi dal Mg+2
da questi valori si evince che precipita prima lo ione Mn+2 poi lo ione Pb+2 ed infine Mg+2
risposta corretta D
18. Una soluzione satura di Bil3(s) contiene 589,7 mg di sale in 1 ,00. L di acqua. Calcolare la costante di solubilità di BiI3.
A) 4,76 x 10-10
B) 6,35 x 10-8
C) 8,21 x 10-9
D) 2,70 x 10-11
soluzione
BiI3 (s) ⇄ Bi+3(aq) + 3 I-(aq)
se indichiamo la solubilità di Bi+3 con S la solubilità di I- è 3S
pertano il KPS = S x (3S)³ = 27 S4
ed essendo S= 589,7 mg /l = 0,5897 g /l = 0,5897 /589,7 moli /L = 0,001 M si ha
KPS= 27 ( 0,001)4
KPS = 27(10-3)4
KPS =27 x 10-12 = 2,7 x 10-11
risposta corretta D
19. Per trattamento con HBr il geraniolo produce il bromuro riportato. Qual è la sequenza di eventi più plausibile per spiegare la formazione di tale prodotto?

A) Protonazione del gruppo OH, eliminazione di HzO, stabilizzazione del
carbocatione formato e addizione dell’anione bromuro. – .
B) Addizione di HBr al doppio legame, protonazione del gruppo OH ed eliminazione di H20.
C) Deprotonazione del gruppo OH, formazione di un intermedio ciclico a 4 termini, attacco dell’anione bromuro con eliminazione di HzO.
D) Protonazione del gruppo OH, eliminazione di HzO con formazione di
un diene coniugato. addizione di HBr.
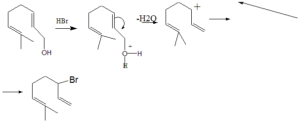
il primo attacco avviene sull’ossigeno dell’OH del geraniolo che attira gli elettroni del doppio legame vicino e che si stacca come H2O mentre contemporaneamente forma il nuovo doppio legame con la somma del Br sul Carbocatione
la risposta corretta è A
20. Disporre in ordine di basicità crescente i seguenti anioni: cloruro, acetiluro, etossido, metiluro.
A) Cloruro, acetiluro, metiluro, etossido
B) Cloruro, etossido, acetiluro, metiluro
C) Metiluro, acetiluro, etossìdo, cloruro
D) Btossido, cloruro, acetiluro, metiluro
soluzione
un aceltiluro ha la forma
21. Un certo composto non volatile X2, se disciolto in acqua, può dissociarsi in 2X. Un litro di soluzione ottenuta sciogliendo 0,80 moli di X2 in acqua ha una pressione osmotica di 2,5 x 106 Pa alla temperatura di 25 ·C. Il grado di dissociazione di x, è:
A) 0,25
B) 0,30
C) 0,45
D) 0,20
soluzione
Quando due soluzioni a diversa concentrazione in uno stesso solvente si trovano in due compartimenti separati da una membrana semipermeabile cioè una membrana che permette il passaggio di uno solo dei componenti ad esempio il solvente, si verifica il passaggio del solvente dalla soluzione a concentrazione meno concentrata a quella più concentrata. La pressione che si deve esercitare per impedire il passaggio è detta Pressione Osmotica.Ciò è dovuto alla differenza di potenziale chimico esistente nei due compartimenti che tende in questo caso a raggiungere uno stato di equilibrio in cui i potenziali chimici dalle due parti della membrana siano uguali. La pressione osmotica è calcolabile da un’espressione matematica simile al’equazione generale di stato dei gas
π V = n RT da cui π =n/V RT cioè π = C x RT
essendo però la pressione osmotica una proprietà colligativa che dipende cioè dal numero di particelle in soluzione, è evidente che occorre tener conto delle dissociazioni che si verificano nel solvente per cui se le particelle in soluzione sono i allora π = C x RT x i
dove i = numero totale di particelle
cioè i = 1 + α(ν – 1)
dove α è il grado di dissociazione e ν il numero di particelle in cui la sostanza si dissocia
se si formano 2 particelle come nel caso del quesito allora ν =2 , e se la sostanza si dissocia completamente allora α = 100% cioè α = 1
Per esempio, la pressione osmotica di una soluzione di glucosio a C=0,1 M
è π = 0,1 x RT infatti il glucosio non si dissocia
mentre invece la pressione osmotica di una soluzione di NaCl 0,1 M è π
π = 0,1 x RT x 2 NaCl si dissocia completamente in Na+ e Cl- quindi i = 2
Analogamente CaCl2 0,1M ha una pressione osmotica di
π = 0,1 x RT x 3
perchè CaCl2 si dissocia completamente formando Ca+2 e 2 Cl- quindi in totale 3 particelle.
tornando al quesito abbiamo X2→ 2 X
π = C x RT x i
in questo caso i non può essere 2 perchè il quesito ci dice che X2 non si dissocia completamente in 2X non solo ma ci vien chiesto di calcolare α.
Pertanto, sapendo che
i = 1 + α(ν – 1)
dove ν è il numero di ioni che si ottengono dalla dissociazione di 1 molecola di X2 ed α è il grado di dissociazione otteniamo
i = π / C x RT =2,5 x 106/ 0,8 x 298 x 8314 = 2,5 x 106/ 2,0 x 106 =1,25
quindi 1,25 = 1 + α(2-1) = 1+2α – α = 1+α
1,25 =1 + α
α = 1,25 -1 =0,25
α =25%
risposta corretta A
22. Il ΔS° di una certa reazione endotermica è circa il doppio di ΔH/T . Si può quindi affermare che:
A) la costante di equilibrio della reazione sarà inferiore a l
B) la reazione è sfavorita
C) la costante di equilibrio della reazione sarà pari a zero
D) la costante di equilibrio della reazione sarà superiore a 1
soluzione
sappiamo che la costante di equilibrio è in relazione con il valore di ΔG° secondo la relazione
![]() Go = – RT ln K
Go = – RT ln K
ma a sua volta ![]() Go è in relazione sia al ΔH° che al ΔS°, infatti
Go è in relazione sia al ΔH° che al ΔS°, infatti
G = H – TS
![]() G =
G = ![]() H –
H – ![]() (TS)
(TS)
![]() Go =
Go = ![]() Ho – T
Ho – T![]() So
So
da queste formule si evidenzia che se ΔS° = 2 ΔH°/T allora TΔS° = 2ΔHo
![]() Go =
Go = ![]() Ho – 2ΔHo
Ho – 2ΔHo
![]() Go = – ΔHo
Go = – ΔHo
dalla relazione vista sopra:
ΔGo = – RT ln K
si può notare che se K fosse =1 ![]() Go =0
Go =0
ma, siccome ΔG° = – ΔH° ( il valore di ΔH deve essere negativo) si deduce che ciò è possibile solo se K è maggiore di 1
ne deriva che la risposta corretta è D
23. Un composto A si decompone seguendo una legge cinetica del primo ordine. Il tempo di dimezzamento è pari a 22 minuti. Il tempo necessario affinché la concentrazione di A si riduca ad un ventesimo di quella iniziale è:
A) i dati non sono sufficienti a determinare il tempo richiesto
B) circa un’ora e mezza
C) circa un’ora
D) circa un’ ora e un quarto
soluzione
nel caso del quesito t1/2= 22 =0.693/k
da cui calcoliamo k = 0,693/22=0,0315
noto k possiamo calcolare il tempo necessario perchè [A] = [A]/20:
1/20=0,05
ln 0,05 = – kt
2,99 = -0,0315 t t= 95 minuti = 1,37 ore cioè circa un’ora e mezza
risposta corretta B
24. Determinare l’entalpia standard di formazione a 298 K dell’acido acetico.
Son note, a 298 K, le entalpie standard di combustione che seguono:
C2H4O2(l) + 2O2(g) → 2CO2(g) + 2H2O(l) ΔH°=-875 kJ /mol
C(s, grapbite) + O2(g)→ CO2(g) ΔH°= -394 kJ/ mol
H2(g) + 1/2 02(g) → H2O(l) ΔH°= -286 kJ/mol
A) I dati forniti non sono sufficienti per rispondere alla domanda.
B) -350 kJ/mol
C) +350 kJ/ mol
D) -485 kJ/mol
soluzione
sappiamo che ∑ ΔH°prodotti – ∑ ΔH°reagenti = ΔH° di reazione
sappiamo anche che essendo H una funzione di stato il suo valore dipende solo dallo stato iniziale e finale del sistema e non dalla via seguita per giungere allo stato finale. Possiamo quindi utilizzare i calori di combustione dei singoli componenti dalla reazione(legge di Hess).Pertanto
indicando con X l’entalpia standard dell’Acido acetico C2 H4O2
875= (2 x -394 ) +( 2 x -286) – X
875= -(788 + 572) – X
X = 1360 -875 = – 485 KJ/mol
risposta corretta D
25. L’idrogeno molecolare reagisce con il monossido di azoto NO per formare il protossido di azoto N2O (gas esilarante) e acqua. E’ stata effettuata una serie di esperimenti alla stessa temperatura ed in condizioni tali che sia reagenti sia prodotti siano allo stato gassoso. Di seguito sono riportate le velocità iniziali della reazione in tre diverse condizioni di concentrazione iniziale
[NO] = 0,30 mol /dm3 [H2] = 0,35 mol/dm3
r° = 2,835 x 10-3 mol /dm3 S
[NO] = 0,60 mol /dm3 [H2] = 0,35 mol /dm3
r° = 1,135 x 10-2 mol /dm3 S
[NO] = 0,60 mol/dm3 [H2] = 0,70 mol/dm3
r° = 2,268 x 10-2 mol/dm3 S
Qual è la legge cinetica della reazione e quanto vale la costante cinetica?
A) r =: k [NO] [H2]2 k =: 0,09 dm-6 mol-2S-1
B) r = k [NO] [Hz] k = 0,09 dm·6 mol-2 S-1
C) r = k [NOJI [Hz} k = 0,09 dm-3 mol-1 S-1
D) r se k [NO]2 [Hz] k = 0,09 dm-6 mol-2 S-1
soluzione
nel primo caso r=[NO][H2]2 non può essere questa la cinetica infatti:
r=0,002835 = k x 0,30 x (0,35)2 k= 0,002835 / 0,03675 =0,0771
r= 0,01135 =0,6 x (0,35)2 k= 0,01135/ 0,0735 =0,1544
r=0,02268= 0,6 x (0,70)2 k= 0,02268/0,49 = 0,0462
analogo risultato si ottiene nel caso della cinetica r=k[NO][H2]
nel caso di r= k[NO]² [H2]
si ha r= 0,002835 = (0,3)2 x 0,35 k= 0,002835/ 0,0315 = 0,09 dm-6 mol-2 s-1
r= 0,01135 = (0,6)2 x 0,35 k= 0,01135/ 0,126 =0,09 dm-6 mol-2 s-1
r= 0,02268 = (0,6)2 x 0,70
k= 0,02268 mol /dm3 s-1 / 0,252 mol3 /dm9 =0,09 dm-6 mol-2 s-1
la cinetica è quindi r= k[NO]2 [H2]
risposta corretta D
26. II carbonio 14 si decompone formando azoto e par1icelle beta seguendo una cinetica del primo ordine con un tempo di dimezzamento pari a 5,73 103 anni. Un reperto archeologico in legno presenta un tenore in carbonio 14 pari al 54 % di quello misurabile negli alberi viventi. Il reperto ha:
A) 5100 anni
B) 2500 anni
C)7300 anni
D) 8500 anni
soluzione
sappiamo che in una cinetica del primo ordine ln [A]= ln [Ao] – kt
e che quando [A]= [Ao]/2
cioè quando la concentrazione iniziale diviene la metà allora t½ viene chiamato tempo di dimezzamento cioè il tempo necessario perché la concentrazione iniziale divenga la metà. Si può pertanto scrivere :
nel caso del quesito t1/2= 5,73 x 103 =0.693/k
da cui calcoliamo k = 0,693/ 5,73 x 103 =120,9
noto k possiamo calcolare i tempo necessario perchè [A] = [A]x0,54:
ln 0,54 = – kt =120,9 x t -0,6162 /-0,000120 = 5097 anni
risposta corretta A
27 La temperatura di fusione del mercurio alla pressione atmosferica è 234 K, mentre la sua entalpia standard di fusione è 2,30 kJ/ mol. Di quanto aumenta l’entropia di una mole di mercurio che fonde a 234 K?
A) 98,3 J-1 K-1
B) 9,83 kJ /mol K
C) 9,83 J /mol K
D) 0,983 KJ/ mol K
soluzione
sappiamo che l’entropia S non è altro che è il rapporto S=Q/T ed è una funzione termodinamica.
Sappiamo inoltre dal primo principio della termodinamica ΔE= q-PΔV da cui
Q= E2-E1 + P( V2-V1)
Q= (E2+PV2) – (E1-PV1) = H2-H1 = ΔH
pertanto S= Q/T = ΔH/T
La variazione di entropia nel caso del quesito è ΔS= ΔH/T = 2,3KJ / 234 K =2300 J/234K
ΔS= 9,83 J/mol K
risposta corretta C
28. In un determinato processo è stato verificato che la somma del calore e del lavoro scambiato da un sistema chiuso non è uguale alla sua variazione di energia interna. Se ne può desumere che:
Al Una parte dell’energia interna è stata dissipata
B) La somma di calore e lavoro scambiati sono uguali alla variazione di entalpia
C) Il processo è irreversibìle
D) Gli sperimentatori hanno probabilmente sbagliato le misure, e queste
vanno ripetute.
soluzione
per il primo principio della termodinamica E=Q+PΔV e ciò deve essere sempre vero. Il primo principio tuttavia, non può fornire indicazioni sulla direzione di un processo che può invece essere indicato dalla variazione di energia libera ΔG per cui la risposta C è errata. La somma tra calore e lavoro, come abbiamo visto, è E=Q+PΔV e non ΔH, quindi la risposta B è errata, così come la risposta A infatti se il sistema perde energia la perderà sotto forma di calore e quindi il primo principio è sempre rispettato.
Si deduce che la risposta corretta è D
29. Determinare la composizione della miscela di benzene e toluene che a 293 K ha una tensione di vapore pari a 5,06 x 103 Pa. Alla temperatura di 293 K, il benzene e il toluene hanno rispettivamente una tensione di vapore pari a 1,01 x 104 Pa e 2,90 x 103Pa. Assumere che la miscela si comporti idealmente.
A) la frazione molare del benzene è pari a 0,30
B) la frazione molare del benzene è pari a 0,25
C) la frazione molare del benzene è pari a 0,23
D) la frazione molare del benzene è pari a 0,27
soluzione
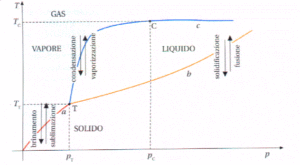
in una soluzione con più componenti in equilibrio col proprio vapore, ad una determinata temperatura, la composizione della fase vapore che si trova al di sopra della fase liquida è diversa dalla composizione della fase liquida da cui proviene. Infatti la fase vapore è più ricca del componente più volatile cioè quello che allo stato puro ha la pressione di vapore più elevata alla stessa temperatura (regola di Konowaloff) questo componente fa aumentare la tensione del vapore sovrastante il liquido. Consideriamo due liquidi A e B,con comportamento ideale, indicando ad una data temperatura rispettivamente con Pa e Pb le pressioni parziali del vapore dei due componenti sopra la miscela, con Xa e Xb le rispettive frazioni molari nella fase liquida e con P°a e P°b le tensioni di vapore dei due componenti puri alla temperatura data, la legge di Raoult viene espressa dalle equazioni:
A) Il punto triplo è il punto dove coesiste il numero maggiore possibile di fasi
B) II punto triplo non dipende dalla natura chimica della sostanza
C) Sul diagramma p,V il punto triplo viene rappresentato come un segmento
D) Sul diagramma p,T il punto triplo si trova sempre ad ordinata più bassa del punto critico
soluzione
Le sostanze possono esistere nei tre stati: solido, liquido o gas a seconda del valore della temperatura e della pressione. Modificando la temperatura e la pressione ogni sostanza può cambiare di stato. Se si fornisce calore ad un sistema che è sottoposto ad una pressione esterna esso viene adoperato per aumentare l’energia interna delle molecole : ad esempio se si fornisce calore all’acqua, alla pressione ambiente, le molecole si muovono più velocemente fino a che le molecole superficiali non raggiungono una tensione di vapore tale da uguagliare la pressione ambiente ed inizia l’ebollizione. Sino a che il liquido non bolle, vediamo che la temperatura dell’acqua aumenta progressivamente proprio a causa del calore assorbito. Quando il liquido inizia a bollire la temperatura rimane costante sino a che tutto il liquido non evapora dopodiché la temperatura ricomincia ad aumentare.
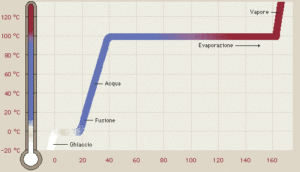
Un diagramma di stato o diagramma delle fasi, è un grafico che rappresenta in un piano cartesiano con sulle ascisse i valori di pressione e sulle ordinate i valori della temperatura ogni punto del piano corrisponde a un preciso stato fisico della sostanza nelle condizioni di pressione e temperatura indicate dal punto.
In questo grafico ogni curva rappresenta i punti in cui uno stato fisico è in equilibrio con un altro stato fisico ed ogni punto della curva è caratterizzato da un valore di temperatura e pressione. Balza subito in evidenza un punto indicato con T in cui la sostanza può coesistere in tutti e tre gli stati e pertanto il punto viene definito punto triplo. In questo grafico, la curva che parte dall’origine degli assi è l’insieme dei punti in cui il solido passa direttamente allo stato di vapore senza passare dallo stato liquido(sublimazione). La curva che parte da T e va verso l’alto a sinistra è l’inseme dei punti in cui sono in equilibrio liquido e vapore mentre la curva in basso è l’insieme dei punti in cui sono in equilibrio solido e liquido. Se consideriamo la curva che ha origine dagli assi cartesiani, notiamo che diminuendo o aumentando la pressione anche di poco, possiamo modificare lo stato fisico della sostanza. Possiamo ancora notare che la curva, in corrispondenza di un certo valore di temperatura detta temperatura critica Tc diviene parallela all’assa X delle pressioni e ciò indica che pur aumentando notevolmente la pressione, il vapore non passerà mai allo stato liquido.
Per quanto riguarda il quesito,il punto A è corretto perchè nel punto triplo coesistono le tre fasi, i punti C e D sono altrettanto corretti come visto sopra, mentre la risposta B è errata in quanto il punto triplo dipende dal tipo di sostanza in esame (per es. il punto triplo dell’H2O è diverso dal punto triplo della CO2 ).
31. Si utilizza dell’acqua bollente per termostatare a 100°C un reattore che lavora in continuo producendo 30 kJ S-1. il ΔHeb dell’acqua è 2,317 kJ g-1. Quanto litri di acqua devono essere forniti al sistema di raffreddamento ogni ora?
Al 12litri
B) 471itri
C) 30 litri
D) 37litri
soluzione
L’equazione del bilancio energetico, scritta in termini di flusso termico e tramite le entalpie in uscita (2) e in ingresso (1) dei due fluidi è:
Q = m ( h2 – h 1)= mΔH
m= Q/ΔH
m=30 Kj/ 2,317 = 12,95 ma 1 ora =3600 s
m= 12,95 x 3600 =46,6 litri
32- 3,0 Kg di metano furono bruciati in presenza di una quantità stechiometrica di ossigeno all’interno di un contenitore il cui volume era 1,0 m3 mantenendo la temperatura fissata a 200°C. La reazione andò a completezza e furono prodotti esclusivamente biossido di carbonio ed acqua. Calcolare la pressione p1 all’interno del contenitore alla fine della reazione Il contenitore venne in seguito raffreddato a 18°C. Quale valore assunse la pressione (P2).
A) p1 7,6x 105 Pa P2 = 4,5 x105 Pa
B) P1= 2,3 x 106 Pa; P2 = 1,3x 106 Pa
C) P1=7,6 x 105Pa;p,=1,3×106Pa
D) P1 = 2,3 x106 Pa; P2 = 4,5 x 105 Pa
soluzione
la reazione di combustione è:
CH4 + 2O2 → CO2 +2 H2O
la pressione alla fine della reazione è dovuta sia alla CO2 formata che all’H2O e può essere calcolata da PV=(nCO2 +nH2O)RT
la quantità in grammi di CO2 è data da CH4 :CO2 = 3000 :X
X=g CO2 = 3000 x 44/16 = 8250 g di CO2
la quantità di acqua è quindi CH4 : 2H2O = 3000:X
X= g H2O= 3000 x 2×18 /16= 6750 g H2O
quindi P1 = (8250/44 + 6750/18 )/1000 x 8,31 x 473 = (187,5 +375 )/1000 x 8314 x 473
P1 = 2,21 x 106 Pa
poichè P1V1/T1=P2V2/T2 ed essendo il volume costante si ha 2,21 x 106 / 473 x 291
P2 = 1,3 x 106 Pa
33. La doppia elica del DNA si rinatura dai due filamenti (A e B). Per questo processo è stato proposto il meccanismo che segue
A+B -+ Elica instabile (stadio veloce)
Elica instabile -+ doppia elica stabile (stadio lento)
La legge cinetica compatibile con questo meccanismo è:
A) r = K (A][B]
B) r = K[A]² [B]²
C) r = K [A]½[B]½
D) r= K [A]-1 [B]-1
soluzione
la reazione è A+B→ Pinstabile
Pinstabile → Pstabile
la reazione globale è:
A+B→ Pstabile
la velocità di reazione è determinata dallo stadio più lento bimolecolare :
V= k[Pinstabile]
tutto dipende quindi da quanto Pinstabile si forma e [Pinstabile] che si forma dipende a sua volta da
[A] [B] pertanto la reazione globale di formazione ha una velocità
V= k [A] [B]
e se le concentrazione [A] e [B] sono uguali
V= dC/dt= -k [A]²
la risposta corretta è A
34. A pressione atmosferica, acqua ed acido formico formano un azeotropo di massimo. Dal punto di vista qualitativo ciò permette di ipotizzare che:
A) le interazionì acqua-acido formico sono energeticamente sfavorite rispetto alla media di quelle tra due molecole di acqua e tra due molecole di acido formico.
B) Le molecole di acido formico tendono ad autoaggregarsi.
C) le molecole di acqua tendono a formare microdomini separati.
D) le interazioni acqua-acido formico sono energeticamente favorite rispetto alla media di quelle tra due molecole di acqua e tra due molecole di acido formico.
soluzione
Un AZEOTROPO è una miscela costituita da due o più sostanze che si comportano all’ebollizione come un composto puro, dato che bolle a temperatura costante producendo un vapore che ha la stessa composizione del liquido. Nel caso specifico,si deve considerare il fatto che l’acqua è una molecola polare con un momento dipolare relativamente elevato in cui l’idrogeno possiede una parziale carica positiva, che, quando si avvicina a una molecola di acdo formico subisce l’attrazione nei confronti dei doppietti elettronici solitari dell’ossigeno così come l’idrogeno dell’acido subisce l’attrazione dei doppietti elettronici dell’ossigeno dell’acqua.Tali attrazioni sono forti e sono più favorevoli rispetto a quelle esistenti tra le molecole separate, infatti mentre si forma la miscela viene liberata energia.
Da quanto esposto si evince che la risposta corretta è D
35-l.a variazione entalpica per la fusione del ghiaccio a 273,15 K e a pressione atmosferica è 3,34 x 1o5 J/Kg. A temperature di poco inferiori si è determinato che la pressione di equilibrio tra fase solida e fase liquida dipende dalla temperatura secondo la relazione ΔP/ΔT = -13,5 x 1o6 Pa /K. Qual è la variazione di volume per il processo di fusione?
A) 9,05 x 1O~5 m3/ kg
B) -9,05 X 10-5 m3/ kg
C) -9,05 X 10-6 m3/ kg
D) 9,05 X 10-6 m3 /kg
soluzione
Se consideriamo una trasformazione di fase reversibile nella quale sono costanti la pressione e la temperatura: il potenziale di Gibbs si conserva cioè:
da cui:
dalla quale si ottiene l’equazione differenziale di Clapeyron:
dove λ rappresenta il ΔH di trasformazione. Pertanto:
dp/dT= -13,35 x 106 = ΔH/TΔV
-13,35 x 106 = 3,34 x 105 /273,15 ΔV
273 ΔV = 3,34 x 105 /-13,35 x 106
ΔV =( 0,2474/ 273 )x 10-1
ΔV = -9,05 x 10-5 m3/Kg
36. Determinare la formula minima di una sostanza che all’analisi elementare ha dato un valore di composizione percentuale di potassio. in massa, pari al 55,26%:
A) KH2PO4
B) K2HPO4
C) K3PO4
D) KH2PO3
soluzione
Per rispondere al quesito occorre calcolare la % di K nei 4 composti e confrontare il risultato con il dato fornito cioè 55,26% pertanto:
KH2PO4 : K =100:x 136 :39 =100 😡 x=28,7 %
K2HPO4 : 2K = 100 😡 174,2: 2×39 =100 😡 x= 44,77%
K3PO4 :3K =100 😡 212,3: 3 x39 =100 😡 x= 55,26%
KH2PO3 :K =100: x 126 : 39 =100:x x= 30,95%
si deduce quindi che la formula minima è K3PO4
37. In una bombola piena di NO2, ad una certa temperatura, si stabilisce l’equilibrio:
4NO2(g) ⇄ 2N2O(g) +3 O2(g)
Nelle condizioni di equilibrio si è dissociato il 23,2% di NO2 ed il manometro della bombola indica una pressione di 1926 kPa. Indicare la risposta che elenca le pressioni parziali dei gas presenti all’interno:
A) p(NO2) = 1326 kPa; p(N2O) = 400 kPa; p(O2) = 200 kPa
B) p(NO2) = 1326 kPa; p(N2O) = 200 kPa; p(O2) = 200 kPa
C) p(NO2) = 1326 kPa; p(N2O) = 200 kPa; p(O2) = 400 kPa
D) p(NO2) = 1326 kPa; p(N2O) = 600 kPa; p(O2) =300 kPa
soluzione
possiamo scrivere pertanto
38. Quanto bicarbonato di zinco si deve aggiungere a O,504g di carbonato di zinco affinché la percentuale in peso di zinco nella miscela risultante sia pari a 63,2%?
A) 0,504g
B) 0,318 g
C) 0,185 g
D) Nessuna delle tre
soluzione
la %di Zn in 0,504 g di ZnCO3 è calcolata da
ZnCO3:Zn =0,5043 :X
X= 0,504 x 65,4 /125,4=0,262
quind 0,504:0,262 =100 😡
% Zn= 51,9%
pertanto se in 0,504 g vi è il 51,9% in X g vi sarà 63,2%
X= 0,614 g
occorre aggiungere 0,614-0,504 =0,110 g
39. Indicare la risposta che indica i prodotti della reazione di sodio metallico con metanolo (CH30H).
A) NaOH, CH4
B) NaOH,H2
O NaOCH3, CH4
D) NaOCH3, H2
soluzione
la reazione tra sodio metallico e metanolo produce metilato (o metossido) di sodio ed idrogeno
Na + CH3OH —–> NaOCH3 + 1/2 H2
 2 Na+ + 2RO- + H2(g) + calore in modesta quantità
2 Na+ + 2RO- + H2(g) + calore in modesta quantitàHNO3(aq) + Zn(s) → NO(g) + H2O(l) + Zn(NO3)2(aq)
A) 2,2,1,1,1
B) 6,6,2,2,1
C) 8,4,3,3,2
D) 9,5,4,4,2
soluzione
la reazione redox è la seguente:
2[NO3- +3e + 4H+ → NO +2H2O
3[Zn → Zn+2 +2e
_____________________________
2NO3- + 3Zn + 8H+ → 2NO + 3Zn + 4H2O
i coefficienti sono pertanto:
2,3,8,2, 3,4
la reazione opportunamente bilanciata ricordando che l’acidità (8H+) deriva da HNO3 è l a seguente:
2HNO3(aq) + 3Zn(s) + 6HNO3 →2 NO(g) + 4H2O(l) +3 Zn(NO3)2(aq)
41. Calcolare la concentrazione di Cu2+(aq) in una soluzione ottenuta aggiungendo 1,50 g di polvere di Cu(s) in 1,00 L di una soluzione di H2SO4 2,00 M. Si considerino le semireazioni: •
SO4-2( aq) + 4H+ (aq)+ 2e→ SO2(g) + 2H2O(l) E°= 0,2 V
Cu2+(aq)+ 2e → Cu(s) E°= 0,337 V
(assumere che la pressione di SO2(g) sia 1,01x 105 Pa)
A) 2,24×10-2 M
B) 4,05×10.2 M
C) 3,11×10.2 M
D) 1,16×10-2 M
42. II numero di piatti teorici N di una colonna per HPLC si calcola dalla equazione:
N=16 x(t/w)²
dove t è il tempo di ritenzione deIl’analita e Wa l’ampiezza alla base del picco dell’analita, Per raddoppiare il valore di N quale valore deve assumere il nuovo tempo di ritenzione (assumendo w costante)?
A) 2,5xt.
B) 1,4xt.
C) 1,8xt
D)4,0xt
soluzione
t²= N/16 t=√N/16 se n deve essere 2 N allora si ha t =√2N/16
ma √N/16=t pertanto il nuovo tempo di ritenzione sarà t= √2 x t
t= 1,4 x t
43. Secondo la legge di Lambert-Beer, l’assorbanza di una soluzione, posta in una cella di l cm, contenente una specie assorbente di concentrazione C molare è
A=ε l C
dove e è una costante. Se la concentrazione C della soluzione diminuisce da 0,20 M a 0,050 M, quale sarà la nuova assorbanza ( si assuma l costante) ?
A) O,75xA
B) 1,50xA
C) 0,25xA
D) 2,50xA
soluzione
la concentrazione da 2,0 M diminuisce di 1/4 e diviene 0,05 M quindi se l’assorbanza è A essa diminuirà di 1/4 cioè diverrà 1/4A = 0,25 A
risposta corretta C
44. La soluzione di una proteina che lega il ferro viene titolata con una soluzione a titolo noto di Fe3+(aq) secondo lo schema
Proteina(aq) + Fe3+(aq) -+ (Proteina·Fe3)(aq)
(non assorbe) (non assorbe) (assorbe a 465 nm)
Poiché il prodotto che si forma assorbe a 465 nm, il punto finale della titolazione viene individuato spettrofotometricamente. Indicare la forma della curva di titolazione (si assuma trascurabile la variazione di volume durante la titolazione).
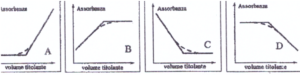
soluzione
poichè l’assorbanza è dovuta al complesso proteina-Fe essa deve necessariamente aumentare con l’aggiunta del titolante e l’ unico grafico che indica tale aumento è il grafico B ed infatti dopo che viene raggiunto il punto di equivalenza rimane in eccesso il Fe che non assorbe per cui l’assorbanza rimane costante.
45. Calcolare la durezza di un’acqua in gradi francesi (°F)(l°F corrisponde a 10 mg/L di CaCO3) sapendo che contiene 85,70 mg/L di ioni Ca2+ e 13,25 mg/L di ioni Mg2+.
A) 30,61
B) 18,75
C) 26,84
D) 11,29
soluzione
se in CaCO3 vi è Ca+2 in X g ve ne saranno 0,0 857 g
100g :40 = X :0,0857 X= 0,214 g = 214 mg di CaCO3
Per il Magnesio si ha
MgCO3 : Mg= 0,01325 :X
84,3: 24,3 = 0,01325 :X X= 0,054g = 54 mg espresso però come se fosse una quantità di CaCO3
in totale si hanno quindi 214+ 54 = 268 mg di carbonato
esso viene espresso in gradi francesi ricordando che:
se 1grado F corrisponde a 10 mg/L di CaCO3 allora 273 mg corrispondono a X gradi F
X= 26,8 °F
46. Uno studente ha sintetizzato le tre etilbenzaldeidi (o,m,p), ma ha dimenticato di etichettarne i contenitori. Per potere identificare pensa di bromurare un’aliquota di ogni campione e vedere quanti prodotti meno-bromurati si ottengono da ciascuno. Quale dei seguenti risultati dovrà aspettarsi?
A) 2 prodotti per la p-etilbenzaldeide, 4 prodotti per la o-etilbenzaldeide,
3 prodotti per la m-etilbenzaldeide
B) l prodotto per la p-etiìbenzaldeide, 3 prodotti per la o-etilbenzaldeide, 2 prodotti per la m-etilbenzaldeide
C) l prodotto per la p-etilbenzaldeide, 2 prodotti per la o-etilbenzaldeide, 3 prodotti per la m-etilbenzaldeide
D) Nessun prodotto per la p-etilbenzaldeide, 2 prodotti per la 0- etilbenzaldeide,3 prodotti per la m-etilbenzaldeide
soluzione
In funzione degli effetti induttivi le reazioni possibili sono :

la risposta corretta èC
47, Un trigliceride è costituito da tre acidi grassi identici ed ha formula molecolare C45H86O6. Qual è la formula molecolare dello ione carbossilato ottenuto per saponificazione del trigliceride?
A) C13H27O2
B) C14H27O2
C) C14H28O2
D) C14H29O2
soluzione
I trigliceridi sono il prodotto ottenuto dalla esterificazione del Glicerolo
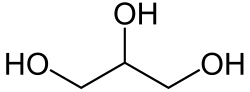
in cui al posto degli atomi di idrogeno degli OH sono presenti le catene di tre acidi grassi a catena lunga
(se viene sostituito un solo idrogeno si hanno i monogliceridi, se vengono sostituiti due atomi si hanno i digliceridi).
pertanto essendo il trigliceride costituito da 45 atomi di C l’acido grasso avrà un contenuto di atomi di C C42 in quanto occorre sottrarre i 3 atomi di C del glicerolo. Quindi il trigliceride avrà un numero di atomi di C pari a 45-3 / 3 essendo 3 il numero di molecole dell’acido grasso legato al glicerolo. Il numero di atomi di idrogeno del trigliceride è H86 per cui l’acido grasso avrà 86-5 atomi di idrogeno del glicerolo, cioè avrà 86-5=81/3 essendo 3 le molecole di acido grasso quindi vi sono 81/3=27 atomi di H.
Il gruppo COO- di ogni molecola dell’acido grasso ha 2 atomi di O che prima erano legati ciascuno ad un C del glicerolo per cui si ha O2.
Riassumendo, la formula dell’acido grasso è C14 H27 O2
La risposta corretta è B
48, Diversamente dall’acetaldeide, la tricloroacetaldeide, quando è sciolta in acqua, è convertita quasi completamente nella forma idrata. Scegliere la spiegazione più plausibile tra le seguenti:
A) La solvatazione degli atomi di cloro avvicina l’acqua al carbonile favorendo la reazione di idratazione
B) La reazione di idratazione è favorita dagli effetti steriei degli atomi di cloro
Cl La presenza degli atomi di cloro rende il carbonile meno elettrofilo
D) La reazione di idratazione è favorita dall’elettronegatività degli atomi di cloro
soluzione
il composto che si forma per idratazione è il cosiddetto idrato di cloralio la cui formula è

ed è stato usato in passato come ipnotico ciè come farmaco.
La presenza degli atomi di cloro che è un elemento molto elettronegativo favorisce l’attrazione di elettroni per cui si crea un aumento della densità di carica positiva sul C del CO che quindi viene facilmente attaccato dall’OH- dell’acqua il cui idrogeno H+si unisce ad uno dei doppietti dell’ossigeno del CO.
Si deduce che la risposta corretta è D
49. Quali stereoisomeri si formano per reazione dell’ossido di cicloesene
(epossicicloesano) con metossido di sodio in metanolo?
A) Una coppia di diastereoisomeri in uguale quantità
B) Una coppia di enantiomeri trans in uguale quantità
C) Un composto meso
D) Una coppia di enantiomeri cis in uguale quantità
soluzione
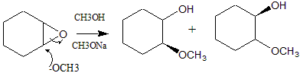
l’apertura dell’anello epossidico è stereoselettiva come ci si aspetta da una reazione SN2 in cui l’attacco del nucleofilo è anti- rispetto al gruppo uscente. Nell’ossido di cicloesene pertanto si ottengono 2 molecole di Trans 2 metossi cicloesanolo.
La risposta corretta è D
50. Quando sia il diene che il dienofilo sono asimmetrici, la reazione di Diels-Alder può fornire due prodotti a seconda della disposizione dei reagenti. Nella seguente reazione quale sarà il prodotto presente in quantità maggiore e perché?
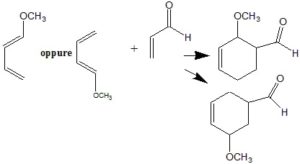
A) I prodotti si formano in quantità uguali
B) Il prodotto in quantità maggiore sarà 2 a causa della disposizione preferenziale dei reagenti per minimizzare gli effetti sterici
C) Il prodotto in quantità maggiore sarà l a causa della disposizione preferenziale dei reagenti dovuta alla loro distribuzione di carica (per risonanza)
D) Il prodotto in quantità maggiore sarà l a causa della disposizione preferenziale dei reagenti per effetto del legame idrogeno tra i due gruppi polari
soluzione
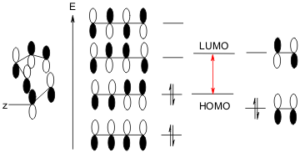
La cicloaddizione tra un diene coniugato e un dienofilo (un alchene o un’alchino), è una reazione che coinvolge gli elettroni 4 π del diene e 2 π del dienofilo. La forza trainante della reazione è la formazione di nuovi legami σ, che sono energicamente più stabili dei legami π .
Il meccanismo prevede la sovrapposizione tra l’ OM più alto occupato del diene (HOMO) e l’OM più basso non occupato del dienofilo (LUMO) ed è consentita termicamente a condizione che gli orbitali abbiano energia simile. La reazione è facilitata da gruppi elettronattrattori sul dienofilo, poiché questo abbassa l’energia del LUMO. I buoni dienofili recano spesso uno o due dei seguenti sostituenti: CHO, COR, COOR, CN, C = C, Ph, o alogeno
E’ tuttavia possibile la sovrapposizione dell’HOMO del dienofilo con il MO non occupato del diene. Questo possibilità alternativa della reazione è favorita dai gruppi donatori di elettroni sul dienofilo e da un diene povero di elettroni.
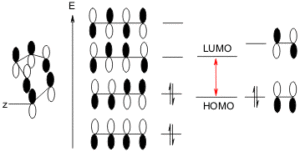
la reazione è diastereoselettiva
Questa scritta sopra è una tipica reazione asimmetrica di α,β-Aldeide insatura Catalizzata da un sale di Diarilprolinol Silil Ether in presenza di acqua.
E’ quindi evidente che il prodotto della reazione del quesito presente in quantità preponderante è il numero 1 perché la reazione è facilitata da gruppi elettronattrattori sul dienofilo, poiché questo abbassa l’energia del LUMO. I buoni dienofili ha il gruppo CHO.
Risposta corretta C
51 La forma completamente protonata dell’alanina ha valori di PKa 2,34 e 9,69. A quali valori di PH l’alanina esiste nelle tre forme indicate?

3
A ) 1 a pH 9,69 2 a PH 6,02 3 a PH 2,34
B) 1 a pH 2,34 2 a PH 6,02 3 a PH 9,69
C) 1 a pH 14 2 a PH 7 3 a PH 0
D) 1 a pH 6,69 2 a PH 7,35 3 a PH 2,34
soluzione
Neli amminoacidi dato che contengono almeno un gruppo acido debole e uno debolmente basico, i loro gruppi possono essere in forma neutra o carica a seconda del pH del mezzo. Si consideri ad esempio la titolazione l’alanina del quesito esposto, mediante aggiunta di una base forte, a partire da un mezzo a pH 0.
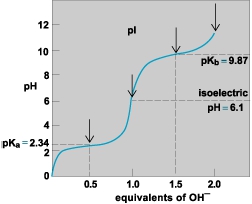
All’inizio, a pH 0, l’alanina è presente nella forma 1 in cui entrambi i gruppi sono protonati; con l’aumentare del pH, tende a cedere H+ prima il più acido fra i due gruppi protonati. Il gruppo COOH è leggermente più acido di quello che si trova in un normale acido carbossilico alifatico ,a causa dell’ effetto elettronattrattore del gruppo amminico, che stabilizza la base coniugata.
Il pKa del gruppo -COOH nell’alanina è 2,35 (Ka = 4,5 x 10-3), mentre quello di -NH3+ è 9,87 (Ka=1,3 x 10–10 dato che il gruppo -NH2 è leggermente meno basico rispetto ad una normale ammina alifatica (Kb = 7,4 x 10-5). Si ricordi che il prodotto Ka Kb = 1014. Questo significa che, nella curva di titolazione riportata sopra, il primo flesso, corrispondente all’aggiunta di mezza mole di OH, rappresenta il valore di pH al quale la metà di 1 si è trasformata in 2; la trasformazione si completa aggiungendo di un’altra mezza mole di OH-, e a quel punto l’amminoacido è completamente presente nella forma 2, la cui carica elettrica netta è zero a causa della contemporanea presenza di due cariche opposte (una specie di questo genere viene anche chiamata zwitterione, dalla parola tedesca “zwitter”, che significa “doppio”). Il pH corrispondente si trova dividendo per 2 lasomma dei pKa dei due gruppi acidi, in questo caso (2,35 + 9,87): 2 = 6,1. Questo è il cosiddetto pH isoelettrico per questo amminoacido, ossia il pH al quale l’amminoacido non migra se immerso all’interno di un campo elettrico; questa è la condizione di minima solubilità in acqua, perché a questo pH le molecole tendono piuttosto ad aggregarsi fra loro. Aggiungendo ulteriore base, il gruppo ammonio comincia a perdere H+ e l’amminoacido comincia a dar luogo alla forma anionica 3.
la risposta corretta è A
52. La seguente reazione di sostituzione è un esempio dì catalisi nucleofila, in cui lo ione ioduro aumenta la velocità di trasformazione del cloruro in alcol. Perché, contrariamente alla reazione non catalizzata. questa reazione genera un prodotto con rìtenzìone di configurazione?
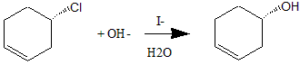
A) Lo io duro promuove l’attacco dell’OH- dalla stessa parte del gruppo uscente
B) La reazione si verifica in due successivi passaggi SN2, il primo mediato dallo ioduro e il secondo dallo ione OH-
C) Lo ioduro promuove la formazione di un intermedio carbocationico che reagisce in maniera stereospecifica con l’OH-
D) L’andamento stereo chimico della reazione è dovuto agli effetti sterici
dello ioduro
soluzione
in realtà lo iodio reagisce per primo con meccanismo SN2 ed inversione di configurazione, successivamente il composto iodato reagisce con meccanismo SN2 ed inverte la configurazione ottenuta, pertanto il prodotto finale è come se avesse seguito un meccanismo con ritenzione della configurazione.
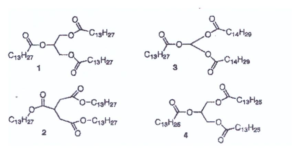
53. La noce moscata contiene un triacìlglicerolo semplice completamente saturo con un massa molare di 722 gmol’ Da. Individuare la sua struttura tra quelle proposte.
A) 1
B) 2
C) 3
D) 4
soluzione
nella molecola n.1 vi sono 13 x 3 + 6 = 45 atomi di C che corrispondono a 540 g
86 atomi di H che corrispondono ad 86 g
6 atomi di ossigeno che corrispondono a 96 g
il Pm della prima molecola è : 540 + 86 + 96 =722 g
pertanto la formula del triaglicerolo è la n. 1
54. Individuare il rapporto esistente tra le specie delle seguenti coppie:
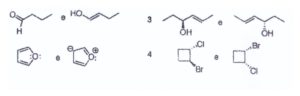
A) l: specie ossidata e ridotta; 2; strutture di risonanza; 3: enantiomeri; 4: diastereoi someri
B) l: tautomeri; 2; strutture di risonanza; 3: stessa molecola; 4: conformerì
C) 1: tautomeri; 2: strutture di risonanza; 3: stessa molecola; 4: diastereoisomeri
D) l: specie ossidata e ridotta; 2: tautomeri; 3: enantiomeri; 4: diastereoisomeri
soluzione
la prima molecola è un chetone in cui l’idrogeno in alfa forma l’enolo per cui le due formule corrispondono a formule tautomeriche (tautomeria cheto-enolica)
La seconda molecola è rappresentata con due formule di risonanza
la terza invece rappresenta la stessa molecola indistinguibile l’una dall’altra.
le molecole n.4 sono due formule che rappresentano due isomeri cis – trans
(diastereoisomeri)
55. Quale dei quattro composti è il prodotto finale della seguente serie di reazioni?

A) l
B) 2
C) 3
D) 4
soluzione
il reattivo di Grignard introduce sul C carbonilico il gruppo CH3 e successivamente H3O+ protona l’ossigeno ed il doppio legame dà reazione di somma con HBr ed il C del doppio legame dopo eliminazione di NaBr si lega all’ossigeno formando un ciclo.
56. Quando riscaldiamo il composto A con una soluzione acida di dicromato di potassio si forma acido benzoico. Identifica il composto dall’analisi del suo spettro 1H NMR.
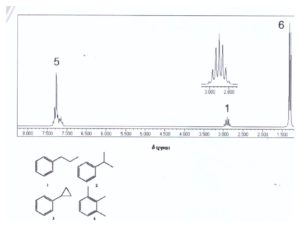
A) 1
B) 2
C) 3
D) 4
soluzione
se indichiamo i vari protoni come in figura,
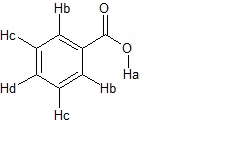
57. Identificare la struttura primaria di un peptide avendo a disposizione le seguenti informazioni:
per idrolisi totale da ogni mole di peptide si ottengono: 2 mol di Phe, 2 mol di Arg, e 1 mol di Ala, di Tyr, di Lys, di Trp, di Leu, e di His;
per idrolisi parziale con tripsina si ottengono i seguenti frammenti peptidici: Tyr-Lys, Gly-Phe-Arg, Trp-Leu-His, Ala-Phe-Arg;
per idrolisi parziale con chimotripsina si ottengono i seguenti frammenti peptidici:
Ala-Phe,
Lys-Gly-Phe,
Leu-His,
Arg-Tyr,
Arg-Trp;
A) Gly-Phe-Arg-Tyr-Lys-Ala-Phe-Arg_Trp_Leu_His
B) Ala-Phe-Arg-Gly-Phe-Arg_ Tyr-Lys- Trp-Leu- Hi s
C) Ala-Phe-Arg- Tyr-Lys-Gly-Phe-Arg-Trp-Leu_His
D) Leu-His-Ala-Phe-Arg-Gly-Phe-Arg_Trp_Tyr_Lys
soluzione
nella molecola vi sono due molecole di Phe e dai frammenti una deve essere -Lys, Gly-Phe questa sequenza compare solo nella C.
Un altro dei frammenti è costituito da Ala-Phe, che riscontriamo sia in B che in C ma vista la precedente considerazione e considerando l’altro frammento Arg-tyr ed Arg-Trp dovremmo avere Ala-Phe-Arg-Tyr-Lys, Gly-Phe-Arg.Trp
siccome uno dei frammenti è Arg-Trp allora la molecola sarà
Ala-Phe-Arg-Tyr-Lys, Gly-Phe-Arg.Trp-
l’ultimo frammento è Leu-His per cui la struttura primaria del peptide è
Ala-Phe-Arg- Tyr-Lys-Gly-Phe-Arg-Trp-Leu-His
la risposta corretta è C
58. Indicare il prodotto della seguente reazione di condensazione di Claisen incrociata:
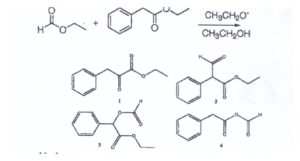
A) l
B) 2
C) 3
D) 4
soluzione
Quando un estere viene trattato con una base avviene una reazione che è simile alla condensazione aldolica e la reazione è
la condensazione di Claisen che porta alla formazione di β-chetoesteri.

lLa reazione di Claisen incrociata sfrutta un composto carbonilico enolizzabile ed un estere che non enolizza nelle stesse condizioni (o comunque con maggiore difficoltà rispetto al chetone):
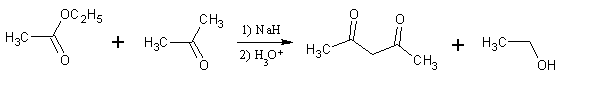
il meccanismo della reazione di claisen è:

da quanto esposto il prodotto della reazione di Claisen incrociata del quesito è la molecola n. 2
59, Ognuna delle seguenti molecole contiene due anelli aromatici, Quale anello, in ciascun composto, subisce più facilmente una sostituzione elettrofila aromatica?
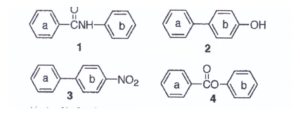
A) 1a 2b 3a 4a
B) Ib;2b;3b;4a
C) I b; 2b; 3a; 4b
D) I a; 2a; 3b; 4b
soluzione
i gruppi elettrondonatori aumentano la densità elettronica dell’anello aromatico, per cui si evince che nella molecola 1 l’azoto può fornire il doppietto all’anello più vicino che in questo caso è l’anello b.
Ovviamente l’ossigeno dell’OH nella molecola n.2 favorisce la sostituzione elettrofila nell’anello aromatico b cui è legato.
Nella molecola 3 il gruppo NO2 è un gruppo elettronattrattore quindi la sostituzione elettrofila è favorita sull’anello opposto a quello cui è legato cioè a
Nella molecola 4 vi è un ossigeno più vicino all’anello b per cui è favorita l’eliminazione in questo anello.
In definitiva gli anelli più facilmente soggettia reazioni di sostituzione elettrofila sono 1 b; 2b; 3a; 4b
60. Un composto reagisce con due equivalenti di H2 in presenza di Ni come catalizzatore e genera per ozonolisi un unico prodotto. Quale dei seguenti composti è quello incognito?
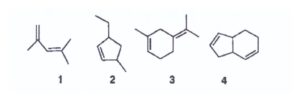
A) 1
B) 2
C) 3
D) 4
soluzione
la molecola che può formare un solo prodotto è la molecola n.4 infatti per ozonolisi i due doppi legami formano 4 estremità acide ma un solo prodotto, mentre le altre molecole formano 2 diversi prodotti.



Lascia un commento