Uno degli argomenti più importanti nell’insegnamento e nell’apprendimento della chimica è l’uso del principio aufbau per prevedere le configurazioni elettroniche degli atomi e per spiegare la tabella periodica degli elementi. Questo metodo è stato insegnato a molte generazioni di studenti ed è il preferito dagli insegnanti e presente in tutti i testi di chimica. Qui però scopriremo che ha qualche difetto e cercheremo di eliminare la versione non corretta del principio.
L’errore deriva da un tentativo di semplificare le cose per lo studente, ma questo è un comportamento non corretto ed in ogni caso non c’è scusa per perpetuare questo mito educativo.
Il metodo aufbau è stato originariamente proposto dal fisico danese Niels Bohr che è stato il primo ad utilizzare la meccanica quantistica nello studio della struttura atomica ed uno dei primi a dare una spiegazione della tabella periodica in termini di distribuzione di elettroni (configurazioni elettroniche). Bohr ha proposto di pensare alla struttura degli atomi della tavola periodica come progressivamente costruita iniziando dall’atomo più semplice di tutti, quello dell’idrogeno che contiene solo un protone e un elettrone. Gli altri atomi differiscono dall’idrogeno per l’aggiunta progressiva di un protone e di un elettrone. L’elio ha due protoni e due elettroni, il litio ne ha tre, il berillio quattro, fino all’uranio che a quel tempo (1913) era l’atomo più noto, costituito da 92 protoni e 92 elettroni; il numero di neutroni varia negli atomi ma è irrilevante in questa discussione.
Come sappiamo, gli stati energetici dell’elettrone, caratterizzati dalle funzioni d’onda definite orbitali atomici (cioè quelle funzioni matematiche che elevate al quadrato forniscono la probabilità di trovare l’elettrone nel punto descritto dalle coordinate presenti in esse) e che vengono indicati con le lettere s, p, d e f. Man mano che ci si allontana dal nucleo abbiamo a seconda del valore di n (1,2,3,4,5..)
orbitale 1s
orbitali 2s e 2p
orbitali 3s, 3p e 3d
orbitali 4s, 4p, 4d e 4f
Si può facilmente constatare che numero di stati dell’elettrone è dato da m= 2 l+1 infatti per l=0 il numero di stati è solamente uno, infatti : m= 2×0+1 =1 e corrisponde ad uno stato S, se l=1 gli stati m sono 2×1+1 = 3 e corrispondono agli stati P(x,y,z) e per l=2 gli stati m sono 2x 2+1=5 corrispondenti ai 5 stati d mentre per l=3 gli stati m sono 2x 3+1 = 7 che corrispondono ai 7 stati f.
Il modello semplice (aufbau) che governa l’ordine di riempimento degli orbitali è il seguente:
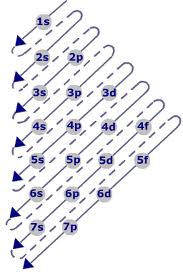
l’ordine di riempimento inizia nella parte superiore del diagramma seguendo le frecce che puntano verso il basso e verso il margine sinistro.
Seguendo questa procedura abbiamo l’ordine di riempimento degli orbitali con elettroni con la seguente sequenza in cui l’energia degli orbitali aumenta da sinistra verso destra :
1s <2s <2p <3s <3p <4s <3d <4p <5s <4d …
Ricordiamo che uno stato atomico può contenere al massimo 2 elettroni e questi devono possedere spin diversi cioè +1/2 e -1/2 perchè gli elettroni non possono avere gli stessi numeri quantici e devono necessariamente differire per lo spin (questo è il cosiddetto principio di massima molteplicità).
Per vedere come questo metodo funziona, consideriamo alcuni esempi.
L’atomo di magnesio ha un totale di 12 elettroni per cui utilizzando il metodo sopra
indicato, si ottiene la seguente configurazione elettronica:
1s2, 2s2, 2p6, 3s2
che è in accordo con i dati dello spettro dell’atomo di Mg.
Vediamo un altro esempio: un atomo di calcio che ha 20 elettroni. Seguendo il metodo si ottiene una configurazione
1s2, 2s2, 2p6, 3s2, 3p6, 4s2
e ancora una volta c’è perfetto accordo con lo spettro atomico del Ca.
Ora vediamo cosa succede per l’atomo successivo, cioè lo scandio con i suoi 21 elettroni.
Secondo il metodo aufbau la configurazione dovrebbe essere :
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d1
ed è vero. Ma in molti libri si sostiene, forse, in modo non ragionevole, che l’ultimo elettrone ad entrare nell’atomo dello scandio sia un elettrone 3d quando in realtà gli esperimenti mostrano abbastanza chiaramente che l’orbitale 3d viene occupato prima dell’orbitale 4s
Molti insegnanti e libri di testo inventano schemi contorti per spiegare perché il 4s si riempie preferenzialmente, sostenendo che siccome l’elettrone 4s è preferibilmente ionizzato per formare un ione di Sc + allora deve essere occupato prima degli orbitali d . Ma la spiegazione, invece, si trova solo nelle prove sperimentali sugli ioni dei metalli di transizione e noi infatti utilizzeremo gli ioni dello Scandio.
Sc3+ ( ione tri-positivo ) 1s2, 2s2, 2p6, 3s2, 3p6, 3d°, 4s°
Sc2+ ( ione di-positivo ) 1s2, 2s2, 2p6, 3s2, 3p6, 3d1, 4s°
Sc1+ ( ione mono-positivo ) 1s2, 2s2, 2p6, 3s2, 3p6, 3d1, 4s1
Sc (atomo neutro) 1s2, 2s2, 2p6, 3s2, 3p6, 3d1, 4s2
Spostandosi dallo Sc3 + ad Sc2 + è chiaro che l’elettrone aggiuntivo entra in un orbitale 3d e non in un orbitale 4s come lo schema aufbau impone. Allo stesso modo, quando passiamo da questo ione allo Sc1 +, l’elettrone aggiuntivo entra in un orbitale 4s sino ad arrivare all’atomo di scandium neutro o Sc. Modelli e sequenze simili sono osservate per gli atomi successivi nella tabella periodica, tra cui titanio, vanadio, cromo (con ulteriori complicazioni), manganese e così via. Il principio aufbau fornisce la corretta configurazione generale per quasi tutti gli atomi ma 20 di essi mostrano configurazioni anomale, come il cromo, il rame, il molibdeno e molti altri.
Resta il fatto che non è possibile prevedere la configurazione in nessuno dei metalli di transizione e nei lantanidi, o se si arriva ad esso anche gli elementi a blocchi P. Ma torniamo allo scandio.
Contrariamente a ciò che viene spesso insegnato, gli orbitali 3d hanno un’energia inferiore a 4s e se dovessimo cercare di prevedere il modo in cui gli elettroni riempiono gli orbitali dello scandio, possiamo supporre che i tre elettroni finali dopo la configurazione nucleare di argon
1s2, 2s2, 2p6, 3s2, 3p6
.
Lascia un commento