LA MISURA POTENZIOMETRICA DEL PH IN LABORATORIO
La misura del PH per via potenziomentrica prevede l’utilizzazione di uno strumento chiamato PHmetro (piacchimetro) il cui elemento fondamentale è un elettrodo in grado di misurare la [H+]. Gli elettrodi di pH più utilizzati sono gli elettrodi di vetro. Il modello tipico è realizzato con un tubo di vetro /(vedi figura) alla cui estremità vi è una bolla di vetro. L’interno dell’elettrodo è solitamente riempito con una soluzione tampone di cloruri in cui è immerso il filo d’argento, coperto con cloruro d’argento, che funge da elettrodo di riferimento. Il pH della soluzione tampone interna può essere 1,0 (HC1 0,1 M) oppure 7,0 .Un esempio schematizzato di elettrodo è il seguente:
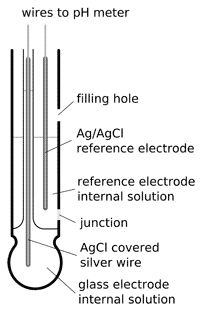
La parte attiva dell’elettrodo è la bolla di vetro. Mentre il tubo ha pareti forti e spesse, la bolla è invece costruita il più sottile possibile come se fosse una membrana. La superficie del vetro è a contatto all’esterno con la soluzione di cui si vuol conoscere il PH ed all’interno con una soluzione ad [H+] nota (soluzione tampone). Entrambe le soluzioni interne ed esterne raggiungono uno stato di equilibrio. Entrambi i lati del vetro assumono una carica a causa dei protoni adsorbiti, questa carica è responsabile della differenza potenziale.
Il vetro ha una struttura tridimensionale di tetraedri di silicato in cui un atomo di ossigeno fa parte di due molecole di silicato ma tale struttura è per lo più amorfa, con ossidi incorporati di metalli alcalini quali sodio o potassio e spesso, nei vetri usati per la misura del PH, vi è una certa quantità di Li+ e Ba++ . Quando la superficie del vetro è esposta all’acqua, si forma uno strato idratato dello spessore di 500 A° ricco in silice. La parte esterna di questo gel idratato si comporta come una membrana scambiatrice di cationi. Alcuni gruppi Si-O- diventano protonati
SiO- + H+ → SiO-H+ +H2O
Questo causa un movimento di ioni sodio o potassio o litio tra la membrana e la soluzione contenente ioni idrogeno e si crea una differenza di potenziale tra l’interno e l’esterno della membrana EH che viene confrontata con il potenziale di un elettrodo di riferimento che è interno al tubo di vetro.Il vantaggio degli elettrodi di vetro è che non si ha movimento di elettroni per cui esso è inerte rispetto ad eventuali agenti ossidanti o riducenti presenti nella soluzione tuttavia possiedono un’elevata impedenza elettrica da 1 a 500 meghoms che negli strumenti obbligano all’uso di voltmetri ad impedenza di ingresso elevata o all’uso di elettrometri. L’applicazione dell’equazione di Nernst porta al calcolo del PH :
PH = PHs+ (E-Es) x F/ 2,303 RT
dove:
pHS è il pH di una soluzione tampone;
ES è il potenziale dell’elettrodo di misura quando è immerso nella soluzione tampone;
E è il potenziale dell’elettrodo di misura quando è immerso nella soluzione di cui si vuole
misurare il pH;
F è la costante di Faraday (23,060 cal / V equivalente);
R è la costante dei gas perfetti (1,987 cal / °C mole);
T è la temperatura assoluta in gradi Kelvin.
sostanze ossidanti e riducenti o alte salinità non interferiscono così come sostanze colloidali, colore, torbidità della soluzione. Oli,sostanze grasse e solidi sospesi a bassa granulometria possono invece influenzare la risposta strumentale, in quanto tendono a depositarsi sulla superficie dell’elettrodo a vetro pertanto è necessario pulire periodicamente l’elettrodo con opportuni detergenti per rimuovere le sostanze grasse.I solidi che si depositano si rimuovono con HCl diluito 1:10 oppure con un bagno ad ultrasuoni.
[embedyt] https://www.youtube.com/watch?v=vwY-xWMam7o[/embedyt]
Campionamento e conservazione dei campioni
I campioni possono essere prelevati in bottiglie di vetro opportunamente lavate e risciacquate con
acqua distillata, avendo cura di riempirle completamente senza lasciare spazio di aria.
I recipienti utilizzati devono essere dotati di tappi a chiusura ermetica allo scopo di evitare perdite di gas disciolti con caratteristiche acide o basiche (NH3, H2S, CO2, ecc.). L’analisi va eseguita prima possibile; conservare i campioni a 4°C e riportarli a temperatura ambiente prima della misura.
Essendo il pH funzione degli equilibri esistenti tra le varie specie ioniche, in particolare CO2, HCO3–
,CO32-, è consigliabile eseguire la misura direttamente all’atto del prelievo, avendo cura di non far
gorgogliare il campione durante la manipolazione. Ciò si realizza facilmente riempiendo una bottiglia a collo largo mediante un tubo di gomma pescante sul fondo del sistema e misurando il pH mentre si fa scorrere l’acqua (è opportuno lasciar uscire dalla bottiglia alcuni litri di acqua prima di fare la misura). Il volume minimo consigliato da prelevare per l’analisi 250 mL.
Nel caso in cui non sia possibile reperire le soluzioni commerciali di tampone per standardizzare lo strumento, riportiamo quì la preparazione di alcune soluzioni:
L’acqua impiegata per la preparazione delle soluzioni tampone deve esser bollita di fresco e successivamente lasciata raffreddare in condizioni controllate che non consentano il contatto con la CO2 dell’aria (recipienti chiusi con tubi a calce sodata). A tale acqua aggiungere una goccia di soluzione satura di KCl ogni 50 mL.Se il suo pH risulta compreso tra 6,0 e 7,0 può essere usata per preparare le soluzioni tampone.
Soluzione tampone di borace (pH = 9,18 a 25 °C)
Introdurre 3,800 g di tetraborato di sodio decaidrato (Na2B4O7·10H2O) in un matraccio tarato da 1000 mL, sciogliere con acqua (6.1) e portare a volume alla temperatura di 25 °C. Conservare la soluzione in bottiglia di polietilene protetta con un tubo di calce sodata. La soluzione è stabile per un mese.
Soluzione tampone di fosfati (pH = 7,41 a 25 °C)
Introdurre 1,179 g di fosfato monopotassico (KH2PO4) e 4,303 g di fosfato disodico (Na2HPO4) in un matraccio tarato da 1000 mL, sciogliere con acqua (6.1) e portare a volume alla temperatura di 25 °C. Impiegare sali essiccati in stufa a 130 °C per due ore. Conservare la soluzione in frigorifero.
La soluzione è stabile per un mese.
Soluzione tampone di fosfati (pH = 6,86 a 25 °C)
Introdurre 3,388 g di fosfato monopotassico (KH2PO4) e 3,553 g di fosfato disodico (Na2HPO4) in un matraccio tarato da 1000 mL, sciogliere con acqua (6.1) e portare a volume alla temperatura di 25 °C.Conservare la soluzione in frigorifero. La soluzione è stabile per un mese.
Soluzione tampone di ftalato (pH = 4,01 a 25 °C)
Introdurre 10,120 g di ftalato acido di potassio (KHC8H4O4) in un matraccio tarato da 1000 ml,
sciogliere con acqua (6.1) e portare a volume alla temperatura di 25 °C.
La soluzione è stabile per un mese.
Soluzione tampone di tartrato (pH = 3,56 a 25 °C)
Agitare vigorosamente un eccesso di tartrato acido di potassio (circa 7 g di KHC4H4O6) in 100 – 300
mL di acqua (6.1), in una bottiglia di vetro tappata. Se necessario filtrare per eliminare il sale in sospensione.
La soluzione è stabile per un mese.
Soluzione tampone di tetraossalato di potassio (pH = 1,68 a 25 °C)
Introdurre 12,610 g di tetraossalato di potassio biidrato (KHC4O8·2H2O) in un matraccio tarato da
1000 mL, sciogliere con acqua e portare a volume alla temperatura di 25 °C.
La soluzione è stabile per un mese.
Quì di seguito è riportato un esempio di PHmetro portatile e da banco


In generale i misuratori di PH vengono utilizzati anche per effettuare le titolazioni acido base spesso in modo automatico, ed in commercio esiste una grande varietà di strumenti. che utilizzano anche campionatori automatici per grandi quantità di campioni.
Le titolazioni potenziometriche sono eseguite misurando il potenziale di un elettrodo sensibile ad un analita (in questo caso H+) durante la sua titolazione con un opportuno reagente. Si può quindi costruire direttamente la curva Potenziale/Volume di titolante.
Le titolazioni potenziometriche forniscono dati più attendibili di quelli forniti dalle titolazioni che usano indicatori chimici, e sono inevitabili quando si devono eseguire in soluzioni colorate o torbide e per ricercare la presenza di specie insospettate.
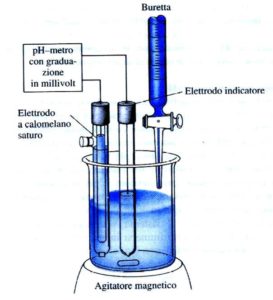
Un titolatore automatico altro non è che una pompa, capace di erogare volumi controllati di liquido (titolante), accoppiata con un voltmetro elettronico che permette di misurare il potenziale di un elettrodo indicatore dopo ogni aggiunta automatica di titolante.

Nel caso di una titolazione acido-base, l’elettrodo indicatore è un normale elettrodo a vetro, per una di precipitazione degli alogenuri si usa un elettrodo ad Ag/AgCl.
Il titolante viene aggiunto automaticamente in grandi incrementi all’inizio della titolazione ed in incrementi via via più piccoli quando ci si avvicina al punto finale (come indicato da maggiori cambiamenti nella risposta per unità di volume).
I metodi per determinare il punto finale di una titolazione potenziometrica sono diversi.
Il più semplice implica la costruzione del diagramma del potenziale in funzione del volume di reagente, come nella figura sotto a sinistra: il punto di mezzo del salto di potenziale viene stimato ad occhio e preso come punto finale.
Alternativamente si può calcolare (anche automaticamente) la derivata Ia (figura al centro) o IIa (figura a destra) della curva di titolazione, rendendo più precisa la rilevazione del punto di equivalenza.

Come eseguire una titolazione potenziometrica in pratica
1- La soluzione da titolare se troppo concentrata (>1M) va diluita e posta in un becher con ancoretta magnetica
2- Titolare con una soluzione a titolo noto con l’ausilio di una buretta azzerata
3- La parte sensibile dell’elettrodo indicatore deve essere completamente immerso nella soluzione senza toccare le pareti del recipiente
4- La soluzione deve essere mantenuta in agitazione senza creare turbolenze
5- Effettuare aggiunte cospicue (0.5-2 ml) di titolante fino a 1-2 ml prima del previsto punto equivalente (viraggio)
6- Dopo ogni aggiunta di titolante assicurarsi che il sistema abbia raggiunto l’equilibrio
7- Dopo ogni aggiunta di titolante registrare il volume totale di titolante aggiunto e il valore di pH o i mV misurati
8- Nell’intervallo di viraggio, l’aggiunta di titolante deve essere tanto più piccola quanto più ripida è la curva di titolazione
9- Effettuare aggiunte cospicue (0.5-2 ml) di titolante dopo il viraggio.
Un esempio di titolatore automatico Metr0hm è mostrato in figura

TITOLATORE
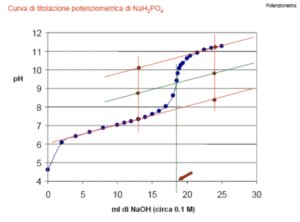
VALUTAZIONE GRAFICA DEL PUNTO DI EQUIVALENZA PER LA TITOLAZIONE DI NaH2PO4
CON NaOH 0.1 M
Lascia un commento