I primi 40 quesiti sono comuni alle classi A e B.
1. Lo ione Cl- è
isoelettronico con:
A) O2-
B) K+
C) S
D) Ne
SOLUZIONE
Isoelettronico significa che due elementi chimici (solitamente due ioni oppure uno ione ed un atomo neutro) possiedono lo stesso numero di elettroni,quindi. nel caso specifico sappiamo che Cl- contiene un elettrone in più rispetto all’atomo neutro cioè contiene 17 +1 =18 elettroni.
O2– possiede (8 protoni ed 8 elettroni ) +2 cariche negative =10 elettroni
K+ possiede 19- 1 =18 elettroni
S p0ssiede 16 elettroni
Ne possiede 10 elettroni
si evince quindi che Cl- è isoelettronico con lo ione potassio K+
risposta corretta B
2. Secondo la teoria VSEPR la geometria della molecola BF3 è:
A) piramidale trigonale
B) a T
C) planare trigonale
D) tetraedrica
SOLUZIONE
La teoria Valence Shell Electron Pair Repulsion proposta dal chimico americano Gillespie è utilizzata per valutare la geometria di una molecola semplicemente considerando che gli elettroni dei legami di una molecola tendono a disporsi il più lontano possibile a causa delle repulsioni reciproche. I doppietti elettronici non impegnati in legame( coppie solitarie o lone pair) si respingono con maggior forza rispetto a quelli impegnati nei legami. In generale viene usato il cosiddetto metodo AXE .
La sigla AXE rappresenta con la lettera A l’atomo centrale e ha sempre come valore sottinteso 1.
La X rappresenta il numero di legami sigma che si formano tra l’atomo centrale e gli atomi ad esso legati. I legami covalenti multipli (doppi, tripli) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti sull’atomo centrale. La somma di X ed E, definita come NUMERO STERICO , ed è associata anche al numero totale di orbitali ibridi.
![]() lineare
lineare


trigonale planare angolare



tetraedrica piramide trigonale Angolare




bipiramide trigonale altalena a forma di T lineare



ottaedrica piramide a base quadrata planare quadrata
secondo questo metodo la molecola BF3 non possiede un doppietto libero( E) quindi la sua struttura è del tipo 
cioè planare trigonale .
Risposta corretta C
3. Indicare la specie che con il legame covalente dal carattere più polare tra le seguenti:
A) SrO
B) CO
C) KI
D) NO
SOLUZIONE
Atomi isolati possiedono diversi valori di energia di ionizzazione (facilita’ a perdere elettroni) e di affinita’ elettronica (facilita’ ad acquistare elettroni).Quando però due atomi si legano con un legame chimico, se gli atomi sono di natura diversa, gli elettroni di legame non sono condivisi equamente fra i due atomi come avviene per il legame tra atomi uguali, per cui la densità’ elettronica (la nuvola elettronica del legame ) può risultare concentrata maggiormente verso quell’atomo che possiede maggiore elettronegatività. Questo determina la formazione di un eccesso di carica negativa sull’atomo verso cui la densita’ elettronica e’ maggiormente sbilanciata, e un eccesso di carica positiva sull’altro atomo: ![]() . L’elettronegatività di un atomo è quindi la capacità di attrarre verso di sè gli elettroni di un legame. Le elettronegatività degli atomi sono state calcolate in più modi per cui esistono più scale di elettronegatività.
. L’elettronegatività di un atomo è quindi la capacità di attrarre verso di sè gli elettroni di un legame. Le elettronegatività degli atomi sono state calcolate in più modi per cui esistono più scale di elettronegatività.
LA SCALA DI PAULING è stata la prima scala di elettronegatività costruita attribuendo all’elettronegatività di un elemento un valore arbitrario e ricavandone i valori relativi degli altri atomi attraverso la formula
dove XA ed XB sono le elettronegatività degli atomi A e B e Δ è
Dove EAB è l’energia di legame del composto A-B, EAA l’energia di legame del composto A-A, e EBB l’energia di legame del composto B-B.
SCALA DI MULLIKEN
L’elettronegatività è misurata dalla media aritmetica tra l’Energia di ionizzazione(EA) e l’Affinità elettronica(I) degli atomi isolati
Scala di Allred-Rochow
ricordando che un elettrone è attratto da un atomo per effetto della Forza di Coulomb esercitata dal nucleo:
dove Z* è la carica nucleare efficace (che tiene conto dell’effetto di schermo degli elettroni intorno al nucleo)
L’elettronegatività deve essere proporzionale alla forza F
dove r è il raggio covalente dell’atomo e le costanti numeriche sono tali da ottenere dei valori compatibili con la scala di Pauling
Secondo la scala di Pauling
K=0,42 Sr = 0,95 C=2,55 N= 3,04 ed O= 3,44
L’ossido di stronzio è un tipico composto ionico e cristallizza in una struttura tipo NaCl dove cationi e anioni hanno coordinazione ottaedrica.
KI è una molecola ionica quindi non è polare
N ed O hanno quasi uguale elettronegatività per cui la molecola NO non può essere polare.
tra C ed O la differenza di elettronegatività è circa 1 pertanto questa molecola è polare.
Risposta corretta B
4. Indicare il tipo di interazione intermolecolare che si avrà tra H2O ed etanolo (CH3CH2OH):
A) di London
B) ione – dipolo indotto
C) dipolo permanente – dipolo indotto
D) legame a idrogeno
SOLUZIONE
L’ALCOL ETILICO CH3CH2OH possiede un atomo di ossigeno con 2 doppietti elettronici non impegnati nel legame,il che permette all’ H dell’acqua di instaurare con esso un legame idrogeno


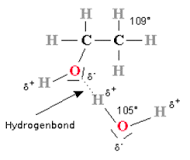
risposta corretta D
5. Un comune metodo di laboratorio per produrre ossigeno gassoso è scaldare il clorato di potassio, KClO3. La reazione da bilanciare è la seguente:
KClO3 (s) →KCl (s) + O2 (g)
Calcolare quanti grammi di KClO3(s) devono essere decomposti per produrre 16,0 g di O2:
A) 81,6 g
B) 40,8 g
C) 20,4 g
D) 61,3 g
la reazione bilanciata è 2KClO3 (s) →2KCl (s) + 3 O2(g)
quindi da 2 x 122,55 g di KClO3 si ottengono 3 x 32 g di O quindi da X se ne otterranno 16g
245,1 : 96 = X : 16
X= 245,1 x 16 / 96 = 40,8 g
risposta corretta B
6. Individuare lʼaffermazione ERRATA tra le seguenti. Il raggio atomico del silicio è:
A) maggiore di quello del carbonio e minore di
quello dello stagno
B) maggiore di quello dello zolfo e minore di
quello del sodio
C) maggiore di quello dellʼalluminio e minore di
quello del germanio
D) minore di quello del piombo e maggiore di
quello del carbonio
SOLUZIONE
DALLA TAVOLA DEI VALORI DEL RAGGIO ATOMICO
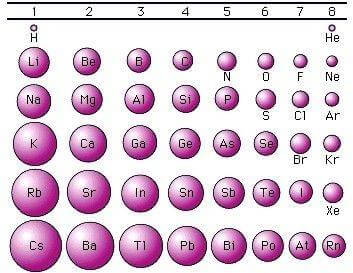
si nota che il raggio atomico diminuisce lungo un periodo( orizzontale) ma aumenta lungo un gruppo (verticale). Dai dati si osserva che la definizione errata è C
7. Secondo la teoria VSEPR quali delle seguenti coppie di molecole presentano la stessa geometria?
A) CO2 HCN
B) CO2 H2O
C) H2O HCN
D) HCN H2S
SOLUZIONE
secondo la teoria VESPR metodo AXE la CO2, avendo 2 coppie di lone pair (doppietti liberi) deve avere la struttura
![]() mentre H2S ed H2O hanno struttura tetraedrica, ne consegue che HCN ha la stessa orientazione spaziale di CO2 cioè lineare.
mentre H2S ed H2O hanno struttura tetraedrica, ne consegue che HCN ha la stessa orientazione spaziale di CO2 cioè lineare.
la risposta corretta è A
8. Tra le seguenti specie indicare quella che non presenta legami covalenti.
A) PF6
B) Cs2O
C) NO
D) NH4
SOLUZIONE
Nel Cs2O è il Cs(+) a formare strati e gli ioni O(2-) occupano i siti ottaedrici tra coppie alternate di strati Cs(+). Essendo il Cesio un elemento fortemente elettropositivo, i sali di Cesio sono fortemente ionici con gli ioni cesio circondati da 3 atomi di O tutti situati su un lato.

La struttura è tenuta insieme mediante legami tra ioni cesio in strati adiacenti. Questo è uno dei pochi casi in cui il raggio ionico del catione risulta maggiore del raggio ionico dell’anione .
Ciò detto è chiaro che la molecola con legami non covalenti è Cs2O
risposta corretta B
9. Lʼisotopo 17 dell’Ossigeno è costituito da:
A) 17 neutroni
B) 17 protoni
C) 9 neutroni, 8 protoni
D) 8 neutroni, 9 protoni
SOLUZIONE
In natura gli elementi possono essere presenti in forme che differiscono tra loro per un diverso peso dell’atomo, ognuno dei quali è presente in una percentuale ben definita. Questi atomi vengono chiamati isotopi. Per esempio l’ossigeno è presente in natura sotto forma di 3 isotopi O 16, O17 ed O18 . Il peso di un atomo non è altro che la somma del numero di protoni e dei neutroni presenti.
PESO DI UN ATOMO= PESO PROTONI + PESO NEUTRONI
Poiché per uno stesso atomo il numero di protoni è sempre uguale al numero di elettroni, è evidente che la differenza di peso tra un isotopo ed un altro dipende dal numero differente di neutroni.
Il peso di un atomo che è indicato nella tavola periodica degli elementi è il valore medio che si ottiene moltiplicando il peso di ogni singolo isotopo per la sua percentuale in natura e dividendo per 100 . Quindi per un numero i di isotopi si ha:
Peso atomico = (abbondanza isotopo 1 x massa isotopo 1) +(abbondanza isotopo 2 x massa isotopo 2) +….+(abbondanza isotopo i x massa isotopo i) /100
L’isotopo 17 dell’ossigeno possiede 8 elettroni quindi 8 protoni ed essendo il peso dell’isotopo 17 possiede necessariamente 9 neutroni (il peso dipende dalla somma protoni+ neutroni).
risposta corretta C
10. Indicare, tra le seguenti, lʼaffermazione corretta riguardo a HCN:
A) ha un legame triplo ed un legame doppio
B) ha un legame singolo ed un legame doppio
C) ha due legami doppi
D) nessuna delle precedenti opzioni è corretta
SOLUZIONE
Il legame tra C ed N è un legame triplo ed il legame con l’H è semplice.
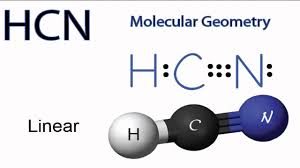
Sia il C che l’N utilizzano 2 orbitali PURI diretti secondo gli assi cartesiani Py e Pz che formano 2 legami π mentre il legame diretto secondo l’asse che unisce C ad N è un legame σ costituito da un ibrido SP lineare
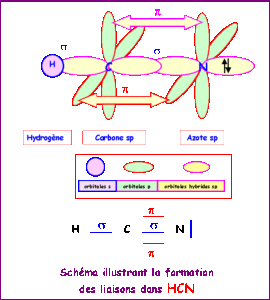 .
.
la risposta corretta è D infatti nessuna delle precdendi risposte A,B,C è corretta
11. In un ripostiglio di 6 m2 e alto 3 m chiuso ermeticamente si verifica una perdita di gas metano.
Quando la falla viene riparata, nel locale si raggiunge una pressione parziale di metano pari a 1,5 atm alla
temperatura di 25 °C. Determinare la quantità di metano presente nel ripostiglio:
A) circa 18 g
B) circa 36 g
C) circa 18 kg
D) circa 36 kg
SOLUZIONE
Il volume occupato dal gas è V = 6 x 3 = 18 m3 = 18000 litri
La pressione P = 1,5 atm
La temperatura è T= 25 +273 = 298 K
Per calcolare le quantità di metano applichiamo l’equazione generale di stato dei gas :
PV=g/PM RT
da cui g = PV x PM / RT
g= 1,5 x 18000 x 16 / 0,0821 x 298 = 1,5 x 18000 x 16 /24,46 = 17705 g
circa 18 Kg
risposta corretta C
12. Una soluzione acquosa di HCl al 37% m/m ha densità pari a 1,20 g/mL. Calcolare la concentrazione
molare dellʼacido:
A) 12,2 M
B) 1,22 M
C) 2,44 M
D) 24,4 M
SOLUZIONE
dal valore della densità sappiamo che 1000 ml contengono 1200 g di HCl ma l’acido non è al 100% ma al 37% quindi
se in 100 g vi sono effettivamente 37 g allora in 1200 g vi saranno X g effettivi
100:37 = 1200:X X= 444 g
per conoscere la Molarità dobbiamo calcolare le moli che corrispondono a 444 g di HCl
se 1 mole corrisponde a 36,5 g allora X moli corrispondono a 444 g
X= 444/36,5=12,16 moli
Pertanto in 1 litro di acido al 37% la cui densità è 1,2g/ml vi sono 12,16 moli quindi la Molarità dell’acido in esame è 12,2 M
risposta corretta A
13. Quanti grammi di ossigeno si ottengono dalla decomposizione di una mole di KMnO4?
A) 40,5 g
B) 64,0 g
C) 32,0 g
D) 16,0 g
SOLUZIONE
la reazione di decomposizione del Permanganato è la seguente:
4 KMnO4 -> 2 K2O +4 MnO2 + 3 O2
da questa si osserva che da 4 moli di KMnO4 si ottengono 3 moli di O2 quindi da 1 mole di KMnO4 si ottengono 3/4 di O2
cioè da 4 x 158 g di KMnO4 si ottengono 3 x 32 g = 24 g
Le risposte date sopra al quesito così come è stato proposto , a mio avviso sono ERRATE,in quanto dalla decomposizione del permanganato si producono solo 3 moli di O2. Se però il quesito è inteso :” calcolare quanto ossigeno si può ottenere da 1 mole di Permanganato ( ma non dalla decomposizione di una mole!!!) ” allora 1 mole può dare origine a 4 x 16=64 g in totale di Ossigeno.In tal caso e solo in tal caso, la risposta corretta è B
14. Con un costo dellʼoro di 34,4 €/g, calcolare quanto costa ogni atomo d’oro.
A) 4,09 ·l0-27€/atomo
B) 1,12 ·10-20 €/atomo
C) 1,12 ·10-23€/atomo
D) 67,8 €/atomo
SOLUZIONE
197 g (peso atomico dell’oro) contengno 6,02 x 10 23 atomi quindi 1 atomo è contenuto in X g
197: 6,02 x 10 23 = 1 : X X= 3 x 1021
3 x 1021 : 34,4 euro = 1 : X X= 11,46 x 10-21
1 atomo di ORO costa 1,15 x 10 –20 EURO
15. Calcolare la percentuale in peso di ossigeno nel nitrito di sodio, NaNO2.
A) 46%
B) 30%
C) 23%
D) 63%
soluzione
in una quantità pari al Peso Molecolare di NaNO2 (69 g) vi sono 2 x 16 g di Ossigeno quindi in 100 ve ne sono X
69:32 = 100 :X X= 3200/69 = 46 %
risposta corretta A
16. La specie che abita il pianeta Trappist 561 possiede 12 dita. La regina del pianeta indossa su ogni dito un anello con un diamante di 0,500 cm3 (densità del diamante 3,55 g/mL). Quante moli di carbonio adornano le dita della regina?
A) 21,3 moli
B) 0,148 moli
C) 1,77 moli
D) nessuna delle precedenti risposte è corretta
soluzione
vi sono 12 diamanti il cui volume totale è 0,500 cc x 12 = 6 ml
dal valore della densità d=g / volume si ha g = dxV pertanto g= 3,55 x 6 = 21,3
essendo il PA del C pari a 12 si ha moli = 21,3 / 12 = 1,77
risposta corretta C
17. Indicare, nellʼordine, i coefficienti stechiometrici necessari a bilanciare la seguente reazione:
B2O3 + K2O→ K3BO3
A) 1, 1, 2
B) 1, 2, 2
C) 1, 2, 3
D) 1, 3, 2
soluzione
la reazone bilanciata è :
B2O3 + 3K2O→ 2 K3BO3
risposta corretta D
18. In un pallone vengono messe a reagire 3,0 moli di NaClO, 2,0 moli di Cr(OH)3 e 4,0 moli di NaOH
secondo la reazione (da bilanciare):
NaClO (aq) + Cr(OH)3 (aq) + NaOH (aq) → NaCl (aq) + Na2CrO4 (aq) + H2O (l)
Individuare il reagente limitante.
A) NaClO
B) Cr(OH)3
C) NaOH
D) i reagenti sono in quantità stechiometrica
soluzione
per risolvere il quesito occorre per prima cosa bilanciare la reazione che è una reazione redox in ambiente Basico fornito da NaOH ed in cui il cromo si ossida da +3 a +6 mentre ClO- forma Cl-
2[Cr+3 + 8OH- → CrO4-2 + 4H2O + 3 e
3[ClO- H2O + 2 e → Cl- + 2 OH-
______________________________________
2Cr+3 + 3ClO- + 16 OH- + 3 H2O → 2CrO4-2 + 8H2O + 3Cl- + 6 OH-
semplificando si ha
2Cr+3 + 3ClO- + 10 OH- + → 2CrO4-2 + 5H2O + 3Cl-
la reazione data sopra è così bilanciata:
3NaClO (aq) + 2 Cr(OH)3 (aq) + 4NaOH (aq) → 3 NaCl (aq) + 2 Na2CrO4 (aq) +5 H2O (l)
da questa reeazione si vede che occorrono 3 moli NaClO 2 moli di Cr(OH)3 e 4 moli di NaOH
le moli disponibili sono rispettivamente 3 2 e 4 e quindi le quantità sono quelle stechiometriche
risposta corretta D
19. Indicare il numero quantico principale n degli orbitali che hanno tutti i seguenti numeri quantici m:
-3, -2, -1, 0, 1, 2, 3 ?
A) 1
B) 2
C) 3
D) 4
soluzione
i numeri quantici sopra riportati corrispondono ai 7 orbitali f . Ciò significa che il numero quantico n =4. Infatti
dato un valore di n i valori di l sono tanti quanti sono i numeri che vanno da 0 ad n-1
per ogni valore di l i valori di m sono tanti quanti sono i valori compresi tra +l e -l compreso lo zero.
pertanto :
per n=1 l=o stato 1s m=0
quando n=2 abbiamo 2 valori di l
l= 0 stato 2s m=0
l=1 m=+1, 0,-1 (stati 2pX 2py 2pz)
quando n=3 abbiamo 3 valori di l
l=0 stato 3s m=0
l=1 m=+1,0,-1 (stati 3px3py3pz)
l=2 m= +2,+1,0,-1,-2 (5 stati 3d)
quando n= 4
l=0 stato 4s
l=1 m= +1,0,-1 (stati 4Px4py4pz)
l=2 m= +2,+1,0,-1,-2 (5 stati 4d)
l=3 m=+3.+2,+1,0,-1,-2,-3 (7 stati f)
risposta corretta D
20. Individuare il valore del coefficiente x.
C2H2 (g) + x O2 (g) → 2 CO2 (g) + H2O (g)
A) 5
B) 3/2
C) 1/2
D) nessuna dei precedenti è corretto
soluzioe
la reazione bilanciata è :
2 C2H2(g) + 5O2(g) ———-> 4CO2(g) + 2H2O(g)
il valore di x =5
risposta corretta A
21. Data la seguente reazione:
HF (aq) + OH-(aq) → F-(aq) + H2O (aq)
calcolare la costante di equilibrio.
A) 7,2 ·1010
B) 5,3 ·106
C) 9,2 ·1012
D) 2,8 ·107
soluzione
questa reazione è l’inverso della reazione di idrolisi di F-
e la K = [F-][H2O] / [HF] [OH-]
sappiamo però che HF è un acido debole e per la reazione HF<==> H+ + F-
Ka = [H+][F-] / [HF]
ciò detto sappiamo che
HF (aq) + OH-(aq) → F-(aq) + H2O (aq)
Keq = [F-] [H2O] / [HF][OH-] cioè essendo [H2O]=costante
Keq=[F-]/ [HF][OH-]
se moltiplichiamo numeratore e denominatore per [H+] si ha
Keq=[F-] [H+]/ [HF][OH-][H+] ma essendo [OH-][H+] = Kw ed [DF-]/[HF]=Ka si può scrivere
Keq = Ka /Kw = 7,2 x 10-4 / 10-14
Keq= 7,2 x 1010
risposta corretta A
- Calcolare la % (m/m) di NaOH in una soluzione acquosa di NaOH 4,0 N con densità di 1,15 g/mL.
- A) 10,4%
- B) 22,7%
- C) 18,1%
- D) 13,9%
Soluzione
Una soluzione 4 N contiene 4 equivalenti per litro
( ricorda che 1 equivalente =PM / numero degli atomi di idrogeno o numero di cariche dell’elemento a sinistra nella formula oppure, ma se si ha una molecola o atomo in una reazione redox
1 equiv = PM/numero elettroni scambiati nella reazione)
Pertanto 4 equivalenti di NaOH corrispondono a PM x 4/1 g cioè g = 4 x 40 =160 g
Essendo la densità = 1,15 g/ml in realtà i grammi contenuti sono corrispondenti a 160/1,15 = 139 g
Quindi la % di NaOH è se in 1000 ve ne sono in realtà139 allora X saranno contenuti in 100
139: 1000 = X :100 X= 139 x 100 / 1000 = 13900 /1000 = 13,9 %
- In una soluzione 0,080 M di un sale M2Y3, si stabilisce lʼequilibrio:
M2Y3 (aq)→2 M3+(aq) + 3 Y2–(aq)
Sapendo che allʼequilibrio [Y2–] = 0,030 M, calcolare il grado di ionizzazione del sale.
- A) 43,2%
- B) 7,6%
- C) 12,5%
- D) 55,79%
Soluzione
Il grado di dissociazione che si indica con α indica di quanto si dissocia una molecola . Nel caso specifico la reazione è :
M2Y3 (aq)→ 2 M3+(aq) + 3 Y2–(aq)
n( 1-α) n2 α n 3 α
all’equilibrio [Y2–] = 0,030 M questa quantità corrisponde a 0,08( (3 x α)
quindi
0,03= 0,08 x 3 x α da cui α = 0,03/ 0,24 = 0,125
Il grado di ionizzazione α per la reazione data è : 12,5%
Risposta corretta C
24-Quanta acqua bisogna aggiungere a 30,0 g di una soluzione al 33,0% di LiCl, per ottenere una
soluzione al 27,0% dello stesso sale?
- A) 6,7 g
- B) 15,3 g
- C) 4,8 g
- D) 20,3 g
Soluzione
Utilizziamo il sistema a croce :
33 27
27
0 6
Da ciò si evince che ogni 27 parti di soluzione al 33 % occorre usare 6 parti di acqua pertanto per 33 g occorre usare
27 :6 = 33 :X
X= 180 / 27 =6,6 g
Risposta corretta A
25-Si consideri la seguente reazione nucleare:
7 4Be + x →7 3Li
Indicare cosa rappresenta x.
- A) un elettrone
- B) un protone
- C) un neutrone
- D) una particella alfa
Soluzione
Il berillio possiede 4 protoni e 4 elettroni ed essendo il numero di massa pari a 7 possiede anche 3 neutroni.E’ chiaro che protoni, neutroni o particelle alfa modificherebbero il numero di massa. Poiché il numero di massa rimane sempre uguale (7) è evidente che X non può essere né un protone, né un neutrone,né una particella alfa. Si tratta quindi di un decadimento beta (la particella beta è un elettrone)
Il nucleo può catturare uno degli elettroni che si trovano negli strati più interni producendo una radiazione gamma
p+ + b– → n per esempio
![]()
Da quanto sopra si evince che X è un elettrone
Risposta corretta A
26-Calcolare il volume di aria, misurato a 273,15K e 1,01 ·105 Pa, necessario per bruciare completamente 100 g di zolfo, secondo la reazione:
S (s) + O2 (g) ® SO2 (g)
Si consideri la composizione % in volume dellʼaria: 21% O2 e 79% N2.
- A) 476 L
- B) 333 L
- C) 298 L
- D) 546 L
Soluzione
Dalla reazione si evince che per bruciare 32 g (il peso di 1 mole di zolfo) occorrono 32 g di ossigeno quindi per 100 g ne occorrono 100 g che corrisponde ad un volume calcolabile dalla equazione di stato dei gas:
PV= 100/32 RT V= RT/P V= 3,12 8,314x 273,15 / 1,01 x 105 = 70,15 litri
Ma l’ossigeno nell’aria rappresenta il 21% quindi
Se 70,15 rappresenta il 21% = X sarà il 100% X= 334 litri
Risposta corretta B
27. Ad una certa temperatura, le tensioni di vapore di acetone e di etanolo sono, rispettivamente: 3,0 ·104Pa e 1,2 ·104 Pa. Calcolare la tensione di vapore di una miscela ideale costituita dal 40% (mol/mol) di acetone e dal 60% (mol/mol) di etanolo, alla stessa temperatura.
A) 1,1 ·104 Pa
B) 2,5 ·104 Pa
C) 1,9 ·104 Pa
D) l,3 ·104 Pa
soluzione
le molecole che costituiscono un liquido sono in continuo movimento tuttavia subiscono forze di attrazione in ogni direzione. Le molecole che si trovano sulla superficie, però, non subendo alcuna attrazione nella parte superiore, tendono a passare nell’atmosfera ma vengono bloccate dalla pressione che questa esercita sulla superficie del liquido. Se però il liquido viene posto in un recipiente chiuso in cui è fatto il vuoto, le molecole dalla superficie passano allo stato di vapore con una certa velocità V1. Nel loro movimento caotico, molte molecole però colpiscono la superficie del liquido e quì vengono attratte con una velovità V2. Inizialmente, il numero di molecole che passano allo stato di vapore è maggiore del numero di molecole che condensano e passano nel liquido, ma quando le due velocità divengono uguali V1=V2 ed allora il vapore è in equilibrio dinamico col liquido. Se a questo punto misuriamo la pressione esercitata dal vapore (sia sulla superficie che sulle pareti del recipiente), quel valore misurato in quelle condizioni di equilibrio viene definito TENSIONE DI VAPORE.
VAPORE
↑ ↑ ↑
↔M→ ↔M→ ↔M→ LIQUIDO
↓ ↓ ↓
quindi possiamo applicare al vapore le leggi dei gas.
(Voglio ricordare che la differenza tra un gas ed un vapore è che si definisce vapore un gas in presenza del proprio liquido. Ad esempio vapori di Ossigeno è gas ossigeno in presenza dell’ossigeno liquido).
nel caso del quesito, trattandosi di due tipi di vapore ognuno con la propria tensione, ambedue contribuiscono alla tensione di vapore totale che è quindi
P = P1 + P2
Nel caso specifico acetone ed etanolo contribuiscono rispettivamente col 40 % e col 60 % alla tensione di vapore totale quindi il contributo alla tensione di vapore totale è:
Pacet= 0,4 x 3,0 ·104 e Petan = 0,6 x 1,2 ·104 Ptot= Pacet + Petan
Ptot = 1,2 x 10 4 +0,72 x 104 = 1,92 x 104 Pa
risposta corretta C
28. Il limite di infiammabilità di un solvente è la minima concentrazione del solvente % (v/v) nellʼaria necessaria a provocare unʼesplosione per innesco con una fiamma libera. Per lʼacetone, tale limite è 2,6% (v/v) a 298,15 K. Quanti kg di acetone devono essere vaporizzati in un deposito di dimensioni, in metri,
5 x 4 x 3 per raggiungere il limite di infiammabilità?
A) 8,5 kg
B) 3,7 kg
C) 4,9 kg
D) 6,5 kg
soluzione
il 2,6% del volume totale che è V= 5 x 4 x 3 =60 m3 corrisponde a 1,56 m3 cioè 1560 l
a questo volume (che deve essere espresso in litri) corrispondono le moli calcolate da PV=nRT 1 x 1560 =n x 0,0821 x 298,15 (la pressione è quella atmosferica quindi 1 atm)
n= 63,75 da cui si ha g =n x PM = 63,75 x 58 = 3697 g = 3,7 Kg
risposta corretta B
29. Qual è lʼelemento il cui triossido ha una massa molecolare di 100 u?
A) Re
B) V
C) Cr
D) W
soluzione
Il triossido contiene 3 atomi di ossigeno cioè 48 u per cui X+48 = 100g X= 52 u
questo peso atomico corrisponde al Cromo Cr
risposta corretta C
30. Calcolare la concentrazione molare di Cl- in unasoluzione acquosa ottenuta mescolando 250 mL di
una soluzione di NaCl 0,010 M e 150 mL di una soluzione di BaCl2 0,020 M. I volumi siano additivi.
A) 0,052M
B) 0,021M
C) 0,088M
D) 0,067M
soluzione
La quantità di NaCl conenuta in 250 ml di soluzione è data da mmoli =ml x Molarità
250 x 0,010 = 2,5 mmoli= 0,0025 moli
In 150 ml di BaCl2 vi sono 150 x 0,02 x 2 mmoli= 6 mmoli= 0,006 moli
Perché in 1 mole di BaCl2 vi sono 2 di Cl- quindi la concentrazione va moltiplicata per 2
Quindi in un totale di 250 +150 = 400 ml vi sono in totale 0,006 +0,0025 moli cioè 0,0085 moli di Cl-
Pertanto se in 400 ml vi sono 0,0085 moli in 1000 : X
X = 8,5 /400 = 0,0212 moli in 1 litro quindi la molarità di Cl- è pari a 0,0212
Risposta corretta B
31- Calcolare quanti grammi di zolfo solido si producono ossidando 35,0 g di Na2S sciolto in unasoluzione contenente solfito di sodio in eccesso, secondo la reazione (da bilanciare):
S2-(aq) + SO32-(aq) + H+(aq) à S(s) + H2O (aq)
A) 43,8 g
B) 21,5 g
C) 57,2 g
D) 13,9 g
Soluzione
La reazione redox è
4[S-2 → S +2e
2[SO3-2 + 4 e + 6H+ → S + 3H2O
____________________________
2S-2 + SO3-2 +6H+ → 2S + S +3H2O
Pertanto da 2 moli (2 x 78 g) di Na2S si ottengono 3 S quindi da 35 g se ne ottengono X
156 : 3x 32 = 35 :X X= 96x 35 / 156 = 21,5 g
32-Una miscela gassosa contiene il 30% (m/m) di F2 (g) ed il 70% di Cl2 (g). Sapendo che 3,10 g di miscela gassosa occupano 1,70 L a 298 K, calcolare
le pressioni parziali dei due gas
A) p(F2(g)) = 8,6 ·105 Pa ; p(Cl2(g)) = 9,7 ·105 Pa
B) p(F2(g)) = 3,6 ·105 Pa; p(Cl2(g)) = 4,5 ·104 Pa
C) p(F2 (g)) = 6,2 ·105 Pa; p(Cl2(g)) = 7,4 ·107 Pa
D) p(F2 (g)) = 5,8 ·105 Pa; p(Cl2(g)) = 8,4 ·107 Pa
Soluzione
Dai dati del quesito si evince che in 3,1 g di miscela vi sono
0,93 g di F2 2,17 g di Cl2
Ad ognuna di queste quantità corrisponde una pressione parziale ottenibile da
PV= nRT quindi se consideriamo il Cloro avremo
Pressione parziale di Cl2 = (2,17 /71) x 0,0821 x 298 /1,7 = 0,439 atm che corrispondono a
1 atm : 101325 =0,439 :X X=4,48 x 104 Pa
Analogo calcolo porta a PF2= 3,6 x 105
P= (0,93 /38 ) x 8314 0 x 298 /1,7 = 3,6 x105
Risposta corretta B
33. Calcolare il pH a cui inizia a precipitare Co(OH)2 (s) (Kps = 2,5 ·10-16), se, ad una soluzione 0,010M di CoCl2, si aggiunge NaOH solido.
A) 9,3
B) 6,8
C) 10,6
D) 7,2
soluzione
Il precipitato si ottiene quando il prodotto delle concentrazioni di Co ed OH- supera il valore del KPS. La concentrazione di OH- a cui inizia la precipitazione è ottenibile da
Kps= [OH-]2 x [Co] in questa espressione [Co] = 0,01 M
Kps /0,01 = [OH-]2 quindi 2,5 x 10-16 / 0,01 = [OH-]2
[OH-] = √2,5 x 10-14 = 1,58 x 10-7 M POH= 7-log 1,58= 6,8 PH= 14-6,8= 7,2
risposta corretta D
34. Un ossido di azoto gassoso NxOy. ha una densità di 1,34 kg/m3 a 283,15 K ed a 1,01 ·105 Pa. Qual è la sua formula minima?
A) NO
B) NO2
C) N2O3
D) N2O5
soluzione
per conoscere la formula minima occore conoscere il peso molecolare e trattandosi di un gas si ha
PV=( g/PM) x RT da cui PM = gx RT / PV g/V non è altro che la densità = 1340 g/ 1000
PM= 1,34 x 0,0821 x 283,15 / 1 = 31,15 g
la formula minima corrisponde alla formula NO che ha una massa molecolare di 30 g
risposta corretta A
35. Il P4O10 in acqua si trasforma in H3PO4 secondo la reazione (da bilanciare):
P4O10 (s) + H2O(l) → H3PO4 (aq)
Calcolare la concentrazione molare di una soluzione di H3PO4 ottenuta sciogliendo 25,0 g di P4O10 in 10,0 L di acqua. (Si assuma che la densità della soluzione sia 1,0 g/mL)
A) 0,035M
B) 0,011M
C) 0,044M
D) 0,074M
soluzione
la reazione bilanciata è la seguente:
P4O10 + 6 H2O→ 4 H3PO4
284 g formano 4 x 98 g di acido quindi 25 grammi formano 34,5 g
34,5 grammi /98 = 0,352 moli in 10 litri producono una Molarità pari a 0,0352 M
risposta corretta A
36. Calcolare quanti grammi di Na3PO4 (s) bisogna sciogliere in 0,500 L di acqua affinché la concentrazione degli ioni Na+ nella soluzione sia 0,15 M (si assuma costante il volume).
A) 7,51 g
B) 3,44 g
C) 4,10 g
D) 9,22 g
soluzione
0,15 M significa che in 1000 ml devono esserci o,15 grammoioni di Na (Na+)
0,15 grammoioni di Na corrispondono a 0,15 x 22,9 = 3,45 g
quindi se da Na3PO4 si otttengono nella soluzione 3 di Na+ da quanti grammi di Na3PO4 si ottengono 3,45 g di Na+ da mettere in un litro di acqua per avere la soluzione 0,15 M?
164 g : 3 x 22,99 g = X : 3,45 g
X= 565,8/68,97 = 8,2 g da porrei in 1000 ml di acqua
pertanto in 0,5 litri cioè in 500 ml se ne dovranno mettere 4,1 g
risposta corretta C
37. Mantenendo costante il numero di moli, un aumento simultaneo della pressione e del volume di un gas ideale determina:
A) un aumento della temperatura
B) una diminuzione del prodotto tra pressione e
volume
C) una separazione di fase
D) nessuna delle risposte precedenti è corretta
soluzione
essendo PV= nRT ed essendo n costante allora un aumento di P o di V o di ambedue i parametri determinano un aumento di temperatura T
risposta corretta A
38. Calcolare la quantità di calore che occorre fornire ad una mole dʼacqua per riscaldarla da 20 °C a 40 °C. La capacità termica specifica dellʼacqua è 4,184 J K-1g-1 (si trascuri il contributo delle dispersioni e della capacità termica della contenitore).
A) 1,5 J
B) 15 kJ
C) 1500 kJ
D) 1,5 kJ
soluzione
sappiamo che la quantità di calore necessaria per aumentare la temperatura da T1 a T2 (ΔT) è
Q = grammi si sostanza x calore specifico x ΔT Q si esprime in J
dove calore specifico è la quantità di calore necessaria per aumentare di 1 grado la temperatura
ne consegue che Q= 18 g (1 mole di H2O) x 4,184 x (40-20) = 1506 J = 1,5 KJ
risposta corretta D
39. Lʼanidride solforosa ha una geometria (posizione media relativa degli atomi):
A) lineare
B) angolare, con angolo di legame di circa 120°
C) angolare, con angolo di legame di circa 109°
D) angolare, con angolo di legame di circa 90°
soluzione
La teoria Valence Shell Electron Pair Repulsion proposta dal chimico americano Gillespie è utilizzata per valutare la geometria di una molecola semplicemente considerando che gli elettroni dei legami di una molecola tendono a disporsi il più lontano possibile a causa delle repulsioni reciproche. I doppietti elettronici non impegnati in legame( coppie solitarie o lone pair) si respingono con maggior forza rispetto a quelli impegnati nei legami. In generale viene usato il cosiddetto metodo AXE .
La sigla AXE rappresenta con la lettera A l’atomo centrale e ha sempre come valore sottinteso 1.
La X rappresenta il numero di legami sigma che si formano tra l’atomo centrale e gli atomi ad esso legati. I legami covalenti multipli (doppi, tripli) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti sull’atomo centrale. La somma di X ed E, definita come NUMERO STERICO , ed è associata anche al numero totale di orbitali ibridi.
![]() lineare
lineare


trigonale planare angolare



la struttura di SO2 corrisponde alla forma angolare possedendo lo S doppietti elettronici liberi (E E )per cui l’angolo di legame che dovrebbe essere quello relativo all’ ibridizzazione SP2 cioè 120° è in realtà 119° a causa della repulsione dei doppietti liberi sullo S.
risposta corretta B
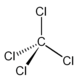
40. Quale delle seguenti formule molecolari può generare isomeri costituzionali?
A) CH3Cl
B) C2H5Cl
C) C3H8
D) C2H4Cl2
soluzione
Isomeri costituzionali sono anche detti isomeri di struttura. Sono composti che possiedono la stessa formula grezza, ma diversa formula di struttura.
CH3Cl non può avere isomeri di struttura essendo i 4 legami del carbonio uguali ed analogamente le strutture C2H5Cl e C3H8.
Invece il composto C2H4Cl2 dicloroetano,ha due possibili strutture una in cui i due atomi di cloro si trovano dalla stessa parte (isomero CIS) ed una in cui i due atomi di cloro si trovano su 2 piani diversi (isomero TRANS)
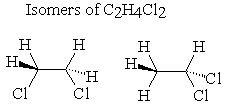
cis trans
risposta corretta D
Qui continuano i quesiti 41-60 della classe A
41. Qual è lo stato di ossidazione dello zolfo nel solfuro di calcio?
A) -2
B) 2
C) 0
D) nessuno dei precedenti
soluzione
il solfuro di calcio ha formula CaS quindi lo zolfo possiede un n.o. = -2
risposta corretta A
42. Indicare lʼaffermazione ERRATA sullʼenergia di prima ionizzazione del berillio:
A) è maggiore di quella del litio
B) è minore di quella del calcio
C) è minore di quella del fluoro
D) è maggiore di quella del magnesio
soluzione
L’ energia di ionizzazione è l’energia richiesta per rimuovere una mole degli elettroni più esterni di un atomo da una mole di atomi gassosi per produrre 1 mole di ioni gassosi ciascuno con una carica 1+.
simbolicamente scriviamo:
Quando parliamo di energia di ionizzazione è fondamentale ricordare che ci riferiamo a moli di elemento allo stato gassoso.
Le energie di ionizzazione sono misurate in kJ mol-1 (kilojoule per mole). Hanno dimensioni variabili da 381 (che è un valore molto basso) fino a 2370 (che è molto alto).Tutti gli elementi hanno una prima energia di ionizzazione e la ragione per cui l’elio (1 ° I.E = 2370 kJ mol-1) non forma normalmente uno ione positivo è a causa dell’enorme quantità di energia che sarebbe necessaria per rimuovere uno dei suoi elettroni.
Se valutiamo le E.I. degli elementi della tavola periodica vediamo un andamento come in figura:
Il litio ha struttura 1s22s1. Il suo elettrone esterno si trova nel secondo livello di energia, molto più distante dal nucleo. Si potrebbe sostenere che ciò sarebbe compensato dal protone addizionale nel nucleo, ma l’elettrone non percepisce la piena attrazione del nucleo – è schermato dagli elettroni 1s2.Possiamo quindi pensare che l’elettrone sia attratto solo da un protone 1+ (infatti dei tre 3 protoni due sono schermati dai due elettroni1s2).
Se si confronta il litio con l’idrogeno (anziché con l’elio), l’elettrone dell’idrogeno percepisce anche una trazione di 1+ dal nucleo, ma la distanza è molto maggiore con il litio. La prima energia di ionizzazione del litio scende a 519 kJ mol-1 mentre quella di idrogeno è 1310 kJ mol-1.
La principale differenza è il numero crescente di protoni nel nucleo mentre si passa dal litio al neon. Ciò provoca una maggiore attrazione tra il nucleo e gli elettroni e quindi aumenta le energie di ionizzazione. In effetti, l’aumento della carica nucleare trascina anche gli elettroni esterni più vicino al nucleo :questo aumenta le energie di ionizzazione ancora di più lungo il periodo.
Perché il calo tra i gruppi 5 e 6 (N-O e P-S)?
Ancora una volta, ci si potrebbe aspettare che l’energia di ionizzazione dell’elemento del gruppo 6 sia superiore a quella del gruppo 5 a causa del protone extra. Che cosa sta compensando questa volta?
Mentre si scende in un gruppo nella Tavola periodica, le energie di ionizzazione generalmente cadono. Avete già visto prove di ciò nel fatto che le energie di ionizzazione nel periodo 3 sono tutte inferiori a quelle del periodo 2.
Prendendo il gruppo 1 come esempio tipico:
N 1s22s22px12py12pz1 1o I.E. = 1400 kJ mol-1
O 1s22s22px22py12pz1 1st I.E. = 1310 kJ mol-1
Lo screening è identico (dal 1s2 e, in una certa misura, dagli elettroni 2s2), e l’elettrone viene rimosso da un orbitale identico.
La differenza è che nel caso dell’ossigeno l’elettrone che viene rimosso è uno della coppia 2px2. La repulsione tra i due elettroni nello stesso orbitale significa che l’elettrone è più facile da rimuovere di quanto sarebbe altrimenti.
La diminuzione dell’energia di ionizzazione allo zolfo è spiegata allo stesso modo.
Perché il valore del sodio è inferiore a quello del litio?
Ci sono 11 protoni in un atomo di sodio, ma solo 3 in un atomo di litio, quindi la carica nucleare
è molto più grande. Potresti aspettarti un'energia di ionizzazione molto più grande nel sodio, ma
compensare la carica nucleare è una distanza maggiore dal nucleo e più uno screening.
| Li | 1s22s1 | 1st I.E. = 519 kJ mol-1 | ||
| Na | 1s22s22p63s1 | 1st I.E. = 494 kJ mol-1 |
L'elettrone esterno del litio si trova nel secondo livello e ha solo gli elettroni 1s2 per schermarlo. L'elettrone 2s1 percepisce la attrazione di 3 protoni schermati da 2 elettroni cioè un' attrazione netta dal centro di 1+. L'elettrone esterno del sodio è nel terzo livello ed è schermato dagli 11 protoni nel nucleo per un totale di 10 elettroni interni. L'elettrone 3s1 percepisce anche una trazione netta di 1+ dal centro dell'atomo. In altre parole, l'effetto dei protoni extra è compensato dall'effetto degli elettroni di screening extra. L'unico fattore rimasto è la distanza extra tra l'elettrone esterno e il nucleo nel caso del sodio. Ciò riduce l'energia di ionizzazione. Spiegazioni simili sono valide mentre si scende nel resto di questo gruppo ed in qualsiasi altro gruppo.
A parte lo zinco alla fine, le altre energie di ionizzazione sono tutte uguali.
Tutti questi elementi hanno una struttura elettronica [Ar] 3dn4s2 (o 4s1 nei casi di cromo e rame). L'elettrone che viene perso
viene sempre dall'orbitale 4s.
Man mano che si passa da un atomo all’altro nella serie, aumenta il numero di protoni nel nucleo, ma anche il numero di elettroni 3d. Gli elettroni 3d hanno un effetto di schermatura, e il protone extra e l’elettrone 3d in più si annullano a vicenda per quanto riguarda l’attrazione dal centro dell’atomo.
L’aumento dello zinco è facile da spiegare.
| Cu | [Ar]3d104s1 | 1st I.E. = 745 kJ mol-1 | ||
| Zn | [Ar]3d104s2 | 1st I.E. = 908 kJ mol-1 |
In ogni caso, l’elettrone proviene dallo stesso orbitale, con uno screening identico, ma lo zinco ha un protone in più nel nucleo e quindi l’attrazione è maggiore. Ci sarà un grado di repulsione tra gli elettroni appaiati nell’orbitale 4s, ma in questo caso ovviamente non è sufficiente per compensare l’effetto del protone extra.
le energie di ionizzazione degli elementi saranno i principali fattori che contribuiscono all'energia di attivazione delle reazioni.
Ricorda che l'energia di attivazione è l'energia minima necessaria prima che si verifichi una reazione. Minore è l'energia di
attivazione, più veloce sarà la reazione - indipendentemente da quale sia l'energia complessiva che cambia nella reazione.
La caduta dell'energia di ionizzazione mentre si scende in un gruppo porterà a energie di attivazione inferiori e quindi a
reazioni più veloci.
In relazione a quanto sopra la risposta esatta è B
43. Il cloruro di idrogeno reagisce con il monossido di diidrogeno. Indicare i prodotti della reazione.
A) Cl2 , O2 , H2
B) Cl2 , HClO
C) Cl2 , O2
D) nessuna delle precedenti risposte è corretta
soluzione
Il cloruro di idrogeno è HCl
Il monossido di diidrogeno non è altro che H2O
ciò significa che non si ha alcun prodotto perché non vi è alcuna reazione.Si tratta solo di una diluizione di HCl con acqua.
risposta corretta D
44. Sulla base della formula di Lewis, della geometria molecolare e dellʼelettronegatività, indicare quali tra le seguenti molecole NON hanno carattere polare: CCl4 ; NH3 ; SF6 ; H2S ; BH3 ; NO2.
A) CCl4; SF6; NO2
B) CCl4; BH3; SF6
C) SF6; NH3; H2S
D) NH3; H2S; NO2
soluzione
quando il centro di massa delle cariche positive e negative di una molecola non coincidono si osserva una distribuzione di carica positiva e negativa che determina la formazione di un dipolo elettrico che viene caratterizzato da un momento di dipolo che è costituito da un vettore con intensità e direzione.
direzione
punto applicazione ——————>verso
< intensità >
La molecola di acqua presenta sull’ossigeno una densità di carica negativa e sull’idrogeno una densità di carica positiva a causa della forte differenza di elettronegatività cioè della differente tendenza ad attrarre gli elettroni di legame. L’ossigeno attrae gli elettroni del legame molto di più che l’idrogeno (possiede un’elettronegatività maggiore):

se consideriamo le singole strutture



vediamo che in CCl4 pur essendo presenti legami polari la somma dei singoli vettori risulta pari a 0 . BH3 a sua volta, possiede struttura planare in cui il centro delle cariche positive coincide con quelle negative quindi non risulta polare. SF6 ha una struttura in cui la somma dei vettori si annulla quindi la risposta esatta è B
45. Identificare la formula bruta del solfito ferrico.
A) Fe2(SO4)3
B) Fe3(SO3)2
C) FeSO3
D) Fe2(SO3)3
soluzione
il suffisso -ITO ci dice che l’atomo centrale possiede numero di ossidazione immediatamente più basso di quello massimo quindi lo zolfo che ha n.o. massimo + 6, nel solfito deve avere n.o.+4 pertanto lo ione solfito deve essere SO3-2 . Essendo il ferro ferrico significa che ha il n.o. massimo cioè +3 pertanto la formula del solfito ferrico è
Fe+3 SO3-2 –> Fe2(SO3)3
risposta corretta D
46. Indicare la formula bruta dellʼanidride solforosa.
A) SO2
B) SO3
C) H2SO3
D) H2SO4
soluzione
il suffisso oso si riferisce al n.o. immediatamente più basso del n.o. massimo di un elemento quindi l’anidride solforosa è un’anidride che deve avere lo S con n.o. immediatamente più basso di quello massimo che sappiamo essere +6.
quindi nell’anidride solforosa lo zolfo deve avere n.o. + 4 pertanto la formula deve essere SO2
risposta corretta A
47. Indicare lʼinterazione principale che si stabilisce quando lʼossigeno gassoso si scioglie in acqua.
A) di London
B) ione – dipolo
C) dipolo – dipolo indotto
D) nessuna delle precedenti
soluzione
Le forze di van der Waals, sono forze attrattive o repulsive tra molecole. Il termine include tre tipi diversi di interazione intermolecolari:
- forza dipolo permanente-dipolo permanente (o forza di Keesom);
- forza dipolo permanente-dipolo indotto (o forza di Debay);
- forza dipolo istantaneo-dipolo indotto (o fortza di dispoersione o di London).
abbiamo visto che l’acqua possiede un momento di dipolo fisso dovuto alla distribuzione delle cariche nella molecola e che l’ossigeno non possiede dipolo.Tuttavia, i doppietti elettronici dell’ossigeno vengono attratti dalla parte positiva del dipolo dell’acqua dando origine nell’ossigeno ad uno spostamento di carica elettrica del legame il che produce un dipolo indotto. Pertanto l’azione tra acqua ed ossigeno è relativa ad un’ interazione dipolo permanente-dipolo indotto (forza di Debay).
Risposta corretta C
48. Indicare la terna contenente solo ossidi acidi.
A) CO2 , CO , Na2O
B) CaO , CO2 , SiO2
C) CO2 , SiO2 , PbO2
D) SiO2 , N2O5 , P2O5
soluzione
non può essere la risposta A perchè Na2O è uin ossido basico in quanto in acqua forma NaOH una base.
non può essere B perchè CaO è un ossido basico che con acqua forma Ca(OH)2
non può essere C perchè PbO2 è un ossido basico che con acqua forma Pb(OH)2
la risposta corretta è D in quanto
SiO2 con H2O forma H2SiO3 (acido metasilicico) . N2O5 con H2O forma 2 HNO3 ed infine P2O5 con 3H2O forma 2 H3PO4 .
49. Quali orbitali ibridi sono utilizzati dallʼatomo di fosforo nella molecola PCl3?
A) sp
B) sp2
C) sp3
D) nessuno dei precedenti
soluzione
la struttura di PCl3 è tetraedrica (simile ad NH3) e quindi gli orbitali ibridi sono del tipo SP3.

risposta corretta C
50. Indicare la specie che non ha legami covalenti.
A) HNO3
B) SiF4
C) CaO
D) CaSO4
soluzione
l’acido nitrico ha la struttura seguente quindi possiede atomi legati con legame covalente
 così come
così come ![]() e
e 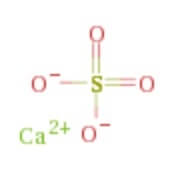
solo la molecola di CaO ha una struttura cristallina ionica infatti il calcio si trova sotto forma ionica Ca+2 e l’ossigeno O-2
ne consegue che la risposta corretta è C
51. Calcolare quanti atomi di calcio vi sono in 26,348 g di Ca(OH)2.
A) 2,141 ·1023
B) 0,3556 ·1023
C) 0,05905 ·10-23
D) 2,141 ·10-23
soluzione
se in Ca(OH)2 vi è 1 Ca in 26348 ve ne sono X 74,1 : 40 = 26,348 :X
X= 14,22 g di calcio
sappiamo che in 1 mole di atomi (40 g) vi sono 6,02 x 10 23 atomi quindi in 14,22 ve ne sono X
X = 85,6 x 10 23 / 40 =2,141 x 1023
Risposta corretta A
52. Indicare la configurazione elettronica dello ione Mo5+:
A) [Kr]
B) [Kr] s2d1
C) [Kr] s1
D) nessuna delle precedenti
soluzione
lo ione Mo+5 possiede la struttura elettronica di Mo senza 5 elettroni.
Sappiamo che la struttura elettronica di Mo è [Kr]4d55s1
quindi perdendo 5 elettroni perde i 5 elettroni d quindi la struttura di Mo+5 è [Kr] 5s1
risposta corretta C
53. Indicare la massa di un lingotto di piombo purissimo costituito da 12,044 ·1023 atomi di piombo.
A) 207 g
B) 103 g
C) 1410 g
D) 414 g
soluzione
se in 1 mole di Pb vi sono 6,02 x 1023 atomi 12,044 x 1023 atomi corrispondono a 2 moli di Pb che corrispondono a 207 x 2 = 414 grammi
risposta corretta D
54. Immergendo un foglio di alluminio in una soluzione acquosa di acido cloridrico si sviluppa un gas che risulta essere idrogeno. Quale delle seguenti affermazioni è FALSA?
A) lʼalluminio si ossida
B) lʼidrogeno si riduce
C) lʼalluminio si riduce
D) si forma AlCl3
soluzione
si forma AlCl3 secondo la reazione 2 Al + 6 HCl → 2 AlCl3 + 3 H2
quidi Al si ossida ad Al+3 ed H2 si forma da 2H+ quindi l’idrogeno si riduce da +1 a 0
l’affermazione falsa è quindi la C
55. Quale delle seguenti opzioni indica il corretto ordine di elettronegatività crescente?
A) O < Br < I < C
B) C < I < Br < O
C) Br < I < O < C
D) C < Br < I< O
soluzione
L’elettronegatività di un atomo è la capacità di attrarre verso di sé gli elettroni di un legame. Le elettronegatività degli atomi sono state calcolate in più modi per cui esistono più scale di elettronegatività.
LA SCALA DI PAULING è stata la prima scala di elettronegatività costruita attribuendo all’elettronegatività di un elemento un valore arbitrario e ricavandone i valori relativi degli altri atomi attraverso la formula
dove XA ed XB sono le elettronegatività degli atomi A e B e Δ è
Dove EAB è l’energia di legame del composto A-B, EAA l’energia di legame del composto A-A, e EBB l’energia di legame del composto B-B.
SCALA DI MULLIKEN
L’elettronegatività è misurata dalla media aritmetica tra l’Energia di ionizzazione(EA) e l’Affinità elettronica(I) degli atomi isolati
Scala di Allred-Rochow
ricordando che un elettrone è attratto da un atomo per effetto della Forza di Coulomb esercitata dal nucleo:
dove Z* è la carica nucleare efficace (che tiene conto dell’effetto di schermo degli elettroni intorno al nucleo)
L’elettronegatività deve essere proporzionale alla forza F
dove r è il raggio covalente dell’atomo e le costanti numeriche sono tali da ottenere dei valori compatibili con la scala di Pauling
Secondo la scala di Pauling i hanno le seguenti elettronegatività
C=2,55 O= 3,44 Br= 2,96 I= 2,66
ne consegue che l’ordine di elettronegatività è: O> Br>I>C
infatti lungo un gruppo l’elettronegatività diminuisce mentre lungo un periodo aumenta.
risposta corretta B
56. Quante moli di NO(g) si ottengono dalla decomposizione di 6,0 moli di HNO2 secondo la
reazione (da bilanciare):
HNO2 (aq) →N2O4 (g) + NO (g) + H2O (aq)
A) 1,0 mol
B) 1,5 mol
C) 4,3 mol
D) 3,0 mol
soluzione
la reazione bilanciata è: 4HNO2=2NO+ N2O4+ 2H2O
quindi se da 4 moli di HNO3 si ottengono 2 NO da 6 moli se ne ottengono X
X= 12/4 = 3 moli
riposta corretta D
57. In 10,0 L di una soluzione acquosa sono sciolti 17,2 mL di O2 (g) (misurati a 273,15 K e 1,01 ·105Pa).
Calcolare la molarità di O2 nella soluzione.
A) l,4 ·10-3 M
B) 7,7 ·10-5 M
C) 6,3 ·10-5 M
D) 1,5 ·10-5 M
soluzione
per calcolare la Molarità ( M= moli in 1 litro di soluzione) è necessario conoscere le moli di ossigeno ed essendo l’ossigeno un gas possiamo calcolarle dalla equazione generale di stato dei gas PV= moli x R x T
sappiamo che a zero gradi (273,15 K) ed 1 atmosfera (1,01 x 105 Pa) 1 mole di un qualunque gas occupa un volume di 22,414 litri pertanto 1,72 ml (0,00172 litri) occupano un volume X
1 mole :22,414 = X = 0,00172 X= 0,00172/ 22,4 14= 7,7 x 10-5
risposta corretta B
58. Calcolare la % (m/m) di NaBr in una soluzione ottenuta mescolando 35,0 g di una soluzione al 18,0% (m/m) di NaBr con 15,0 g di una soluzione al 22,0% (m/m) di NaBr.
A) 20,5%
B) 21,9%
C) 19,2%
D) 21,0%
soluzione
35 g di soluzione al 18% corrispondono a 35 x 0,18 g= 6,3 g di NaBr
15 g di soluzione al 22% di NaBr corrispondono a 15 x 0,22 =3,3 g di NaBr
in totale mescolandole due soluzioni si hanno 6,3 + 3,3 g di NaBr cioè 9,6 g NaBr
questi sono contenuti in 35 +15 g cioè in 50 g
pertanto se in 50 g vi sono 9,6 g in 100 ve ne sono X X= 19,2 g %
Risposta corretta C
59. Una bombola contiene 500 dm3 di azoto alla pressione di 4,96 ·106 Pa e a 25°C. Indicare la massa del gas.
A) 52 kg
B) 28 kg
C) 45 kg
D) 7,35 kg
soluzione
1 dm3 corrisponde a 1 litro quindi 500 dm3 = 500 L pertanto essendo PV= nRT 4,69 x 106 x 500 =n (273+25 )x 8,314
n= 48,9 atm x 500 / 298 x 0,0821 = 24450/ 24,46 = 999,6 moli
essendo il PM =28 i g di N2 = 999,6 x 28 = 27988 g = 27,988 Kg
risposta corretta B
60. Un recipiente chiuso, con una parete scorrevole, immerso in un termostato a 16 °C contiene 5 moli di un gas ideale. Quale pressione bisogna esercitare sulla parete scorrevole affinché il volume sia 2 dm3?
A) 6 MPa
B) 600 kPa
C) 600 atm
D) 600 Pa
soluzione
sappiamo che a temperatura costante
P1V1= P2V2 ma a 16°
P1V1= 5 x 289 x 0,0821 = 118,6 pertanto 118,6 = P2 x 2 P2= 119/2= 59,3 atm
Qui riprendono i quesiti 41-60 della classe B
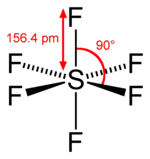
41. Secondo la teoria VSEPR la geometria della molecola PCl5 è:
A) trigonale planare
B) bipiramidale trigonale
C) a T
D) nessuna delle precedenti
soluzione
La Teoria Valence Shell Electron Pair Repulsion (VESPR)proposta dal chimico americano Gillespie è utilizzata per valutare la geometria di una molecola semplicemente considerando che gli elettroni dei legami di una molecola tendono a disporsi il più lontano possibile a causa delle repulsioni reciproche. I doppietti elettronici non impegnati in legame( coppie solitarie o lone pair) si respingono con maggior forza rispetto a quelli impegnati nei legami. In generale viene usato il cosiddetto metodo AXE .
La sigla AXE rappresenta con la lettera A l’atomo centrale e ha sempre come valore sottinteso 1.
La X rappresenta il numero di legami sigma che si formano tra l’atomo centrale e gli atomi ad esso legati. I legami covalenti multipli (doppi, tripli) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti sull’atomo centrale. La somma di X ed E, definita come NUMERO STERICO , ed è associata anche al numero totale di orbitali ibridi.
![]() lineare
lineare


trigonale planare angolare



il pentacloruro di fosforo PCl5 non possiede doppietti elettronici liberi e pertantosecondo il metodo AXE gli atomi di cloro tendono a disporsi secondo una bipiramide trigonale (AX5)

in cui tre atomi di cloro sono disposti su un piano con angoli di 120 gradi ed altri due con angoli di 90° rispetto al piano.
la risposta corretta è B
42. Nella seguente reazione da bilanciare:
NH3 (g) + O2 (g) → NO2 (g) + H2O (g)
indicare il rapporto tra i coefficienti stechiometrici di O2 e di H2O.
A) 7/3
B) 21/2
C) 7
D) 7/6
soluzione
dalla reazione si evince che l’azoto si ossida da -3 nell’ammoniaca a +4 nell’NO2 con un trasferimento elettronico di 7 elettroni
l’ ossigeno O° a sua volta acquista gli elettroni formando O-2 con acquisto di due elettroni per atomo quindi O2 acquista 4 e
4[N-3 + 2 H2O → NO2 + 7 e
7[O2 +4 e → 2 H2O
_____________________________
4N-3 +7O2 +8 H2O → 4 NO2 + 14 H2O
4NH3+ 7O2 ——-> 4NO2 + 6H2O
ne consegue che il rapporto coefficienti dell’O2 e dell’acqua è 7/6
risposta corretta D
43. Indicare gli orbitali ibridi utilizzati dallʼatomo di fosforo in [PCl6]
A) sp2d3
B) sp3d2
C) sp3d3
D) p3d3
soluzione
per spiegare la geometria molecolare de PCl6 come di altre molecole si può ipotizzare una combinazione degli orbitali SPd dell’atomo centrale ed esattamente SP3d2 che produce 6 orbitali ibridi di uguale energia. Il fosforo P ha la seguente struttura elettronica : 1s22s22p63s23p3 con orbitali d non occupati. Questa struttura tuttavia non giustifica la struttura ottagonale del PCl6 quindi dobbiamo ipotizzare che si possa fare una combinazione lineare di orbitali che diano origine a 6 orbitali ibridi uguali diretti secondo gli angoli di un ottaedro. Infatti
Il fosforo normale avrebbe 5 elettroni di valenza: due negli orbitali 3s e uno in ognuno dei tre orbitali 3p in PCl6 vi sono 6 elettroni.
L’ibridizzazione degli orbitali del fosforo necessariamente deve essere SP3d2 e non può essere d2SP3 infatti la differenza tra le due ibridizzazioni che nonostante diano ambedue strutture ottaedriche consistono nella ibridizzazione di orbitali dello stesso livello energetico per SP3d2 mentre per d2SP3 l’ibridizzazione avviene tra orbitali d di livello più basso rispetto a SP . e siccome il fosforo ha la struttura 1s2 2s2 2p6 3s2 3p3 deve necessariamente coinvolgere gli orbitali 3d e l’ibridizzazione possibile è SP3d2.
risposta corretta B
44. Calcolare quanto fluoro è contenuto in 984 g di una miscela di cloruro di argento e di fluoruro di potassio al 36,24% in cloruro di argento.
A) 11,7 g
B) 116,6 g
C) 205,2 g
D) 80,5 g
soluzione
se la % di cloruro di Argento è 36,24 allora il fluoruro di potassio è 100-36,24 =63,76 %
pertanto la quantità di fluoruro è il 63,76% di 984 g cioè 0,6376 x 984 =627,39 g
se in KF vi è F in 627,39 ve ne sono X
58: 19 = 627,39 :X X= 627,39 x 19/ 58= 205,5 g
riposta corretta C
45. La costante di equilibrio della reazione
AgClO3 (s) → Ag+(aq) + ClO3-(aq)
è 1,65 ·10-3 a 30,0 °C. Calcolare la concentrazione di Ag+ in una soluzione acquosa satura di AgClO3 a 30,0 °C.
A) 0,00165 M
B) 0,0406 M
C) 1,65 M
D) nessuna delle precedenti
soluzione
AgClO3 (s) → Ag+(aq) + ClO3-(aq)
1 X X
X2 = KPs X= √1,65 ·10-3 = 0,0406 moli /l
risposta corretta B
46. Il carbonato di sodio in una soluzione acquosa di acido solforico reagisce secondo la reazione:
H2SO4(aq) + Na2CO3(aq) → CO2(g) + H2O(l) + Na2SO4(aq)
Mettendo a reagire quantità stechiometriche di carbonato e di acido si sviluppano 44,8 mL di CO2 misurati a STP (T = 273,15 K, P = 101,3 kPa). Calcolare la massa di Na nel campione di Na2CO3 che si è trasformato.
A) 92,0 mg
B) 46,0 mg
C) 0,174 mg
D) 84,3 mg
soluzione
la quantità in grammi di CO2 ottenuta che corrisponde a 44,8 ml di gas è calcolata dall’equazione generale di stato dei gas
PV=g/PM RT
101300 Pa x 44,8 = g/44 8,314 x 273,15
g= 101300 x 44,8 x 44 / 8,314 x 273,15
g=199682560 /2270,9 =87,931
se da Na2CO3 :CO2 = X: 87,93
106:44 = X:87,93
X= 211,8 g di Na2CO3
se Na2CO3 : 2 Na = 211,8 :X X= 211,8 x 2 x 22,98 /106
X= 91,8 g
risposta corretta A
47. Calcolare il pH di una soluzione ottenuta aggiungendo 4,0 g di NaOH solido a 1 L di soluzione di HF 0,1 M.
A) 13,0
B) 9,8
C) 8,1
D) 7,5
soluzione
Dai dati tabulati HF è un acido debole ed ha una costante di dissociazione Ka= 6,7 × 10-4
4 grammi in 1 litro corrispondono a 4/40 =0,1 moli/l pertanto tutto l’HF si trasforma in NaF
si ha pertanto idrolisi di un sale di acido debole e base forte pertanto
F- + H2O = HF + OH-
Kidr= Kw/Ka Ki = [HF][OH⁻]/[F⁻]
[OH-] = √ Kw/Ka Cs = √ (10-14 / 6,7 × 10-4 ) x 0,1 = 0,245 x 10-5
POH = -log 0,245 x 10-5 = -log 2,54 x 10-6 = 6- log 2,54 = 6- 0,404 = 5,6
PH = 14 – 5,6 =8,4
risposta corretta C
48. Un individuo assume ogni giorno 2,0 L di acqua della fontana che ha un contenuto di As(V) pari a 6,5 μg/L. Quanti milligrammi di As(V) vengono ingeriti in 2 anni da tale individuo? Si consideri lʼanno di 365 giorni.
A) 4,3 mg
B) 5,7 mg
C) 9,5 mg
D) 7,1 mg
soluzione
Ogni giorno l’individuo consuma 2 litri x 6,5 μg =13,0μg
1 anno è costituito da 365 giorni quindi in un anno consuma 13,0 x 365= 4745 μg pertanto in 2 anni assume 9490 μg
1μg corrisponde a 1 x 10-6 g quindi 9490 μg corrispondono a
1 : 0,000001 = 9490 :X X= 0,00949 g = 9,5 mg
risposta corretta C
49. Decomponendo termicamente 52,3 g di un minerale contenente CeO2 (s), si formano 0,014 moli di O2 (g), secondo la reazione (da bilanciare):
CeO2 (s) →Ce2O3 (s) + O2 (g).
Calcolare la % di Ce nel minerale.
A) 15,0%
B) 21,7%
C) 38,9%
D) 41,8%
soluzione
la reazione bilanciata è: 4 CeO2 (s) → 2Ce2O3 (s) + O2 (g).
la quantità di CeO2 nel minerale è calcolata considerando che se da 4CeO2 si ottiene O2 da X g se ne ottengono 0,014 x 32 g
4 x 172,11 :32 = X : 0,448 X= 9,63 g di CeO2 presenti nel campione
Se in CeO2 vi è 1 atomo di Ce in 9,634 ve ne saranno X
172,11 : 140,1 = 9,634 :X
X = 140,11 x 9,634 / 172,11 = 7,85 g
la % di cerio nel campione di minerale è
se in 52,3 g vi sono 7,85 g di cerio in 100 ve ne sono X
X=7,85 x 100/ 52,3 = 15 %
risposta corretta A
50. Calcolare il pH di una soluzione ottenuta mescolando volumi uguali di una soluzione di HCl 0,1 M e una di CH3COONa 0,l M.
A) 3,0
B) 4,5
C) 6,9
D) 5,7
soluzione
trattandosi di volumi uguali e concentrazioni uguali tutto il sale si trasforma in acido per cui il PH è quello che deriva da un acido debole. Poichè il volume raddoppia allora le moli diminuiscono della metà quindi Ca=0,05 M
[H+] = √Ka x Ca = √K1,8 x 10-5 x 0,05 = 9,5 x 10-4 PH= 4- log 9,5 = 4-0,97 = 3,03
risposta corretta A
51- calcolare la costante di ionizzazione di un acido debole HA sapendo che aggiungendo 50 mL di una soluzione di NaOH 0,1 M a 50 mL di una soluzione 0,2 M di HA si ottiene una soluzione con un pH = 4,5.
A) 6,8 ∙ 10-7
B) 3,2 ∙ 10-5
C) 8,4 ∙ 10-3
D) 5,2 ∙ 10-8
soluzione
[H+]= 10 -4,5 = 0,5 (questo è un logaritmo!) x 105
Ricorda che per risalire dal PH ad H+ [ H+]=10-ph e se Ph è intero [ H+]= esponente di 10. Se l’esponente non è intero come nel caso specifico, allora occorre aumentare l’esponente al valore intero superiore e poi sottrarre da questo il valore del PH
e nel caso specifico 10-4,5 diviene 10-5 e la differenza è 5-4,5 =0,5
Questo però è un logaritmo dal quale occorre calcolare il numero corrispondente infatti il numero a cui corrisponde il logaritmo 0,5 è 3,16 .
5 mmoli Na+ reagiscono con 5 mmoli di HA ;
si formano 5 moli di sale NaA e rimangono 5 mmoli di HA
si ha quindi HA in presenza del sale NaA cioè si è formato un tampone.
poichè per una soluzione tampone [ H+] = Ka Ca/Cs
Ca= 5 mmoli e Cs = 5 mmoli formate nella reazione in un volume di 100ml quindi le due concentrazioni sono uguali Ca=Cs
[H+] = Ka x 1 = Ka
quindi [H+]= 3,16 x 10-5
rispota corretta B
52. Determinare quanti grammi di FeC2(s| si ottengono dalla decomposizione di 1,50 moli di ferrocianuro di potassio secondo la reazione (da bilanciare):
[Fe(CN)6]4-(aq) → FeC2 (s) + CN–(aq) + N2 (g)
A) 233,1 g
B) 119,8g
C) 275,9 g
D) 223,9 g
soluzione
la reazione bilanciata è: [Fe(CN)6]4-(aq) → FeC2 (s) + 4CN–(aq) + N2 (g)
da 1 mole di [Fe(CN)6]4- si ottiene 1 mole di FeC2 quindi da 1,5 moli si ottengono 1,5 moli di FeC2
cioè 79,84 g x1,5 =119,8
risposta corretta B
53. Il carburo di litio Li2C2 (s) si ottiene attraverso la seguente reazione condotta a 1200 K:
2 Li (s) + C2H2 (g) →Li2C2 (s) + H2 (g) con Kp = 0,15.
Se la pressione nel recipiente allʼequilibrio è 1,0 ∙105 Pa, calcolare la composizione % (v/v) dei gas.
A) C2H2 (g) = 38% H2 (g) = 62%
B) C2H2 (g) = 26% H2 (g) = 74%
C) C2H2 (g) = 87% H2 (g) = 13%
D) C2H2 (g) = 55% H2 (g) = 45%
soluzione
Kp= H2 (g) / C2H2 (g) = 0,15 = PH2/PC2H2
0,150= X/1-X
0,15 (1-X ) =X
0,15 -0,15X =X
1,15X= 0,15 X=0,13
quindi da 1 mole si formano 0,13 moli di H2 da 100 se ne formano 13 quindi H2=13%
C2H2 = 100-13 = 87%
risposta corretta C
54. Un recipiente chiuso e rigido contenente acqua liquida in equilibrio con vapore acqueo viene termostatato
a 373,15 K. Mediante un dispositivo che non consente al vapore di uscire, viene aggiunto del cloruro di sodio ed il contenitore viene delicatamente agitato, sotto termostatazione. Cosa può accadere?
A) si forma unʼemulsione
B) la pressione allʼinterno del contenitore aumenta
C) parte del vapore condensa
D) parte dellʼacqua liquida evapora
soluzione
quando si stabilisce l’equilibrio dinamico tra le particelle della superficie liquida e le particelle del vapore la prerssione del vapore misurata è chiamata tensione di vapore.
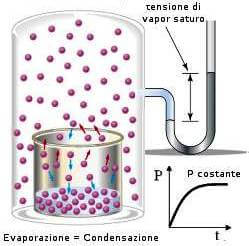
l’aggiunta di NaCl secondo la legge di Raoult provoca un abbassamento della tensione di vapore pertanto la quantità di vapore deve diminuire ed infatti parte del vapore condensa sulla superficie del liquido.
risposta corretta C
55. Un sistema chiuso, in cui non avvengono reazioni chimiche, subisce una serie di processi reversibili che lo riportano allo stato iniziale. Sommando tutti gli scambi termici avvenuti nei singoli processi, si trova che il sistema ha assorbito calore dallʼambiente circostante. Quale delle seguenti affermazioni è vera?
A) lʼambiente circostante ha svolto lavoro sul sistema
B) il sistema ha svolto lavoro sullʼambiente circostante
C) in totale il sistema non ha svolto alcun lavoro
D) nessuna delle precedenti
soluzione
il primo principio della temodinamica ΔΕ = Q + L
La convenzione del “primo criterio” o “criterio misto” dice che il calore Q è positivo se si trasferisce dall’ambiente al sistema, mentre L è positivo se compiuto dal sistema.
La convenzione “egoistica” sostiene invece che sia il lavoro che il calore sono considerati positivi quando vengono forniti al sistema. In tal caso l’espressione del primo principio della termodinamica è:
∆U = Q + L
in un sistema isolato (cioè costituito dal sistema + ambiente) ΔΕ =0 perciò Q= -L
Nel caso specifico il sistema assorbe calore dall’esterno quindi è il sistema a compiere lavoro
Risposta corretta B
56. Qual è lʼeffetto della presenza di un catalizzatore su una reazione chimica?
A) sposta lʼequilibrio verso la formazione dei prodotti
B) diminuisce lʼenergia di attivazione della reazione
C) favorisce termodinamicamente la formazione di una quantità maggiore di prodotti
D) sottrae prodotti dalla miscela di reazione, favorendo la conversione totale dei reagenti
soluzione
perchè una reazione avvenga è necessario che venga superata una barriera di energia che viene chiamata ENERGIA DI ATTIVAZIONE. Nella figura seguente l’energia di attivazione è rappresentata dal punto di massimo della curva.

l’energia di attivazione è l’ energia minima necessaria per far avvenire una reazione ( X→ Y) .
Perché una reazione avvenga è necessaria la collisione di due o più molecole opportunamente orientate e dotate di un livello di energia minimo (l’energia di attivazione), da permettere la collisione nonostante le forze repulsive generate dalle loro nuvole elettroniche esterne. Tale livello minimo di energia costituisce pertanto una barriera di potenziale . Se l’energia disponibile è tale da superare questa barriera allora le forze repulsive vengono superate e le molecole coinvolte vengono a trovarsi ad una distanza tale da poter riorganizzare i legami tra gli atomi che le compongono per originare nuovi composti (prodotti della reazione).
Spesso l’energia di attivazione non permette che una determinata razione avvenga, per cui si utilizzano alcune sostanze dette catalizzatori che diminuiscono la barriera di energia tanto da far avvenire reazioni che altrimenti potrebbero non verificarsi senza catalizzatore.
Ne consegue che la risposta corretta al quesito è B
57. Il reagente A si converte in altre specie chimiche seguendo una legge cinetica del secondo ordine, v = k[A]2.
Quale delle seguenti affermazioni è vera?
A) il procedere della reazione non richiede che le molecole di A si incontrino tra loro
B) la reazione avviene quando le molecole di A si incontrano tra loro
C) la reazione è favorita da una diminuzione della temperatura
D) A è un composto intrinsecamente instabile
soluzione
La reazione dovrebbe essere 2 A → B per cui la velocità è v = k[A]2. La reazione avviene quindi quando le molecole di A reagiscono urtandosi tra loro.
riposta corretta B
58. Sapendo che la seguente reazione è endotermica
2 H2O(g) → 2 H2 (g) + O2 (g)
cosa si può fare per diminuire la quantità di H2O allʼequilibrio?
A) aggiungere ossigeno
B) diminuire il volume del recipiente in cui avviene
la reazione
C) aggiungere un catalizzatore
D) aumentare la temperatura a pressione costante
soluzione
dal primo principio della termodinamica ΔE= Q + L dove L= lavoro che, a pressione costante, per un gas è P (V2-V1)
ΔE = Q + PV2-PV1 il prodotto ΔE= Q + H2 -H1 dove H= entalpia quindi
ΔE= Q + ΔH
in una reazione chimica si ha ∑ H prodotti – ∑ H reagenti= ΔH di reazione
per la reazione 2 H2O(g) → 2 H2 (g) + O2 (g)
(2H O2 + H H2) – HH2O = ΔH
Per processo endotermico si intende una trasformazione che comporta un aumento di entalpia del sistema e dunque un trasferimento di calore dall’ambiente al sistema stesso. Adottando il criterio egoistico, che prende in riferimento il sistema, la variazione di entalpia ΔH assume valore positivo. In riferimento invece alla notazione mista, il ΔH, rappresentando energia ceduta dall’ambiente, assume valore negativo.
Ciò stabilito, se si aumenta la temperatura la reazione data sopra procederà da sinistra a destra e quindi la concentrazione di H2O diminuisce.
risposta corretta D
59. Individuare i composti che hanno uno stereoisomero meso:
a) 2,3-dimetilpentano, b) 2-cloro-3-metilbutano, c) 1,3-dimetilciclopentano, d) 3,4-difluoroesano.
A) a, c
B) a, d
C) c, d
D) d
soluzione

 CH2 – CH-CHF-CHF-CH-CH3
CH2 – CH-CHF-CHF-CH-CH3
1 2 3 4
composto meso un composto che presenta più atomi di carbonio asimmetrici (centri chirali ) ma nel suo complesso, a causa dell’esistenza di un piano di simmetria interno, risulta non attivo otticamente. Tale genere di composto presenta tipicamente degli stereoisomeri cioè molecole che sono immagini speculari e non sovrapponibili.Alcune forme meso si possono riconoscere, per esempio, perché i sostituenti legati agli atomi chirali sono gli stessi e si trovano dallo stesso lato della molecola.


acido tartarico, composto meso con piano di simmetria (piano che divide la molecola in due parti uguali).
A differenza di una miscela racemica che è una miscela equimolecolare di una coppia di 2 enantiomeri, un composto meso è un composto puro che non presenta attività ottica anche se presenta 2 atomi asimmetrici.
detto questo, è evidente che i composti meso sono c e d
risposta corretta C
60. Lʼidrolisi delle ammidi catalizzata dagli acidi è un processo irreversibile. Individuare la motivazione corretta.
A) nellʼultimo stadio della reazione lʼammoniaca eliminata viene protonata
B) lʼacido carbossilico formato viene protonato
C) la formazione dellʼacido carbossilico è stericamente favorita
D) le idrolisi acide sono sempre processi irreversibili
soluzione

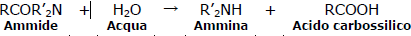
le ammidi eagiscono con l’acqua per dare l’acido carbossilico solo in presenza di un acido o base forte.
l’ammina che si forma dal processo di idrolisi acida , è protonata ed è presente quindi come ione amminio.
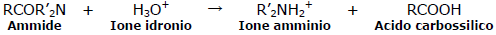
è quindi evidente che la risposta corretta è A
Lascia un commento