I primi 40 quesiti sono comuni alle classi A e B.
1. Indicare quale, tra i seguenti, è il composto di coordinazione:
A) TiO2
B) XeF2
C) Ni(CO)4
D) Ca(OH)2
soluzione
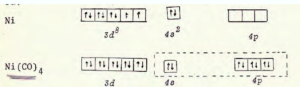
i composti di coordinazione sono molecole in cui un catione metallico è coordinato cioè legato ad atomi, ioni o gruppi atomici con un numero di legami superiore al suo numero di ossidazione. I composti di coordinazione vengono anche chiamati composti complessi ed un esempio è uno ione metallico in soluzione acquosa che è coordinato da molecole d’acqua. Gli atomi o gruppi atomici che si legano al metallo vengono chiamati LEGANDI. Nei composti complessi, il metallo utilizza gli orbitali d e molto spesso i complessi che essi formano assumono colorazioni marcate come per esempio il Fe, coordinato all’emoglobina del sangue impartisce a questo la ben nota colorazione rossa. Uno dei legandi molto comuni è il gruppo carbonile ed i complessi che ne risultano vengono chiamati carbonili metallici.Il Ni usa gli orbitali SP3 e la struttura che ne risulta è tetraedrica ed il composto è diamagnetico (non esistono elettroni spaiati).
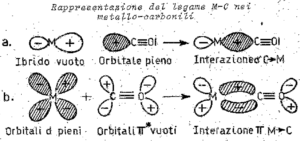
poiché i metalli di transizione formano con molta facilità complessi molto stabili con l’ossido di carbonio, se ne deduce che deve intervenire un meccanismo di interazione di legame diversa da quello puramente σ e specifico per questo tipo di composti, infatti
infatti uno spostamento di elettroni via legame π dal metallo all’ossido di carbonio rende quest’ultimo più negativo per cui risulta esaltata la sua basicità(donazione di elettroni).
in altri termini l’interazione σC→Me rendendo il CO meno negativo p più positivo faciliterà un richiamo di elettroni dal metallo al CO attraverso il legame π ed il risultato è un reciproco rafforzamento dei legami σ e π.
Da quanto abbiamo esposto è chiaro che il composto di coordinazione è Ni(CO)4
risposta corretta C
2. In una scatola sono conservati 100 gessetti che pesano in totale 1,00 kg. Assumendo che il gessetto sia costituito interamente da solfato di calcio diidrato, calcolare il numero di atomi di ossigeno contenuti in un gessetto:
A) 2,07 · 1023
B) 6,02 · 1023
C) 1,38 · 1023
D) 3,46 · 1022
soluzione
se 100 gessetti pesano 1000 g un gessetto pesa 10 g. Il PM del solfato di Ca .2H2O è 172,14 g
Sappiamo che in 1 mole di sostanza (in questo caso 172,14 g ) vi sono 6,02 x 1023 molecole quindi in 10 g ve ne saranno X
X= 10 x 6,02 x 1023 / 172,14 =0,342 x 1023
in 1 gessetto vi sono 3,49 x 1022 molecole
risposta corretta D
3. Lo ione Fe2+ è isoelettronico con:
A) Mn2+
B) Co3+
C) Ni2+
D) Cu2+
soluzione
Isoelettronico significa che ha lo stesso numero di elettroni di un altro elemento che può essere neutro o ione.
Fe+2 possiede 2 elettroni in meno rispetto ad Fe ([Ar] 3d64s2) quindi Fe+2 ha la configurazione [Ar] 3d6
Le configurazioni degli altri ioni sono:
Mn [Ar] 3d54s2 Mn+2 significa che vi sono 2 elettroni in meno quindi la configurazione elettronica di Mn+2 è : [Ar] 3d5
Co [Ar] 3d74s2 Co+3 significa che vi sono 3 elettroni in meno quindi la configurazione elettronica di Co+3 è: [Ar] 3d6
Ni [Ar] 3d84s2 Ni+2 significa che vi sono 2 elettroni in meno quindi la configurazione elettronica di Ni+2 è : [Ar] 3d8
Cu+2 [Ar] 3d104s1 Cu+2 significa che vi sono 2 elettroni in meno quindi la configurazione elettronica di Cu+2 è: [Ar] 3d9
ne consegue che il Fe+2 è isoelettronico con lo ione Co+3
risposta corretta B
4. Lasciando una soluzione acquosa di NaOH esposta all’aria, dopo qualche tempo la concentrazione dell’idrossido di sodio diminuisce. Come si può spiegare questo fenomeno?
A) l’idrossido di sodio reagisce con l’acqua.
B) l’idrossido di sodio evapora.
C) evapora l’acqua cambiando la concentrazione della base.
D) l’idrossido di sodio reagisce con l’anidride carbonica sciolta in acqua.
soluzione
una soluzione acquosa di NaOH in presenza di aria è a contatto con l’anidride carbonica in essa contenuta per cui si ha la reazione
1) CO2 + NaOH = NaHCO3 (formazione di bicarbonato di sodio)
2) NaHCO3 + NaOH = Na2CO3 + H2O (formazione di carbonato di sodio)
essendo l’ ambiente basico le reazioni avvengono in modo completo e gli equilibri sono spostati tutti a destra della reazione verso la formazione del Carbonato.
La quantità di NaOH in presenza di aria pertanto diminuisce per formazione di Na2CO3
risposta corretta D
5. Indicare il tipo di interazione principale che si instaura tra H2O e D2O.
A) legame a idrogeno
B) dipolo permanente – dipolo indotto
C) carica – carica
D) nessuna delle precedenti
soluzione
Il deuterio rispetto all’idrogeno possiede un neutrone in più ma ciò non modifica le proprietà delle interazioni tra le molecole che per effetto del momento di dipolo si attraggono con un vero e proprio legame a ponti idrogeno O-H…O-H
O-D…O_H

si instaura pertanto un legame Idrogeno.
risposta corretta A
6. Quanto piombo si deve pesare per avere sulla bilancia un numero di atomi uguale a quello che costituisce 5,00 kg di ferro?
A) 1,85 g
B) 18,5 g
C) 1,85 kg
D) 18,5 kg
soluzione
la prima cosa da fare è calcolare quanti atomi vi siano in 5000 g di Fe.
sapendo che in una quantità 55,85 g (pari al PA del Fe) vi sono 6,02 x 1023 atomi allora in 5000 g ve ne saranno X
X = 5000 x 6,02 x 1023 / 55,85 = 538,9 x 1023 atomi
pertanto se in una quantità di Pb pari al suo PA vi sono 6,02 x 1023 atomi in X g ve ne saranno 538,9 x 1023 che rappresentano la quantità di atomi in 5 Kg doi Fe.
207,2 : 6,02 x 1023 atomi = Xg : 538,9 x 1023
X = 207,2 x 538,9 x 1023 / 6,02 x 1023
X= 18548 g = 18,5 Kg
risposta corretta D
7. Porre i seguenti elementi in ordine di elettronegatività decrescente:
A) Cl > Si > S > P
B) Cl > P > Si > S
C) Cl > S > P > Si
D) Cl > S > Si > P
soluzione
L’elettronegatività è definita come la capacità di un atomo di attrarre verso di sè gli elettroni di un legame. Se il legame è tra due atomi uguali gli elettroni ovviamente si trovano equamente condivisi tra i due atomi. Se invece gli atomi sono differenti allora uno dei due atomi ha una tendenza maggiore ad attrarre il doppietto elettronico di legame.
Esistono diverse scale di elettronegatività degli atomi la prima delle quali e forse più usata è la scala di Pauling .
La scala si costruisce attribuendo all’elettronegatività di un elemento un valore arbitrario e ricavando poi i valori relativi a questo attraverso la formula così ottenuta:
Consideriamo due atomi A e B che prendono parte a un legame covalente. Secondo Pauling la differenza di elettronegatività tra questi due atomi è pari a:
dove:
xa ed xb sono le elettronegatività degli atomi A e B.
Δ è detto “surplus di energia”,ed è dato da:
Dove EAB è l’energia di legame del composto A-B,
EAA l’energia di legame del composto A-A,
EBB l’energia di legame del composto B-B
il coefficiente 0,102 è dovuto al fatto che originariamente Pauling utilizzò entalpie espresse in elettroni volts mentre attualmente l’unità di misura nel sistema SI dell’entalpia è kJ/mol. Se espressa invece in kcal/mol il coefficiente assume il valore di 0,208.
Scala di Mulliken
L’elettronegatività è definita semplicemente come la media aritmetica tra l’ Energia di Ionizzazione e l’Affinità elettronica
Scala di Allred-Rochow
Questa scala si basa sull’idea che un elettrone venga attratto da un atomo per effetto della forza coulombiana esercitata dal nucleo
dove Z* è la carica nucleare efficace
L’elettronegatività è proporzionale a questa forza:
- dove r è il raggio covalente dell’atomo.
ELETTRONEGATIVITA’ E TAVOLA PERIODICA
l’elettronegatività diminuisce lungo i gruppi mentre cresce lungo i periodi pertanto
Cl =3,16
Si=1,9
S = 2,58
P = 2,19
quindi la soluzione al quesito è Cl > S > P > Si
risposta corretta C
8. Indicare l’affermazione ERRATA:
A) il legame singolo Si-Cl è più polare del legame singolo P-Cl
B) il legame singolo C-S è meno polare del legame singolo S-O
C) il legame singolo Si-O è più polare del legame singolo P-O
D) il legame singolo Si-O è meno polare del legame singolo P-O
soluzione
dai dati di elettronegatività che si possono vedere anche nel precedente quesito, è evidente che il silicio ha minore elettronegatività del fosforo quindi il legame Si-O è più polare del legame P.O
La risposta corretta è D
9. Indicare la molecola che non presenta legami doppi, secondo la teoria VSEPR:
A) SO2
B) B2O3
C) Cl2O
D) CO2
soluzione
La teoria VSEPR (Gillespie) consiste nell’individuare la disposizione geometrica degli atomi di una molecola tenendo presente che gli elettroni di un legame tendono a disporsi il più lontano possibile respingendosi tra loro secondo la legge di Coulomb.
l’SO2 ha la seguente struttura

quindi presenta atomi che usano ibridi SP2 e quindi con legami σ e π.
B2O3 o triossido di diboro ha la seguente struttura
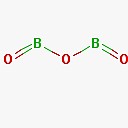
Anche questa molecola presenta doppi legami tra boro ed ossigeno.
La molecola di CO2 ha la struttura lineare :

ed ovviamente presenta doppi legami.
La molecola Cl2O è pertanto la molecola che possiede solo legami sigma :

Sia l’ossigeno che il cloro usano ibridi SP3 con angolo che dovrebbe essere 109°,28′ tuttavia in questo caso la treoria VESPR prevede un angolo leggermente maggiore perchè i due atomi di cloro si respingono tra loro.
la risposta corretta è C
10. In Texas è stato rinvenuto un meteorite di forma approssimativamente sferica, di raggio 0,300 m e densità 4500 kg/m3. Esso è costituito da ferro e nichel ed il primo è presente al 35% in peso. Calcolare la quantità in moli di nichel presente nel campione.
A) 5,63 mol
B) 5,63 ·103 mol
C) 3,03 mol
D) 3,03 ·103 mol
soluzione
Per calcolare la % di Ni presente nel meteorite è necessario conoscere la quantità iniziale di materia in cui esso è contenuto che corriponde al peso del meteorite.
Non ci viene fornito il peso tuttavia conosciamo la densità d e sappiamo che d=grammi /Volume
Pur non essendo fornito il volume , è possibile ottenerlo dai dati del quesito infatti il meteorite è una sfera ed il volume di una sfera è V=4/3π r3 pertanto conoscendo il raggio r=0,3 m si ha V= 0,113 m3 pertanto:
d = 4500 kg= Kg / 0,113 da cui si ha Peso meteorite= 508,5 Kg
Sapendo che contiene Fe al 35% è chiaro che Ni è il 65%
Per ottenere la quantità di Ni presente nel meteorite è sufficiente effettuare la proporzione:
se in 100 Kg vi sono 65 Kg di Ni allora in 508,5 Kg ve ne sono X
X= 65 x 508,5 / 100 = 330,5 Kg e siccome il Ni ha un PA=58,7 g
moli di Ni =330,5 x 103 g /58,7 = 5,63 x 103
risposta corretta B
11. Indicare la configurazione elettronica dello ione S2‒
A) [Ne] 3s2 3p8
B) [Ne] 3s2 3p5
C) [Ne] 3s1 3p6
D) [Ar]
soluzione
S2- significa che lo zolfo rispetto all’atomo neuro ha 2 elettroni in più (2 cariche negative) ,pertanto avendo lo S la seguente struttura:
S= [Ne] 3s²3p⁴ ne consegue che S-2 = [Ne] 3s²3p6
la risposta corretta è C
12. La formula di Lewis di H2SO3:
A) ha tre legami doppi
B) ha un legame zolfo-idrogeno
C) ha un legame triplo
D) ha un solo legame doppio tra ossigeno e zolfo
soluzione
H2SO3 è un acido e quindi gli ioni H+ sono disponibili per eventuali reazioni di sostituzione per cui non vi è un legame S-H diretto ma esso deve essere legato all’0ssigeno da cui è più facile staccarlo.Infatti la struttura di H2SO3 è la seguente :
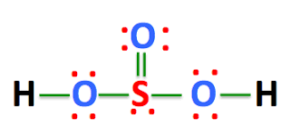
quindi vi è un solo doppio legame tra ossigeno e zolfo.
risposta corretta D
13. Indicare quale coppia di molecole ha la stessa geometria molecolare, secondo la teoria VSEPR:
A) BeCl2 H2O
B) BeCl2 XeF2
C) BeCl2 SO2
D) BeCl2 NO2
soluzione
Allo stato cristallino il cloruro di berillio presenta una struttura di polimero monodimensionale costituito da celle tetraedriche unite per gli spigoli; la struttura tetraedrica è distorta, con angoli Cl-Be-Cl di 109° e Be-Cl-Be di 71°
In fase gassosa può presentarsi sia come monomero che come dimero. I monomeri presentano geometria lineare con angolo di 180° a conferma del parziale carattere covalente dei legami: la molecola BeCl2 secondo la teoria VESPR mostra una geometria lineare

PbCl2 + Al2(SO4)3 → PbSO4 + AlCl3
A) 1, 1, 2, 2
B) 1, 1, 3, 3
C) 1, 2, 3, 3
D) 2, 2, 3, 3
P4O10 (s) + H2O (l) → H3PO4 (aq)
Calcolare quanti grammi di H3PO4 si formano e quanti grammi del reagente in eccesso rimangono inalterati alla fine della reazione.
A) H3PO4: 3,45 g; reagente in eccesso: 1,55 g
B) H3PO4: 8,82 g; reagente in eccesso: 2,08 g
C) H3PO4: 3,92 g; reagente in eccesso: 2,34 g
D) H3PO4: 13,62 g; reagente in eccesso: 2,08 g
CH4 (g) + O2 (g) → CO2 (g) + H2O (l)
calcolare il volume di ossigeno necessario per la combustione di 5,0 dm3 di CH4. I volumi siano misurati alla temperatura di 25°C e alla pressione di 101 kPa.
A) 2,5 dm3
B) 5,0 dm3
C) 7,5 dm3
D) 10 dm3
A) 3, 4, 3, 1, 2
B) 3, 8, 3, 2, 4
C) 3, 8, 3, 1, 4
D) 3, 8, 3, 2, 8
CrCl3 + (NH4)2S + H2O →NH4Cl + H2S + Cr(OH)3
A) 1, 1, 2, 2, 3, 3
B) 1, 2, 3, 3, 6, 6
C) 2, 2, 3, 3, 6, 6
D) 1, 2, 3, 4, 6, 6
As2O5 (s) + H2O (l) → H3AsO4 (aq)
A) 0,0360 g
B) 0,108 g
C) 0,144 g
D) 0,460 g
A) tetraedrica
B) piramidale quadrata
C) bipiramidale trigonale
D) ottaedrica
La teoria VSEPR (Valence Shell Electron Pair Repulsion, cioè repulsione delle coppie elettroniche nel guscio di valenza) è un metodo che serve per individuare in una molecola la disposizione geometrica degli atomi e si basa sul fatto che i doppietti elettronici di legame ed i doppietti solitari (lone pair) tendono a disporsi il più lontano possibile fra loro secondo la legge di Coulomb . Le forze di repulsione tra due coppie solitarie sono più forti rispetto alle forze di repulsione tra una coppia solitaria ed una coppia di legame, a loro volta più forti delle forze di repulsione tra due coppie elettroniche di legame. Gli elettroni tendono a respingersi posizionandosi il più lontano possibile tra loro. Per conoscere la geometria molecolare con la teoria VESPR si usa il metodo AXE . Con la lettera A si indica l’atomo centrale e ha sempre come valore sottinteso 1. La X rappresenta il numero di legami sigma tra l’atomo centrale A e gli atomi ad esso legati X. I legami covalenti multipli (doppi, tripli, etc) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti sull’atomo centrale A. La somma di X ed E, viene chiamata definita numero sterico.
















A) 72 mg
B) 45 mg
C) 98 mg
D) 24 mg
A) 10,4%
B) 22,7%
C) 18,1%
D) 13,9%
C3H5(NO3)3 (l) → CO2 (g) + H2O (g) + N2 (g) + O2 (g)
Quante moli di N2 (g) si ottengono decomponendo 2 mol di nitroglicerina?
A) 2 mol
B) 3 mol
C) 4 mol
D) 6 mol
A) 185 mL
B) 350 mL
C) 224 mL
D) 188 mL
Cr2O72‒(aq) + CH3CH2OH (g) + H+(aq)→ Cr3+ (aq) + CH3COOH (aq) + H2O (l)
Calcolare quante moli di alcol reagiscono con 1 mol di dicromato di potassio.
A) 2,5 mol
B) 1,5 mol
C) 3,0 mol
D) 2,0 mol
[Ca2+] = 10‒2,0 M, [F‒] = 3,4·10‒5,0 M, [SO4‒2] = 10‒1,5 M
Quali solidi possono essere presenti come precipitati nei sedimenti dell’oceano?
A) CaF2 (s)
B) CaSO4 (s)
C) nessun solido
D) CaF2 (s) e CaSO4 (s)
MnO4‒(aq) + Mn2+(aq) + H2O (l) → MnO2 (s) + H+ (aq)
A) 6 mol
B) 8 mol
C) 4 mol
D) 5 mol
O2(g) è 1,45 g/L. Calcolare il peso molecolare del gas Y2.
A) 58,4 u
B) 65,1 u
C) 36,2 u
D) 24,9 u
un eccesso di vapor d’acqua, secondo la reazione (da bilanciare):
S2Cl2 (g) + H2O (g) →SO2 (g) + HCl (g) + S (s)
A) 1,24 mol
B) 0,37 mol
C) 0,25 mol
D) 0,78 mol
A) acqua
B) soluzione 0,05 M di Na2SO4
C) soluzione 0,05 M di CaCl2
D) soluzione 0,01 M di Na2SO4
goccia a goccia una soluzione di NaOH 0,010 M. Calcolare la concentrazione di Fe3+ in soluzione quando inizia la precipitazione di Mg(OH)2 (s)
A) 7,5 ∙10‒20 M
B) 1,8 ∙10‒24 M
C) 4,3 ∙10‒16 M
D) 9,3 ∙10‒18 M
quando Mg(OH)2 inizia a precipitare la
[OH-]=
[OH-]= √6 x 10-10 = 2,44 x 10-5
NH3 (g) → N2 (g) + H2 (g)
La pressione nel recipiente, ad equilibrio raggiunto, diventa 1,41 ∙107 Pa. Calcolare la costante Kc (espressa in molarità) alla temperatura di 723 K.
A) 6,5
B) 8,9
C) 1,4
D) 3,2
I2 (g) → 2 I(g)
Sapendo che all’equilibrio la pressione parziale di I (g) monoatomico è 0,21 ∙105 Pa, calcolare il grado di dissociazione di I2 (g) a 1170K.
A) 41%
B) 12%
C) 32%
D) 27%
Ag+(aq) + 2 NH3 (aq) → Ag(NH3)2+(aq) K2=107,2
A) 10‒10,2
B) 10‒80
C) 10‒6,4
D) 10‒14,7
HX (aq) + H2O (l) → H3O+(aq) + X‒(aq) K=10‒7,4
HY (aq) + OH‒(aq) → Y‒(aq) + H2O (l) K=105,0
B) HZ
C) HY
D) HT
92 U + n → 92 U → 38 Sr + 54 Xe + n
Per ogni neutrone assorbito dall’ uranio, quanti neutroni si formano?
A) 3
B) 2
C) 4
D) 1
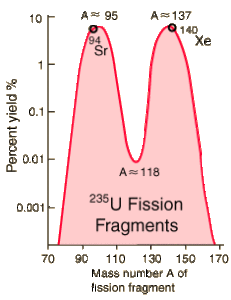 Un paio di frammenti comuni dalla fissione dell”uranio 235 sono lo xeno e lo stronzio:
Un paio di frammenti comuni dalla fissione dell”uranio 235 sono lo xeno e lo stronzio:
235 236 94 139
92 U +n → 92 U 38 Sr + 54 Xe +3n
pertanto per ogni neutrone si ottengono 3 neutroni.
risposta corretta A
37. In un contenitore rigido è inizialmente contenuta una miscela dei gas A e B. I gas reagiscono secondo la reazione:
a A + b B →c C + d D con c + d > a + b
Assumendo che i gas siano ideali, cosa si può fare per mantenere la pressione finale uguale a quella iniziale?
A) immettere un gas inerte nel contenitore
B) inserire un catalizzatore
C) diminuire la temperatura
D) nessuna delle risposte precedenti
soluzione
l’immissione di un gas, sia pure inerte, aumenterebbe la pressione del recipiente. Il catalizzatore, diminuendo l’energia di attivazione della reazione sposterebbe la reazione verso destra e la pressione finale sarebbe sempre maggiore di quella iniziale. Poichè la pressione è in relazione alla temperatura secondo l’equazione di stato dei gas ideali si ha nello stato iniziale P1 V =n1 RT e nello stato finale P2 V=n2 RT. Pertanto, a parità di volume V e di Temperatura T se la pressione finale P2>P1 affinchè P2 sia uguale a P1 dobbiamo modificare l’unico parametro che è possibile modificare cioè la temperatura: infatti diminuendo opportunamente T allora P2 diverrà ad un certo punto uguale a P1.
risposta corretta C
38. A 4 mol d’acqua alla temperatura di 25 °C viene fornito calore per 5,10 kJ. Calcolare la temperatura del sistema quando avrà raggiunto l’equilibrio termico. Si trascuri il contributo delle dispersioni e della capacità termica del contenitore. La capacità
termica specifica dell’acqua è 4,184 J K‒1 g‒1
A) circa 345 K
B) circa 315 K
C) circa 335 K
D) circa 325 K
soluzione
La temperatura iniziale è T1= 25°C se aggiungiamo calore Q alla massa m= 4 x 18 =72 g di acqua sappiamo che Q = m C ( T2-T1) pertanto esprimendo le calorie in Jaule (non in KJ) si ha:
5100 =72 x 4,184 (T2 -25) 5100 J =301,25 (T2 -25) 51 00 = 301,25 T2 – 7525 7525+ 5,1 / 301,25 =T2 T2= 41,9 °C
T2= 314,9 K
risposta corretta B
39. Il cloruro di berillio ha una geometria (posizione media relativa degli atomi)
A) lineare
B) angolare, con angolo di legame pari a circa 120°
C) angolare, con angolo di legame pari a circa 109°
D) angolare, con angolo di legame pari a circa 90°
soluzione
Secondo la teoria VESPR il cloruro di berillio di formula BeCl2 non ha coppie elettroniche libere per cui secondo il metodo AXE . (con la lettera A si indica l’atomo centrale e ha sempre come valore sottinteso 1. La X rappresenta il numero di legami sigma tra l’atomo centrale A e gli atomi ad esso legati X. I legami covalenti multipli (doppi, tripli, etc) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti sull’atomo centrale A. La somma di X ed E, viene chiamata definita numero sterico.
da quanto detto la molecola Be Cl2 ha la seguente struttura

40. Quanti sono gli isomeri costituzionali che hanno formula molecolare C6H14?A) 3
B) 4
C) 5
D) 6
soluzione
Gli isomeri di struttura sono quei composti che possiedono lo stesso numero di atomi che però hanno disposizione diversa nello spazio.
Il composto C6H14 può avere 5 Isomeri strutturali e cioè:
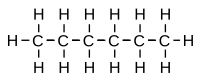




– esano 3-metil-pentano 2-metil-pentano(isoesano) 2-2-dimetil butano 2-3-dimetil butano
risposta corretta C
Qui continuano i quesiti 41-60 della classe A
41. Indicare la formula bruta dell’idrogenosolfito di magnesio.
A) Mg(HSO3)2
B) Mg2HSO3
C) MgHSO3
D) Mg(HSO4)2
soluzione
la desinenza ito è riferita ad un sale ossigenato che possiede l’atomo centrale legato all’ossigeno con il n. ossidazione immediatamente più basso del n.o massimo dell’atomo.
per esempio
nel nitrato NO3- l’azoto legato all’ossigeno ha n.o =+5 (3 x 2 -1) nel Nitrito NO2- ha n.o. = +3 (2×2 -1) (ricordiamo che il numero di legami di ogni atomo di O è generalmente 2)
Nel solfato SO4-2 il n.o. dello zolfo è +6 (4×2-2) nel solfito SO3-2 è +4 (3 x 2 -2) pertanto l’idrogenosolfito è HSO3- per cui essendo Mg+2 la formula dell’idrogenosolfito di Magnesio deve essere
Mg(HSO3)2
risposta corretta A
42. Indicare gli elementi in ordine crescente di raggio atomico:
A) Cs, K, Cl, F
B) F, K, Cl, Cs
C) F, Cl, Cs, K
D) F, Cl, K, Cs
soluzione
Il Raggio Atomico è la misura della distanza dal nucleo entro cui si trova racchiusa il 95% della densità elettronica.Il raggio atomico dipende soprattutto dalla Zeff ( carica efficace) cioè la carica di cui realmente risente un elettrone in un atomo con più elettroni. Si dice “efficace” a causa dell’effetto di schermo degli altri elettroni degli strati più internidell’elemento: all’aumentare di Zeff il raggio atomico diminuisce.
Nella tavola periodica il raggio atomico diminuisce lungo un periodo ed aumenta lungo un gruppo.
I i gas nobili fanno eccezione: due atomi dello stesso gas nobile non possono infatti legarsi covalentemente tra loro, ma sono tenuti uniti dalle deboli di Van der Waals , per cui la distanza internucleare è maggiore, e conseguentemente, il raggio atomico. I lantanidi ed attinici subiscono, rispettivamente, la cosiddetta contrazione lantanoidea ed attinoidea. Ciò detto si evince che l’ordine crescente si ha con la sequenza F,Cl,K,Cs
risposta corretta D
43. Calcolare il numero di atomi di idrogeno presenti in 50,0 g di ammonio solfato.
A) 1,82 ·1023 atomi
B) 1,82 ·1024 atomi
C) 9,10 ·1023 atomi
D) 9,10 ·1024 atomi
soluzione
in una molecola di (NH4)2SO4 vi sono 8 atomi di idrogeno quindi in 50 g ve ne sono X
X= 50 x 8 / 132,14 = 3,02
se in 1 g vi sono 6,02 x 1023 atomi in 3,02 ve ne sono X
x= 18,2 x 1023 oppure X =1,82 x 1024
risposta corretta B
44. Indicare la formula bruta del fluoruro stannoso:
A) SnF
B) SnF2
C) SnF3
D) SnF4
soluzione
lo stagno ha n.o. + 2 e +4 quindi la formula del cloruro stannoso è SnF2 mentre il fluoruro stannico è SnF4
risposta corretta B
45. Indicare l’affermazione ERRATA tra le seguenti:
A) il raggio atomico in un gruppo aumenta andando dall’alto verso il basso
B) il raggio atomico in un periodo diminuisce andando da sinistra verso destra
C) il raggio ionico dei cationi isoelettronici in un periodo diminuisce da sinistra a destra
D) il raggio ionico degli anioni isoelettronici in un periodo aumenta da sinistra a destra
soluzione
Isoelettronico significa che possiede un ugual numero di elettroni quindi la Zeff fa in modo che il raggio ionico diminuisca lungo un periodo.Per quanto riguarda il raggio ionico abbiamo già visto che il Raggio Atomico è la misura della distanza dal nucleo entro cui si trova racchiusa il 95% della densità elettronica.Il raggio atomico dipende soprattutto dalla Zeff ( carica efficace) cioè la carica di cui realmente risente un elettrone in un atomo con più elettroni. Si dice “efficace” a causa dell’effetto di schermo degli altri elettroni degli strati più internidell’elemento: all’aumentare di Zeff il raggio atomico diminuisce.
Nella tavola periodica il raggio atomico diminuisce lungo un periodo ed aumenta lungo un gruppo.
I i gas nobili fanno eccezione: due atomi dello stesso gas nobile non possono infatti legarsi covalentemente tra loro, ma sono tenuti uniti dalle deboli di Van der Waals , per cui la distanza internucleare è maggiore, e conseguentemente, il raggio atomico. I lantanidi ed attinici subiscono, rispettivamente, la cosiddetta contrazione lantanoidea ed attinoidea.
Detto questo l’affermazione errata è D
46. Indicare la coppia nella quale entrambe le specie hanno la stessa configurazione elettronica:
A) Cl‒, N3‒
B) Cl‒, Na+
C) O2‒, Al3+
D) O2‒, Cl‒
soluzione
Cl –→ [Ne] 3s2 3p6
Na+ →[Ne]
O2- → [He] 2s22p6
N3- → [He] 2s2
Al+3→ [He] 2s2 2p6
la coppia isoelettronica è O2- , Al+3
risposta corretta C
47. Indicare l’affermazione ERRATA tra le seguenti:
A) lo stato di ossidazione dello iodio nell’acido periodico è maggiore di quello che ha nell’acido ipoiodoso.
B) lo stato di ossidazione del boro nell’acido borico è maggiore di quello del fosforo nell’acido fosforoso.
C) lo stato di ossidazione dello zolfo nell’acido solforoso è uguale a quello del carbonio nell’acidocarbonico.
D) lo stato di ossidazione dello zolfo nel solfuro di calcio è uguale a quello dell’ossigeno nell’ossido di litio.
soluzione
HIO4 n.o.I = +7 HIO n.0. = +1
H3BO3 n.o. B= +3 H3PO3 n.o.P = +3
H2SO3 n.o. S= +4 H2CO3 C n.o.= +4
CaS n.o. S =-2 Li2O n.o O = -2
da ciò si evince che l’affermazione errata è B
48. Indicare l’affermazione ERRATA tra le seguenti:
A) gli idruri ionici sono composti binari formati da idrogeno e non metalli.
B) generalmente i composti ionici hanno un punto di fusione più alto di quello dei composti covalenti.
C) generalmente i composti covalenti sono più solubili di quelli ionici in solventi apolari.
D) generalmente i composti ionici sono più solubili di quelli covalenti in acqua.
soluzione
La particella ionica nota come idruro è l’anione dell’idrogeno, H−. Il termine viene anche utilizzato per descrivere alcuni composti dell’idrogeno con elementi metallici ciò significa che l’affermazione errata è A
49. Indicare la formula bruta dell’acido ipofosforoso.
A) H3PO2
B) H3PO3
C) H3PO4
D) H4P2O7
soluzione
la formula dell’acido ipofosforoso è H3PO2
Infatti il suffisso ICO si riferisce al composto in cui l’atomo centrale ha n.ossidazione più alto
Il suffisso OSO si riferisce al valore del n. ossidazione più basso rispetto al massimo
IPO deriva dal greco e significa sotto, quindi il suffisso IPO–OSO si riferisce al valore ancora più basso di quello OSO.
risposta esatta A
50. Quale specie non presenta legami covalenti.
A) BCl3
B) XeF2
C) SbCl5
D) SrO
soluzione
BCl3 è un composto covalente ed a c.n è gassoso . BCl3 la molecola di BCl3 è planare. Gli angoli Cl–B–Cl sono di 120° il che indica orbitali ibridi SP2.
SbCl5 ha struttura ottaedrica e legami covalenti:

Il difluoruro di xeno è un composto covalente con struttura lineare
![]()
SrO,ossido di stronzio, è un composto ionico e cristallizza formando una struttura dove cationi e anioni hanno coordinazione ottaedrica:

51. I fulmini promuovono la formazione di monossido di azoto nell’atmosfera. Un campione di
questo gas viene raccolto in un volume di 1,00 dm3 misurato a STP (T = 273,15 K, P = 101,3 kPa).
Quante moli e quanti grammi di monossido di azoto sono presenti nel campione?
A) 0,0446 mol; 59,94 g
B) 0,0223 mol; 1,34 g
C) 0,0446 mol; 2,05 g
D) nessuna delle precedenti
soluzione
il calcolo delle moli si può effettuare applicando l’equazione generale di stato dei gas PV= nRT
pertanto 101,3 x 1 /273 x 8,314 = 0,446 moli = o,446 x 30=1,34 g
nessuna delle risposte è corretta pur essendo corretto in due risposte il valore del numero di moli è errato il numero dei grammi.
risposta corretta D
52. Indicare l’affermazione ERRATA tra le seguenti:
A) i legami a idrogeno non si possono instaurare all’interno della stessa molecola
B) la presenza di legami a idrogeno può comportare un aumento dei punti di fusione
C) la presenza di legami a idrogeno può comportare un aumento dei punti di ebollizione
D) una molecola d’acqua può formare un massimo di quattro legami a idrogeno
soluzione
l legame ad idrogeno o ponte ad idrogeno è un caso particolare di forza intermolecolare (tra le molecole) e quindi esterno alla molecola. Ciò comporta che occorre più energia per spezzare questo ulteriore legame sia per la fusione chee per l’ebollizione .

Si deduce che l’affermazione errata è A
53. Indicare l’affermazione ERRATA tra le seguenti:
A) i legami presenti in CO2 sono più polari di quello presente in O2
B) il legame presente in HF è più polare di quello presente in HBr
C) il legame presente in BrF è più polare di quello presente in ClF
D) il legame presente in F2 è più polare di quello presente in Br2
soluzione
la molecola CO2 è lineare O–C–O ed i vettori che costituiscono il momento dipolare del legame CO essendo diretti dal C all’ossigeno avendo cioè direzioni opposte ma modulo uguale , si annullano . Pertanto il diossido di carbonio è un composto apolare ma il legame C-O è polare quindi l’affermazione A è corretta.
Nella molecola di ossigeno, non essendo presente differenza di elettronegetività non si ha polarità.
HF ed HBr sono ambedue polari, tuttavia essendo il fluoro più polare del Br è evidente che HF è più polare di HBr
Per quanto riguarda BrF e ClF i valori di elettronegatività di Br e Cl sono 2,96 e 3,16 rispettivamente ne consegue che BrF è più polare di ClF
L’affermazione errata è la D in quanto le molecole costituite da atomi uguali sono apolari non essendovi differenze di elettronegatività.
54. Il dottor McCoy analizza un nuovo elemento scoperto sul pianeta Vogon IV. Tramite uno smaterializzatore analizza 1,00 kg di campione che scopre essere costituito da 1,4989 ·1024 atomi.
Qual è il peso atomico del nuovo elemento?
A) circa 40 u
B) circa 250 u
C) circa 402 u
D) nessuno dei precedenti
se PA contiene 6,02 x 1023 atomi = 1000 : 1,4989 x 1024
PA = 6,02 x 1023 x 103 / 1,4989 x 1024
PA= 401,6
risposta corretta C
55. Il dottor McCoy scopre che il nuovo elemento ha una configurazione elettronica del tipo ns2 (n-1)d6.A quale gruppo della tavola periodica appartiene tale elemento?
A) ai metalli di transizione, nel gruppo 6
B) ai metalli di transizione, nel gruppo 8
C) ai gas nobili, nel gruppo 18
D) nessuno dei precedenti
soluzione
Gli elementi di transizione vengono anche chiamati elementi del blocco d, sono tutti metalli ed il loro nome è dovuto al fatto che nella tavola periodica occupano i gruppi intermedi che vanno da 3 a 12. Un’altra caratteristica di questi elementi è che si ha un riempimento progressivo degli orbitali di tipo d in ciascun periodo. In generale sappiamo che gli orbitali dei livelli più bassi vengono riempiti prima di quelli più esterni ciò dipende dal fatto che negli elementi del blocco d gli orbitali s possiedono energia più bassa rispetto a quelli d, per cui gli orbitali s vengono riempiti prima.
Un elemento con struttura ns2 (n-1)d6 (ad esempio 4s2 3d6) appartiene certamente al gruppo VIII in quanto possiede i 5 orbitali d con 6 elettroni di cui 4 orbitali con elettroni spaiati ed uno con una coppia di elettroni.
risposta corretta B
56. Quante moli di NO (g) si ottengono dalla decomposizione di 6,0 mol di HNO2 , secondo la reazione (da bilanciare):
HNO2 (aq)→N2O4 (g) + NO (g) + H2O (aq)
A) 1,0 mol
B) 1,5 mol
C) 4,3 mol
D) 3,0 mol
soluzione
la reazione è una reazione di dismutazione in quanto uno stesso elemento si ossida e si riduce contemporaneamente
1[2NO2- → N2O4 + 2e ( l’azoto +3 si ossida ad azoto +4)
2[NO2- +e +2H+ → NO +H2O (l’azoto si riduce da +3 a +2)
__________________________
4NO2- +4H+ → N2O4 + 2NO + 2H2O
pertanto se da 4 moli di HNO2 si ottengono 2 moli di NO da 6 moli se ne ottengono 3
Risposta corretta D
57. Un carbone fossile contiene il 2,2% (m/m) di zolfo. Determinare il volume di SO2 (g) misurato a 273,15 K e 1,01 ∙105 Pa che si forma dalla combustione di una tonnellata di carbone.
A) 22,7 m3
B) 10,5 m3
C) 15,4 m3
D) 34,8 m3
soluzione
sappiamo che in 100 g di carbone vi sono 2,2 g di S quindi
se da S si ottiene SO2 da 2,2g se ne ottengono X
32g: 64g = 2,2 :X
X= 64x 2,2 /32 = 4,4 g di SO2
essendo le condizioni normali cioè 101 Pa e °C allora sappiamo che il volume di una molecola di SO2 è 22,414 litri quindi
64 : 22,414 = 4,4 :X
X=1,54 litri da 100 g di Carbone
Da 1 tonnellata ( 106 g) di carbone si ottengono 15,4 m3
quindi se da 102 g si ottengono 1,54 litri cioè 1,54 x 10-3 m3 da 1 tonnellata (106 g) se ne ottengono X
X= 1,54 x 10-3 m3 x 106 /102
X=1,54 x 101 = 15,4 m3
risposta corretta C
58. Calcolare la % m/m di CsCl in una sua soluzione 1,0 molale.
A) 32,7%
B) 28,4%
C) 19,3%
D) 14,4%
soluzione
1 molale significa che in 1000 g di solvente è contenuta 1 mole di sostanza cioè 168,36 g quindi la massa totale è 1168,36g
pertanto
1168 :168,36 = 100 :X X=14,4
risposta corretta D
59. Qual è il volume di un recipiente che contiene 5 kg di idrogeno molecolare, se la pressione all’interno
del recipiente è 6,3 ·106Pa e la temperatura è 30 °C?
Supporre che il sistema gassoso sia ideale.
A) 50 dm3
B) 5 m3
C) 1 m3
D) 5 dm3
soluzione
dall’equazione di stato dei gas PV=nRT abbiamo:
V = 2500 x 8,314 x 303/ 6,3 ·106 = 6,3 x 109 /6,3 x 106 =1 m3
risposta corretta C
60. Un recipiente chiuso, con una parete scorrevole, immerso in un termostato a 39 °C, contiene 14 mol di
un gas ideale. Quale volume assume il recipiente se sulla parete è esercitata una pressione di 3,0 ·106Pa?
A) 1,2 m3
B) 4 m3
C) 4 dm3
D) 12 dm3
soluzione
dall’equazione di stato dei gas
V=nRT/P = 14 x 8,314 x 312 / 3 x 106 =0,012 m3 = 12 litri = 12 dm3
risposta corretta D
Qui continuano i quesiti 41-60 della classe B
41. Un giorno, il dottor McCoy ritrova nel suo laboratorio un vecchio campione, dalla cui etichetta sbiadita riesce solo a capire che si tratta di un cloruro di un metallo alcalino. Decide quindi di sciogliere in acqua il campione e di precipitare il cloruro sotto forma di sale di argento. Da 0,500 g di campione incognito ottiene 0,961 g di AgCl. Di quale sale si tratta?
A) LiCl
B) NaCl
C) KCl
D) RbCl
soluzione
se in AgCl vi è Cl in 0,961 ve ne sarà X
X= 35,5 x 0,961 / 143,3 = 0,238 g di Cl
se da o,5 si ottengono 0,238 g di Cl allora la % di Cl è X= 23,8/0,5 = 47,6%
la % nei sali è:
42,39 :35,5 =100 😡 X= 83,7 % di Cl in LiCl
58,44 :35,5 =100 :X X= 60,7 % di Cl in NaCl
74,55 :35,5 =100 :X X= 47,62 % di Cl in KCl
120,92 :35,5 =100:X X = 29,36 % di Cl in RbCl
dai dati sopra esposti si deduce che il composto era cloruro di potassio KCl
risposta corretta C
42. Indicare quale geometria ha lo ione PCl4+ secondo la teoria VSEPR:
A) a sella
B) tetraedrica
C) planare quadrata
D) nessuna delle precedenti
soluzione
Secondo la teoria VESPR si utilizza il metodo AXE dove con la lettera A si indica l’atomo centrale che ha sempre come valore sottinteso 1. La X rappresenta il numero di legami sigma tra l’atomo centrale A e gli atomi ad esso legati X. I legami covalenti multipli (doppi, tripli, etc) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti sull’atomo centrale A. La somma di X ed E, viene chiamata definita numero sterico.






Secondo la teoria VESPR ed il metodo AXE quindi la molecola PCl4+ è tetraedrica
risposta corretta B
43. Indicare il gruppo di coefficienti, riportati in ordine casuale, che bilancia la seguente reazione di ossidoriduzione:
KMnO4 + K2S + H2O →MnS + S + KOH
A) 1, 1, 2, 2, 5, 5
B) 1, 2, 5, 7, 7, 8
C) 2, 2, 5, 7, 8, 8
D) 2, 2, 5, 7, 8, 16
soluzione
la reazione è la seguente:
2[MnO4- + 4H2O + 5e → Mn+2 + 8OH-
5[S-2 → S +2 e
______________________________________
2MnO4-+ 5S-2 +8H2O → 2Mn+2 + 16OH- + 5S
pertanto
2KMnO4 + 7K2S + 8H2O →2MnS +5 S +16 KOH
la risposta corretta è D
44. Calcolare la quantità di HCl necessaria a consumare 0,270 g di acido ossalico (COOH)2, secondo la reazione (da bilanciare):
(COOH)2 (aq) + K2Cr2O7 (aq) + HCl (aq) → CO2 (g) + CrCl3 (aq) + KCl (aq) + H2O (l)
A) 0,292 g
B) 0,109 g
C) 0,328 g
D) 0,766 g
soluzione
la reazione è un’ossidoriduzione
il n.o. del Carbonio in COOH COOH è +3 per ogni C quindi -6 in totale ed il C si ossida a n.o + 4 in CO2 quindi
6 [ (COOH)2 → 2 CO2 + 2 H+ +2e
2 [ Cr2O7-2 + 6 e + 14 H+ → 2Cr+3 +7H2O
_____________________________________
6(COOH)2 + 2Cr2O7-2 + 28 H+ → 12 CO2 +4 Cr+3 + 12H+ + 14 H2O e dividendo tutto per 2 e semplificando
3(COOH)2 + Cr2O7-2 + 8 H+ → 6 CO2 + 2 Cr+3 + 7 H2O
quindi se per 3 moli di (COOH)2 occorrono 8HCl allora allora per 0,270 g ce ne vorranno X
3x 90 :8x 36,5 = 0,270 :X
X= 0,292 g
risposta corretta A
45. Indicare, tra le seguenti molecole, quella NON planare, secondo la teoria VSEPR:
A) AlCl3
B) XeF4
C) H2O
D) nessuna delle precedenti
soluzione
In AlCl3 L’alluminio presenta un orbitale vuoto in cui è possibile ospitare un doppietto elettronico proveniente da un donatore di elettroni.quindi secondo il metodo AXE ci indica la seguente struttura:

XeF4 secondo il metodo AXE ha struttura planare quadrata dato che lo xeno possiede due coppie di elettroni non condivise che si situano sopra e sotto il piano molecolare.

la molecola di acqua presenta due doppietti solitari sull’ossigeno e la sua struttura, secondo il metodo AXE è

si deduce quindi che secondo la teoria VESPR nessuna delle molecole è planare.
Risposta corretta D
46. Qual è la formula minima di un composto costituito dal 23,965% in peso di ossigeno e la restante parte da iodio?
A) I9O4
B) I2O5
C) IO
D) IO2
soluzione
i pesi molecolari sono:
I9O4 = 1132,1+ 64= 1196
I2O5 253,8 + 80 = 333.8
IO = 126,9 + 16 = 142,9
IO2 = 126,9 + 32 = 158,9
Pertanto le % di O sono rispettivamente
1196:64 =100 :X X = 5,35%
338,8 :80 = 100: X X = 23,9 %
142,9 :16 = 100 : X X = 11,19 %
158,9 :32 = 100: X X = 20,13 %
la risposta corretta è I2O5 quindi B
47. Calcolare il pH di una soluzione ottenuta aggiungendo 4,0 g di NaOH (s) a 1,0 L di soluzione di HF 0,1 M (trascurare le variazioni di volume).
A) 13,0
B) 9,8
C) 8,1
D) 7,5
soluzione
La concentrazione di NaOH è 4/40 = 0,1 M ed essendo ambedue i composti a concentrazione uguale, tutto l’acido debole viene trasformato in sale NaF e quindi il PH risultante è dovuto all’idrolisi del sale per cui:
F- +H2O → HF + OH- e se indichiamo con Cs la concentrazione del sale si ha .
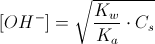
[OH-] = √ ( 10-14 / 7,2 x 10-4 ) 0,1 = √0,138 x 10-10 x 0,1 = √1,38 x 10-12 = 1,17 x 10-6 POH = -log [OH-] = 6-log 1,17 = 6- 0,07 = 5,93
essendo PH+POH =14 PH= 14-5,93 = 8,1
risposta corretta C
48. Una compressa di Maalox (farmaco antiacido) contiene 200 mg di Mg(OH)2 (s) e 200mg di Al(OH)3 (s). Quante compresse occorrono per neutralizzare 72,0 mL di una soluzione di HCl 0,5 M?
A) 2
B) 3
C) 4
D) 1
soluzione
le millimoli di acido sono moli HCl = 72 x 0,5 = 0,036
le moli di OH- contenute in una compressa sono calcolate da 0,200 / 58,3 = 0,00343 e 0, 200 / 78 = 0,00256
in totale le moli di base in una compressa sono 0,006 per cui occorrono 6 pillole per neutralizzare l’acido.
Le risposte fornite nel quesito non sono corrette
49- Un alogenuro di bario, BaX2, contiene il 46,21% (m/m) di bario. Stabilire quale alogeno è X.
A) cloro
B) bromo
C) fluoro
D) iodio
soluzione
se il Ba è contenuto per il 46,2 % la % di X deve essere 100 – 46,2 =53,8 %
controlliamo adesso la % si X nei vari composti Ba Cl2 BaBr2 BaF2 BaI2
per BaCl2 la quantità % di Cl è:
208 : 71 = 100 :X X= 34,1 % Cl
Per BaBr2 la quantità % di Br è:
297,14 : 160 =100 :X X= 53,8 %
per BaF2 si ha
175,3 : 38 = 100 :X X= 21,7 %
per BaI2 si ha :
391,1 : 127 x 2 = 100 :X X= 64,9 %
come si vede il composto BaX2 è BaBr2 e l’alogeno è Br
risposta corretta B
50. Un gas Y occupa il volume di un litro alla temperatura di 273,15 K e alla pressione di 1,01 ∙105Pa. In queste condizioni il suo peso è 1,293g. A quale temperatura un litro dello stesso gas pesa 1,000 g, se la pressione è diventata 0,917 ·105Pa?
A) 365 K
B) 388 K
C) 321 K
D) 305K
soluzione
quì abbiamo un gas a volume costante a cui applichiamo l’equazione di stato dei gas nelle due condizioni di T e P:
P1V =n1 x RT1
P2V= n2 RT2
P1/P2 = n1/n2 (T1/T2)
1,01 / 0,917 = 1,293/1 (T1/T2)
1,101 = 1,293 x T1/T2
T2 = 1,293 x T1 /1,101 = 320,7 =321 K
risposta corretta C
51. Alla temperatura di 291,15 K e alla pressione di 1,01 ·105 Pa, la solubilità (espressa come frazione molare) dell’ammoniaca in metanolo è 0,35. Calcolare la solubilità in % m/m.
A) 34%
B) 17%
C) 13%
D) 22%
soluzione
frazione molare di NH3 =moli NH3 / moli H3 + moli metanolo
le moli di NH3 si possono calcolare da PV=nRT perciò 1,01 x 105 x 1 = n x 8,314x 291,15
0.000417 x 105 = 41,7 moli di NH3
note le moli di NH3 possiamo agevolmente calcolare le moli di metanolo ricordando che la fraz.molare è
moli NH3 / moli H3 + moli metanolo = fraz.molare
Pertanto la quantità di metanolo è 41,7/41,7 +X =0,35
41,7 x 0,35 + 0,35 X = 41,7 14,6 + 0,35X = 41,7 0,35 X = 41,7 – 14,6 X= 27,2/0,35 = 77,71 moli di metanolo
per calcolare la % m/m 0cc0rre conoscere la massa cioè i grammi sia di NH3(PM=17) che di Metanolo CH3OH (PM= 32 )
i grammi di NH3 sono NH3= 41,7 x 17 =708,9 g
i grammi di metanolo sono 32 x 77,71 = 2486,7
per calcolare la % m/m occorre calcolare la massa totale che è 708,9 + 2486,7 =3195,6
pertanto la % m/m è data dalla proporzione
3195,6 :708,9 =100 😡 x=22,18 %
risposta corretta D
52. Determinare la percentuale (v/v) di H2 (g) e di Ar (g) in una miscela che presenta una densità di 1102
g/m3 misurata alla temperatura di 303,15 K e alla pressione di 1,01 ·105 Pa.
A) H2 (g): 33% Ar (g): 67%
B) H2 (g): 61% Ar (g): 39%
C) H2 (g): 14% Ar (g): 86%
D) H2 (g): 38% Ar (g): 62%
soluzione
1102 g/m3 = 1102 g /1000 litri = 1,102 g/ litro
d = MAPA/RT + MBPB/RT
moltiplicando ambo i membri per RT/p e semplificando si ha:
RT d/p = MApA/p + MBpB/p
Per la legge di Dalton pA/p = xA e pB/p = xB dove xA e xB sono rispettivamente la frazione molare di A e la frazione molare di B si ottiene:
RT d/p = MA xA + MB xb che ci permette di ottenere la composizione della miscela conoscendo la densità.
Infatti:
0,0821 x 1,102 x 303,15 = Xa Ma +XbMb
303,15 x 1,102 x 8,314 / 1,01 x 105 = 2 XH + 39,9 XAr ( ricordiamo che Xa+Xb =1 ) quindi
27,5= 2XH + 39,9 (1- XH)
27,5 = 2XH +39,9 -39,9 XH
39,9XH -2XH = 39,9-27,5
37,9 Xh= 12,4
XH= 0,33
xAR = 0,67
%H =33 %
%Ar= 67%
risposta corretta A
53. Un ossido di uranio UXOY è costituito dal 89,9% di uranio. Determinare la formula minima del composto.
A) UO2
B) U3O5
C) U2O3
D) UO4
soluzione
se l’ Uranio è 89,9% allora la % di ossigeno è 100-89,9= 10,1%
Per calcolare la formula minima dividiamo le % per il peso atomico
89,9/ 238= 0,377
10,1 / 16 = 0,631
dividiamo per il numero più piccolo
Uranio =0,377/0,377 =1
Ossigeno 0,631/0,377= 2,65
moltipilichiamo per 2 per ottenere valori quasi interi
la formula minima è quindi U2O5
risposta corretta A
54. Un recipiente chiuso e termostatato a 375 K è occupato in parte da acqua liquida. Qual è la pressione nel recipiente misurabile con un manometro?
A) maggiore di quella atmosferica
B) minore di quella atmosferica
C) uguale a quella atmosferica
D) non è possibile rispondere alla domanda in mancanza di dati aggiuntivi
soluzione
Quando nel recipiente chiuso il vapore è a contatto col liquido, ad una determinata temperatura si stabilisce un equilibrio tra le molecole che evaporano e quelle che vengono trattenute sulla superficie del liquido. La pressione del vapore misurata in condizioni di equilibrio si chiama tensione di vapore. Sappiamo inoltre che a 100° C la tensione del vapore acqueo è 1 atmosfera (infatti l’acqua bolle a 100°C) se la temperatura aumenta, allora la tensione di vapore aumenta ricordando che a volume costante si ha :
P1/T1 =P2/T2
quindi 1 /273= P2 / 375 pertanto P2 = (1/273 )x 375 = 1,37 atm .
Risposta corretta A
55. Un sistema chiuso, in cui non avvengono reazioni chimiche, subisce una serie di processi
reversibili che lo riportano allo stato iniziale. Il sistema ha svolto lavoro di 500 kJ sull’ambiente
circostante. Quale delle seguenti affermazioni è vera?
A) dall’ ambiente circostante è entrato nel sistema un calore maggiore di 500 kJ
B) dall’ambiente circostante è entrato nel sistema un calore minore di 500 kJ
C) dall’ambiente circostante è entrato nel sistema un calore uguale a 500 kJ
D) nessuna delle precedenti
soluzione
sappiamo che per il primo principio della termodinamica ΔΕ = Q-L
se il sistema compie lavoro in condizioni irreversibili ( ad esempio un cilindro con un pistone che per effetto del calore si muove verso l’alto da un volume V1 ad un volume V2 contro la pressione esterna P) allora
ΔΕ = Q- P ΔV = Q-P (V2 -V1 )
se invece il processo è reversibile (in cui ogni stato del sistema differisce da quello precedente di un infinitesimo per cui è possibile ripristinare lo stato iniziale) allora P è la pressione di un gas ideale ottenibile da PV=RT ( per 1 mole) P= RT/V. Pertanto
L = – ∫ pdv =- ∫ RT/V dv =-R T ln V2/V1
Poichè ΔΕ = Q- P ΔV se il lavoro L è 550 KJ la quantità di calore deve essere maggiore del lavoro cioè di 500KJ in quanto ΔΕ non è nullo.
risposta corretta A
56. In un sistema chiuso, costituito da un solo componente, le transizioni di fase avvengono:
A) a temperatura e volume costanti
B) a temperatura costante e pressione variabile
C) a temperatura e pressione costanti
D) a volume e pressione costanti
soluzione
Un sistema chiuso è un sistema che non scambia massa con l’ambiente esterno, mentre può effettuare con esso scambi di energia in tutte le sue forme (compreso il calore) o di lavoro.
La Fase di una sostanza è uno stato della materia stabile ed uniforme (che possiede proprietà intensive omogenee ed invariate nel tempo). Una fase può trasformarsi in un’altra per effetto della temperatura e della pressione e questo passaggio è detto Transizione di fase cioè la conversione, ad una data temperatura e pressione, di una fase in un’altra. La Temperatura a cui avviene la trasformazione è detta Temperatura di transizione ed è la temperatura a cui, per una data pressione, le due fasi coesistono. Se consideriamo un sistema chiuso contenente ghiaccio e forniamo ad essa energia sotto forma di calore, l’acqua cambia stato fisico trasformandosi in liquido (fusione).Quando la fusione inizia, la temperatura rimane costante in quanto il calore serve a spezzare i legai tra molecole ed ovviamente la pressione rimane costante.
si deduce che la risposta corretta è C
57. Una sostanza si decompone seguendo una cinetica del primo ordine, con un tempo di dimezzamento di 37 s. Quanto tempo è necessario per ridurre la concentrazione del reagente ad un quinto del suo valore iniziale?
A) circa 96 s
B) circa 66 s
C) circa 56 s
D) circa 86 s
soluzione
In un sistema omogeneo chiuso, in condizioni di reazione costanti (pressione, temperatura, ecc.) la velocità della reazione è sempre proporzionale alle potenze delle concentrazioni.
k= costante di velocità (o velocità specifica che numericamente è uguale alla velocità quando le conc. sono 1M)
v = k[A]a[B]b[C]c
n = a+b+c+…. ordine globale della reazione
Per reazioni del primo ordine (n=1) k è espressa in s-1.
Per un’ equazione del primo ordine: – d[A]/dt = k[A] ( il segno – si riferisce al fatto che la concentrazione diminuisce nel tempo) per cui si può anche scrivere
d[A]/[A] = – k dt ed integrando
ln [A] – ln [A]o = – kt
ln [A]/[A]o = – kt ln [A] = -kt + ln [A]o [A] = [A]o e-kt
in termini di logaritmi decimali
log [A] = k/2,303 x t + log [A]o
Ad un qualsiasi tempo t, la concentrazione di reagente non consumato, [A], e la concentrazione del prodotto,[X], sommate, danno la concentrazione iniziale del reagente, [A]o:
[A] + [X] = [A]o
esprimendo in funzione di X:
[X] = [A]o – [A]
sostituendo a [A] il valore dell’equazione integrata si ha:
[X] = [A]o – ([A]o e-kt) [X] = [A]o(1 – e-kt)
Una grandezza utile per la caratterizzazione della velocità di reazione è il tempo di dimezzamento (half life time) che si indica con τ che è il tempo necessario perché la concentrazione del reagente si dimezzi cioè quando
[A] = 1/2 [A]0
Per calcolare il tempo di dimezzamento
sostituiamo ad [A] il valore 1/2 [A]0
nell’equazione ln [A]/ [A]o = – kt e si ha:
ln 1/2 = -kt ln 1 – ln 2 = – kτ ln 2 = – kτ
nel caso del quesito possiamo calcolare k in quanto conosciamo il tempo di emivita o di dimezzamento:
τ = ln 2/ k da cui k= ln2/37 k= 0,0187
poiché ci viene chiesto di calcolare dopo quanto tempo la concentrazione iniziale diminuisce sino a diventare 1/5 di quella iniziale cioè quando [A] = 1/5 [A]0
sapendo che ln [A]/ [A]o = – kt ed essendo [A] = 1/5 [A]0
ln 1/5 = -kt ln 1 – ln 5 = – kτ – ln 5 = – kτ cioè
ln 5 = 0,0187 t t= 1,61 /0,0187 t= 86,0 s
risposta corretta D
58. In un reattore aperto avviene la combustione della grafite. Scegliere, tra le seguenti azioni, quella utile a spostare l’equilibrio verso la formazione dei prodotti.
A) alimentare anidride carbonica
B) diminuire la temperatura a pressione costante
C) aggiungere un catalizzatore
D) nessuna delle procedenti
soluzione
essendo la reazione di combustione C + O2 → CO2 + calore
la risposta A non è corretta in quanto l’aumento di CO2 sposterebbe la reazione verso sinistra.
Se consideriamo adesso quale sia l’effetto della pressione sulle molecole. sappiamo che un aumento di pressione tende a far diminuire il cammino libero medio delle molecole che reagiscono più facilmente e rapidamente favorendo quindi la reazione di formazione dei prodotti. Nel caso specifico però la pressione è costante pertanto essa non può modificare la direzione della reazione né in un senso né in un altro.
Dalla reazione di combustione si osserva che si sviluppa calore
C + O2 → CO2 + Q
per cui una diminuzione di temperatura toglie calore cioè diminuisce Q e ne determina lo spostamento della reazione verso i prodotti ( infatti dobbiamo considerare il calore come se si trattasse di un altro composto).
Si deduce che la risposta corretta è B
59. La costante di equilibrio tra i conformeri equatoriale/assiale nel bromocicloesano è K1 = 2.2,
mentre nel clorocicloesano è K2 = 2.4, sebbene il bromo sia un atomo più grande del cloro. Si deduce, quindi, che il cloro ha una preferenza maggiore per la posizione equatoriale rispetto al bromo. Scegliere la spiegazione più plausibile tra le seguenti:
A) la lunghezza del legame C-Br è maggiore di quella C-Cl, per cui, nella conformazione assiale, si
ha una diminuzione della tensione sterica 1,3 diassiale per il bromo.
B) il bromo stabilizza maggiormente il conformero assiale per un fenomeno di iperconiugazione
C) il conformero equatoriale del clorocicloesano ha una maggiore simmetria del corrispondente
bromoderivato
D) il bromo stabilizza maggiormente il conformero assiale per un fenomeno di polarizzabilità
soluzione
Per iperconiugazione si intende l’interazione degli elettroni di un legame (di solito C-H o C-C) con unorbitale p vuoto o parzialmente riempito che può essere non impegnato in legami o di antilegame oppure con un orbitale π riempito. Tale interazione origina un orbitale molecolare più esteso che aumenta la stabilità del sistema. Come si può notare non è questo il caso del quesito.
La simmetria dei due conformeri non giustifica la predilezione del cloro per i legami equatoriali nè la polarizzabilità dei due atomi.
Solamente la lunghezza del legame tra Carbonio e Cloro più piccola di quella di quella tra Carbonio e Bromo favorisce per motivi sterici la predilezione della posizione equatoriale.
risposta corretta A
60. Predire quali sono gli stereoisomeri che si ottengono dalla reazione di addizione elettrofila di
bromo al trans-3-esene.
A) una miscela racemica degli enantiomeri treo del 3,4-dibromoesano
B) la forma meso del 3,4-dibromoesano
C) una coppia di diastereoisomeri
D) tutti i possibili stereoisomeri
soluzione
in questa molecola si hanno 2 centri chirali i quali danno origine a stereoisomeria ottica. La reazione con Bromo dà origine al composto
Ricordiamo che quando nella molecola esiste un piano di simmetria interno, come in questo caso,si ottiene un composto meso otticamente inattivo. Infatti ognuno dei due atomi di C asimmetrici dà origine ad attività ottica il primo di segno + ed il secondo di segno – ambedue però con lo stesso valore numerico per cui l’attività ottica è nulla.Un racemo invece è la miscela in rapporto 1:1 di due enantiomeri uno di segno + ed uno di segno – di un composto chirale. Il conglomerato racemico invece è una miscela meccanica equimolare di cristalli ciascuno dei quali contiene solo uno dei due enantiomeri presenti in un racemato.
Come si evince, la risposta corretta è B





Lascia un commento