GIOCHI DELLA CHIMICA NAZIONALI 2019 CLASSI A-B
1. Indicare quale, tra i seguenti composti binari, contiene il legame covalente dal carattere più polare.
A) CO2
B) SiO2
C) NO
D) NaCl
soluzione
NaCl non ha un legame covalente ma ha un legame esclusivamente polare. Na+ e Cl- formano infatti un reticolo ionico.
Nell’anidride carbonica CO2 il Carbonio e l’ossigeno utilizzano orbitali ibridi SP2 con formazione di un doppio legame e la struttura è lineare con un momento dipolare pari a zero in quanto i due vettori sono uguali in modulo ma con verso opposto.
In NO monossido di azoto, gli orbitali molecolari possiedono un elettrone p di antilegame spaiato. La differenza di elettronegatività è pari a 0,4 D ( 3,04 D per l’N e 3,44 D per l’ossigeno ) pertanto è un legame covalente polare ma con bassa polarità.
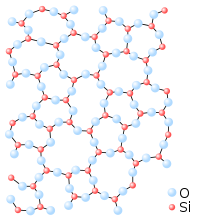
La molecola di SiO2 è strutturalmente molto stabile perchè forma un reticolo covalente in cui il Si forma 4 legami σ con altrettanti atomi di ossigeno ognuno dei quali forma due legami con due atomi di Si. I legami SiO sono molto polari (Si= 1,9 D ed O 3,44 D) tuttavia non sono prevalentemente ionici rispetto al legame covalente
![]()
da quanto abbiamo esposto si vede che la molecola covalente più polare è SiO2.
risposta corretta B
2. L’emissione di una particella β+ da parte di un nucleo atomico comporta:
A) un aumento di un’unità del numero atomico
B) una diminuzione di un’unità del numero atomico
C) un aumento di un’unità del numero di massa
D) una diminuzione di quattro unità del numero atomico
soluzione
Il decadimento β+ avviene perchè un protone legato si trasforma in un neutrone legato, un positrone ed un neutrino:
Il positrone, che è l’ antiparticella dell’elettrone ha carica positiva, pertanto questo decadimento viene indicato con il termine beta più (β+).
Un esempio di decadimento beta più è il decadimento del radionuclide Fluoro-18 nel nuclide stabile ossigeno 18, che segue questo schema:
si può osservare che il numero di massa rimane uguale (18) mentre varia il numero atomico che diminuisce di un’unità.
La risposta corretta è pertanto B
3. Indicare il numero massimo di elettroni che possono essere contenuti in un orbitale 5f:
A) 14
B) 10
C) 2
D) 1
soluzione
Ogni orbitale è una funzione matematica Ψ il cui quadrato fornice la probabilità di trovare l’elettrone nel punto descritto dalla funzione. Ciò che comunemente si intende per orbitale non è altro che la densità di probabilità (come in questo caso). Sappiamo che una qualsiasi funzione orbitale che è soluzione dell’equazione di Shrodinger possiede ben determinati numeri quantici ( n,l,m) che possono essere uguali per due elettroni ma devono differire per il numero quantico di spin che può assumere solo valori +½ oppure -½.
L’oritale Ψ5f può descrivere quindi 2 soli elettroni con numeri quantici 5n,l,m,s±½.
Risposta corretta C
4. Indicare i coefficienti stechiometrici (in ordine sparso) necessari per bilanciare la seguente reazione:
FeS + KClO3 + HCl → FeCl3 + S + KCl + H2O
A) 1, 1, 2, 2, 2, 3, 4
B) 1, 1, 1, 2, 2, 3, 3
C) 1, 1, 2, 2, 3, 6, 6
D) 1, 1, 2, 2, 2, 3, 6
soluzione
siamo in presenza di una reazione redox in ambiente acido per HCl incui l’ossidante è ClO3- e le sostanze che si ossidano sono Fe+2 che forma Fe+3 ed S-2 che forma S
3[ClO3- + 6H+ + 6e –> Cl- + 3H2O
6[S-2 –> S +2 e
6[ Fe+2 –> Fe+3 + e
_________________________________
3ClO3- +18H+ + 6S-2 +6Fe+2 –> 3 Cl- +6 S + 9H2O +6Fe+3 e semplificando
ClO3- + 6 H+ + 2S-2 + 2 Fe+2 –> Cl- + 2 S + 3H2O + 2Fe+3
la reazione bilanciata è pertanto:
2FeS + KClO3 + 6HCl → 2FeCl3 +2 S + KCl + 3H2O
2,1,6,2,2,1,3
risposta corretta D (1, 1, 2, 2, 2, 3, 6)
5. Indicare quale, tra le seguenti specie, è un composto di coordinazione.
A) Ca(OH)2
B) PF5
C) Ni(CO)4
D) CH4
soluzione
I composti di coordinazione o composti complessi sono molecole in cui un catione metallico è coordinato (cioè legato con un particolare legame chimico) ad atomi o gruppi atomici con un numero di legami superiore al suo numero di ossidazione. In particolare si tratta di composti metallici in cui il metallo utilizza orbitali di tipo d (oppure ibridi ad es dsp3 o sp3d) per formare il legame di coordinazione.
Molte sostanze sono classificate come composti di coordinazione in quanto la loro chimica è facilmente descritta considerando un atomo o ione centrale Mn+ intorno al quale si possono disporre una grande varietà di molecole o ioni chiamati leganti (L, L’, …).
La carica del complesso risultante è determinata dalla carica del metallo e la somma delle cariche Ad es. se il metallo è lo ione Pt2+, si possono avere i seguenti complessi dove i leganti sono molecole di ammoniaca o ioni cloruro:
[Pt(NH3)4]2+ ; [Pt(NH3)3Cl]+; [Pt(NH3)2Cl2]; [Pt(NH3)Cl3]- ; [PtCl4]2
Il numero di coordinazione definisce il numero di gruppi che circondano il metallo in un composto di coordinazione. Può variare da 2 a 9.La geometria di coordinazione descrive l’arrangiamento o disposizione spaziale dei leganti intorno all’atomo o ione metallico centrale. Tra i composti forniti dal quesito, è evidente che il metallo che utilizza orbitali d è il nichel che forma Ni(CO)4 in cui gli elettroni di legame del CO <=CO vengono donati al Nikel che attraverso gli orbitali d retrodona i due elettroni agli orbitali di antilegame del CO (back donation) formando un legame abbastanza forte poichè si forma un ciclo
Risposta corretta C
6. 6,00 grammi di CaCO3 reagiscono con un eccesso di CH3COOH secondo la reazione, da bilanciare:
CaCO3 + CH3COOH → Ca(CH3COO)2 + CO2 + H2O
Se tutto il carbonato di partenza viene consumato nella reazione, calcolare i grammi di CO2 e i grammi di Ca(CH3COO)2 ottenuti.
A) CO2= 9,48 g; Ca(CH3COO)2 = 9,48 g
B) CO2= 9,48 g; Ca(CH3COO)2 = 2,64 g
C) CO2= 2,64 g; Ca(CH3COO)2 = 9,48 g
D) CO2= 2,64 g; Ca(CH3COO)2 = 5,28 g
soluzione
la reazione bilanciata è:
CaCO3 + 2CH3COOH → Ca(CH3COO)2 + CO2 + H2O
da cui si vede che da 1 mole di CaCO3 (che pesa 100 g) si ottiene 1 mole di CO2( che pesa 44 g )
100 : 44 di CO2 =6 :X X= 2,64 g di CO2
si osserva anche che da 100 g di CaCO3 si ottiene 1 mole di Ca(CH3COO)2 cioè 158.7 g
quindi
100 : 158,17 = 6 : X X = 9,49 g di Ca(CH3COO)2
risposta corretta C
7. Il dottor McCoy ha scoperto un nuovo elemento. Di questo elemento, che ha battezzato Vogonio (Vg), conosce la massa atomica (402,23 g mol‒1) e i principali stati di ossidazione (+2, +3). Ha notato che il cloruro vogonico (VgCl3) è molto igroscopico e che all’aria forma un sale idrato di formula VgCl 3 · x H2O. Scaldando questo composto in presenza di un anidrificante ottiene il sale anidro di massa pari al 75,8% di quella del composto iniziale. Individuare il valore di x.
A) 3
B) 6
C) 9
D) 12
soluzione
Se Vg = 402,23 il peso del suo cloruro è VgCl3 = 508.73 g
Questo cloruro possiede X H2O moli di acqua igroscopica quindi il suo peso sarà VgCl3.XH2O = 508,73 + X18
(18 è il peso molecolare di H2O)
Il quesito ci informa che una volta eliminata l’acqua igroscopica rimane VgCl3 che è il 75,8% del peso iniziale pertanto deduciamo che il peso dell’acqua igroscopica (cioè 18X ) è 100-75,8=24,2 % del peso iniziale.
Il peso iniziale era 508,73 + 18X quindi il 24,2% del totale iniziale è 0,242 x (508,73 + 18X) .
Questo deve essere pertanto pari a X18
si può quindi scrivere che la quantità di acqua igroscopica è 18 X ma essa è lo 0,24,2 del totale che è 508,73 + 18X quindi 18X =0,242 ( 508,73 + 18X )=123,11 + 4,36X da cui 18X-4,36X = 123,11 cioè 13,64 X = 123,11
Pertanto X = 123,11/13,64 =9,0
risposta corretta C
8. Indicare la configurazione elettronica dell’arsenico nel suo stato fondamentale.
A) [Ne] 3s2 3p6 3d10 4s2 4p3
B) [Ar] 3d10 4s2 4p5
C) [Ar] 4s2 4d10 4p3
D) [Kr] 3d10 4s2 4p3
soluzione
La struttura elettronica dell’arsenico nel suo stato fondamentale, con numero atomico 33 possiede quindi 33 elettroni ed è la seguente:
[Ar] 3d104s24p3
questa struttura è equivalente a [Ne] 3s2 3p6 3d10 4s2 4p3 in quanto [Ne] 3s2 3p6 =[Ar]
la risposta corretta è A
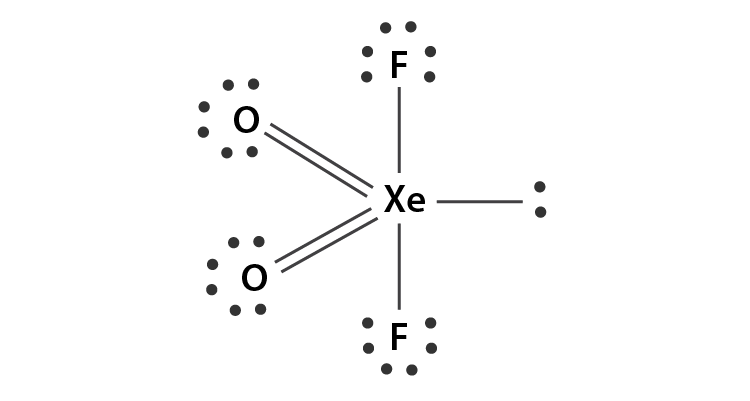
9. Indicare, secondo la teoria VSEPR, la geometria della molecola XeF4
A) tetraedrica
B) planare quadrata
C) ottaedrica
D) a sella
soluzione
La teoria VSEPR ( dall’inglese Valence Shell Electron Pair Repulsion, cioè repulsione delle coppie elettroniche del guscio di valenza) è un metodo proposto da Gillespie per individuare la disposizione geometrica degli atomi in una molecola considerando che i doppietti elettronici siano essi impegnati o non impegnati (lone pairs) in un legame, tendono a disporsi il più lontano possibile fra loro in conseguenza della legge di Coulomb, secondo la quale cariche elettriche di segno uguale si respingono. Il metodo comunemente usato per stabilire la geometria molecolare nella teoria VESPE è il cosiddetto metodo AXE. La sigla AXE rappresenta con la lettera A l’atomo centrale e ha sempre come valore sottinteso 1. La X rappresenta quanti legami sigma si formano tra l’atomo centrale e gli atomi ad esso legati. I legami covalenti multipli (doppi, tripli, etc) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti nell’atomo centrale. La somma di X ed E, definita come numero sterico, è associata anche al numero totale di orbitali ibridati considerati dalla teoria del legame di valenza.Quì di seguito puoi trovare alcuni esempi:
![]()
![]()
![]()
![]()










la molecola di XeF4 presenta sullo Xeno 2 coppie di elettroni solitari quindi secondo la teoria VESPR è una struttura del tipo AX4E2 pertanto la struttura è

cioè planare quadrata.
Risposta corretta B
10. Individuare l’affermazione ERRATA:
A) il silicio è meno elettronegativo del carbonio
B) il piombo appartiene al gruppo 14
C) il selenio appartiene al gruppo 16
D) il germanio ha il raggio atomico minore di quello dell’arsenico
soluzione
Il silicio ha un’elettronegatività di 1,9 D mentre il carbonio ha 2,55 D quindi la risposta A è corretta
Dalla tabella di Mendeleev si osserva che Pb appartiene allo stesso gruppo del C, Si Ge,Sn, cioè il 14 pertanto anche la risposta B è corretta
Il selenio appartiene allo stesso gruppo dell’ossigeno e dello zolfo cioè il gruppo 16 quindi anche C è la risposta corretta.
Infine, sappiamo che in un gruppo il raggio atomico diminuisce con l’aumentare del numero atomico e poichè il germanio con numero atomico 32 precede l’arsenico con numero atomico 33 allora il germanio ha un raggio atomico maggiore dell’arsenico per cui la risposta errata è D.
11. In un recipiente vengono posti a reagire 4,86 g di FeCl3 e 3,48 g di K2SO4 secondo la reazione da bilanciare:
FeCl3 + K2SO4 → Fe2(SO4)3 + KCl
Indicare l’affermazione corretta:
A) FeCl3 è il reagente limitante e a reazione completa avranno reagito 2,0 ·10‒2 mol di K2SO4
B) FeCl3 è il reagente limitante e a reazione completa si otterranno 4,0 ·10‒2 mol di KCl
C) K2SO4 è il reagente limitante e a reazione completa avranno reagito 2,0 ·10‒2 mol di FeCl3
D) K2SO4 è il reagente limitante e a reazione completa si otterranno 4,0 ·10‒2 mol di KCl
soluzione
la reazione bilanciata è:
2FeCl3 +3 K2SO4 → Fe2(SO4)3 + 6KCl
2 x 162,2 g + 3 x 174,259
324,4 + 522,78
considerato che per 324,4 di FeCl3 occorrono 522,78 + evidente che se mettiamo areagire 4,86 g di FeCl3 e 3,48 g di K2SO4 il reattivo limitante è K2SO4.
Ioltre, se da 522,78 si ottengono 6 x 74,55 allora da 3,48 se ne otterrano X da cui
X= 3,48 x 447,3/ 522,78 = 3,28 g cioè 3,28 /74,55 = 0,044 moli = 4,4 x 10-2 moli
Risposta corretta D
12. Il trifluoruro di boro BF3 è un importante catalizzatore acido di Lewis. Generalmente non lo si trova puro, ma sotto forma di complesso eterato di formula BF3 · CH3CH2OCH2CH3 che, a temperatura ambiente, è un liquido incolore. Calcolare la percentuale in massa di BF3 contenuto in questo complesso.
A) 52,2%
B) 50,0%
C) 47,8%
D) 30,0%
soluzione
se in BF3 · CH3CH2OCH2CH3 vi è BF3 = in 100 g :X
141,94 : 67,81 = 100 :X X= 47,8 %
risposta corretta C
13. Nel 2267, a bordo dell’Enterprise, il dottor McCoy ha una tavola periodica aggiornata. Dopo gli orbitali f, infatti, sono stati scoperti elementi che riempiono gli orbitali g e gli orbitali h. Indicare il numero atomico dell’elemento che, per primo, sblocca gli orbitali g, secondo la regola della diagonale (detta anche di Madelung o di Klechkowski).
A) Z = 121
B) Z = 221
C) Z = 402
D) A = 402
soluzione
la configurazione elettronica di un elemento si può costruire seguendo la regola detta diagonale di Madelung secondo la quale gli elettroni si dispongono in ordine crescente secondo la somma dei numeri quantici n e l:
Ad esempio, l’orbitale 4s ha numero quantico principale uguale a quattro e numero quantico secondario uguale a zero pertanto la somma n + l = 4 + 0 = 4; l’orbitale 3d ha numero quantico principale uguale a 3 e numero quantico secondario uguale a 2 pertanto la somma n + l = 3 + 2 = 5. Gli elettroni quindi si disporranno andando ad occupare per primo l’orbitale per il quale la somma n+l è minore.
Se la somma dei due numeri quantici è la stessa allora verrà occupato per primo l’orbitale in cui n ha valore più basso.

Gli elementi oltre il numero atomico 92 che corrisponde al numero di protoni dell’Uranio, sono definiti transuranici; quando superano il 104 sono conosciuti come superpesanti. Questi ultimi non esistono in natura ma possono essere prodotti negli acceleratori di particelle, “sparando” dei nuclei relativamente leggeri contro nuclei più pesanti possibili.L’esistenza teorica della serie è stata proposta da Glenn Seaborg vincitore del Nobel nel 1951 per la scoperta dei primi 5 elementi transuranici.
I superattinidi sono elementi chimici ancora da scoprire che partono dal numero atomico 121 (unbiunio) al 153 (unpentrio), in cui gli orbitali 5g e 6f sono riempiti.
La serie dei superattinidi è stata predetta seguendo la serie dei transattinidi, elementi con numero atomico che supera il 103 che è il Laurenzio.

questo modello di tavola periodica è chiamato Modello di Pyykkö. Da questa tavola si evince che il primo degli elementi superattinidi con orbitali g occupati è l’elemento con Z=121 a cui viene attribuito il nome di UNBIUNIO.
Risposta corretta A
14. Indicare, secondo la teoria VSEPR, la geometria della molecola BrCl5
A) planare quadrata
B) piramidale quadrata
C) a bipiramide trigonale
D) ottaedrica
soluzione
La teoria VSEPR ( dall’inglese Valence Shell Electron Pair Repulsion, cioè repulsione delle coppie elettroniche del guscio di valenza) è un metodo proposto da Gillespie per individuare la disposizione geometrica degli atomi in una molecola considerando che i doppietti elettronici siano essi impegnati o non impegnati (lone pairs) in un legame, tendono a disporsi il più lontano possibile fra loro in conseguenza della legge di Coulomb, secondo la quale cariche elettriche di segno uguale si respingono. Il metodo comunemente usato per stabilire la geometria molecolare nella teoria VESPR è il cosiddetto metodo AXE. La sigla AXE rappresenta con la lettera A l’atomo centrale e ha sempre come valore sottinteso 1. La X rappresenta quanti legami sigma si formano tra l’atomo centrale e gli atomi ad esso legati. I legami covalenti multipli (doppi, tripli, etc) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti nell’atomo centrale. La somma di X ed E, definita come numero sterico, è associata anche al numero totale di orbitali ibridati considerati dalla teoria del legame di valenza.Quì di seguito puoi trovare alcuni esempi:
![]()
![]()
![]()
![]()










Il composto BrCl5 presenta sul Br una coppia elettronica solitaria per cui è del tipo AX5E che come sappiamo ha la seguente struttura:

Risposta corretta B
15. Tra le seguenti coppie di molecole, indicare quella tra cui si instaura il legame intermolecolare più forte:
A) BCl3, H2O
B) NH3, NH3
C) PH3, PH3
D) CH4, CCl4
soluzione
cLe forze intermolecolari possono essere attrattive o repulsive e si esplicano tra due o più molecole, che possono essere uguali oppure diverse fra loro. Questo tipo di forze nasce fra molecole in cui il baricentro delle cariche negative non coincide con il baricentro delle cariche positive. Ciò è dovuto al fatto che alcune molecole presentano un momento dipolare risultante non nullo, e si comportano dunque come dei deboli dipoli elettrici. Le forze intermolecolari determinano le proprietà fisiche di una sostanza, soprattutto nei passaggi di stato che coinvolgono i liquidi(solido-liquido e liquido-gas).Un’elevata forza fra le molecole di una soluzione (ad esempio un legame ad idrogeno, come nel caso dell’acqua) fa innalzare il punto di ebollizione di quest’ultima, perché per riuscire a portare le molecole in fase vapore occorre fornire maggior energia sotto forma di calore per rompere questi legami. tra le forze intermolecolari distinguiamo :
Le forze di Van Der Waals
Le forze di Van der Waals, sono un insieme di interazioni intermolecolari che comprende le Forze di London e le interazioni dipolo-dipolo.] Le forze di Van der Waals sono interazioni che riguardano sia molecole polari che molecole apolari, che siano allo stato liquido o solido della materia, e fanno sì che le molecole appartenenti a questi due stati di aggregazione siano più compatti e meno mobili.
Le forze di van der Waals si possono avere quando si verifica:
- un’attrazione tra dipoli permanenti (in questo caso prende il nome di interazione di Keesom
- un’attrazione tra dipolo permanente e dipolo indotto (in questo caso prende il nome di forza di Debay);
- un’attrazione tra dipolo istantaneo e dipolo indotto (in questo caso si parla di forza di London)
Quando in una molecola l’atomo centrale possiede una o più coppie di elettroni non impegnati in legame, la molecola risulta asimmetrica e, poiché i singoli momenti dipolari non si annullano, risulta anche complessivamente polare. Questo è, per esempio, il caso dell’acqua, H2O e dell’ammoniaca, NH3.
Tra le molecole proposte dal quesito risulta evidente che l’ NH3 è dotato di un doppietto elettronico libero ed in questo caso la forza preponderante è l’interazione di Keesom, infatti, queste interazioni elettrostatiche, dette anche interazioni dipolo – dipolo, nascono fra due molecole entrambe dotate di un proprio momento dipolare, le quali tendono a disporsi in modo da avvicinare i poli di carica opposta:
dove k corrisponde alla costante di Boltzman, μ1 e μ2 ai momenti dipolari delle due molecole, ε0 alla costante dielettrica nel vuoto e r alla distanza fra i due dipoli.
Anche se l’H2O possiede due doppietti elettronici liberi sull’ossigeno e quindi ha un forte momento dipolare, il BCl3 con cui è a contatto ha una struttura trigonale planare ed è simmetrica e non è polare quindi si ha bassa interazione intermolacolare.
PH3 è una molecola polare come NH3 in quanto possiede un doppietto elettronico libero ma il momento dipolare è molto differente tra le due molecole: μ = 1,47 D per NH3 μ = 0,58 D per PH3
CH4 e CCl4 pur possedendo momenti dipolari tra C e H e tra C e Cl per la conformazione delle molecole la somma dei moduli dei vettori polarità CCl e CH è nulla.
Si evince che la risposta corretta è B
16. In un recipiente vengono posti a reagire 3,00 g di idrossido di cromo(III) con un eccesso di acido solforico secondo la reazione, da bilanciare:
Cr(OH)3 + H2SO4 → Cr2(SO4)3 + H2O
Al termine della reazione, tutta l’acqua formatasi viene scissa per elettrolisi in idrogeno ed ossigeno molecolari. Calcolare il volume di idrogeno molecolare formatosi in condizioni standard.
A) 1,95 L
B) 3,00 L
C) 1,34 L
D) 22,4 L
soluzione
la reazione bilanciata è:
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6 H2O
da 2 x 103 g di Cr(OH)3 si ottengono 6 x 18 di H2O quindi da 3,0 g se ne ottengono X X= 108 x 3,0 / 206 = 1,57
L’acqua che si ottiene viene poi sottoposta ad elettrolisi per ottenere H2 quindi
se da H2O si ottiene H2 da 1,57 g se ne ottengono X cioè 18:2 = 1,57 : X X= 0,174 g
Trattandosi di un gas, il volume che corrisponde a 0,174 g di H2 si ottiene da PV=nRT.
Trattandosi di condizioni standard T=273 K ed R=0,0821 e P) 1 atm perciò
V= (0,174/2) x 0,0821 x 273 / 1 = 0,087 x 22,414 = 1,95 L
Risposta corretta A
17. L’acqua regia (da non confondere con l’acquaragia, un solvente apolare) è una miscela di acido cloridrico ed acido nitrico acquosi concentrati. È così chiamata perché è in grado di sciogliere anche i metalli più nobili come l’oro, il metallo regale per eccellenza. Indicare cosa accade durante la reazione:
A) l’azione combinata delle proprietà ossidanti dell’acido nitrico e coordinanti del cloruro permettono l’ossidazione dei metalli e la formazione di clorocomplessi anionici solubili nel mezzo acquoso
B) l’azione combinata delle proprietà ossidanti del cloruro e coordinanti del nitrato permettono l’ossidazione dei metalli e la formazione di nitrocomplessi anionici solubili nel mezzo acquoso
C) il metallo disciolto in acqua regia non sta cambiando il suo stato di ossidazione
D) il metallo disciolto in acqua regia si sta riducendo
soluzione
L’acqua règia (o acido nitroclorico o acido cloronitrico o acido nitromuriatico) è una miscela, instabile a temperatura ambiente, composta da una mole di HNO3 e tre moli di HCl.
Essi reagiscono secondo la reazione: HNO3 + 3 HCl –> Cl2 + NOCl + 2H2O
Nessuno dei due acidi che compongono l’acqua regia, preso singolarmente, riesce a intaccare l’oro o platino o palladio: anche se da solo l’acido nitrico riesce a ossidare una piccolissima quantità di oro in ioni Au3+, occorrono gli ioni Cl– forniti dall’acido cloridrico complessano lo ione per trasformarlo in acido cloroaurico (HAuCl4) e permettere la continuazione della reazione di ossidazione.
Da quanto sopra si evince che la risposta corretta è A
18. Sciogliendo 1,00 ·10-3 mol di fosfito monoacido di sodio in un litro d’acqua si formano ioni sodio idrati. Indicare il numero di moli di ioni sodio idrati che si formano:
A) 1,00 · 10-3 mol
B) 2,00 · 10-3 mol
C) 3,00 · 10-3 mol
D) 1,00 mol
soluzione
il fosfito monoacido di sodio Na2HPO3 sciolto in H2O produce per ogni molecola 2 atomi di sodio :
se da 1 mole di Na2HPO3 si ottengono 2 moli di Na allora da 0,001 moli se ne ottengono X
1:2=0,001 :X X= 0,002 moli cioè 2 x 10-3 moli
Risposta corretta B
19. Tra le seguenti specie indicare quella in cui non sono presenti legami doppi:
A) XeO2F2
B) NO3
C) SNF3
D) nessuna delle precedenti opzioni è corretta
soluzione
Ovviamente sappiamo che l’ossigeno forma doppi legami e quindi le risposte A e B non sono corrette.
La molecola di SNF3 è invece una molecola in cui lo zolfo si lega all’azoto di NF3 con un legame triplo

la risposta corretta è C
20. Indicare tra i seguenti elementi quello che forma con l’ossigeno il legame covalente più polare:
A) Na
B) K
C) Mg
D) F
soluzione
sia Na che K ed Mg formano legami con l’ossigeno ma essendo la differenza di elettronegatività non elevata non sono molto polari, al contrario del composto che si forma con il Fluoro.Il difluoruro di ossigeno è un fortissimo ossidante, come suggerito dal fatto che in questo composto il n.ox dell’atomo di ossigeno è +2, che è un valore inusuale ne consegue che la polarità del legame covalente è maggiore degli altri composti con ossigeno.
Risposta corretta D
21. Un recipiente chiuso contiene n moli di un gas ideale. Se la pressione viene quadruplicata e il volume viene ridotto a sette sedicesimi di quello iniziale, la temperatura:
A) rimane costante
B) diminuisce
C) aumenta
D) non si può rispondere, in mancanza di informazioni aggiuntive
soluzione
ricordiamo che P1V1/T1 = P2V2/T2
se supponiamo P1=1 e V1=1 allora P2 = 4P1 e V2 = 7/16 V1
sostituendo avremo 1 x 1 /T1 = 4 x 7/16 /T2
da cui 1/T1 = 1,75/ T2 da cui da cui T2/T1 = 1,75 si evince che T2 > T1
Risposta corretta C
22. Per riscaldare 2,00 moli di acqua da 25,0 °C fino a 30,0 °C vengono impiegati 783,1 J. Quanta energia viene dispersa nel processo? La capacità termica specifica dell’acqua è 4,184 J K‒1g‒1.
A) 5 J
B) 40 J
C) 0,4 J
D) 30 J
soluzione
ricordiamo che per aumentare la temperatura dell’acqua da T1 a T2 occorre una quantità di calore pari a:
Q= m C (T2-T1)
dove m è la massa di acqua, C la capacità termica e T2,T1 è la temperatura finale ed iniziale.
pertanto Q= 2 x 18 x 4,184 ( 30-25) Q= 753,1 J
Avendo però impiegato 783,1 J pr l’aumento della temperatura, si evince che nel processo si disperdono
783- 753,12 = 30 J
risposta corretta D
23. La geometria molecolare (posizione media relativa degli atomi) della molecola di fosgene (COCl2) è:
A) trigonale piramidale, l’angolo Cl-C-Cl è 102.8°
B) trigonale piramidale, l’angolo Cl-C-Cl è 109.4°
C) trigonale planare, l’angolo Cl-C-Cl è 111.8°
D) trigonale planare, l’angolo Cl-C-Cl è 121.8°
soluzione
La teoria VSEPR ( dall’inglese Valence Shell Electron Pair Repulsion, cioè repulsione delle coppie elettroniche del guscio di valenza) è un metodo proposto da Gillespie per individuare la disposizione geometrica degli atomi in una molecola considerando che i doppietti elettronici siano essi impegnati o non impegnati (lone pairs) in un legame, tendono a disporsi il più lontano possibile fra loro in conseguenza della legge di Coulomb, secondo la quale cariche elettriche di segno uguale si respingono. Il metodo comunemente usato per stabilire la geometria molecolare nella teoria VESPE è il cosiddetto metodo AXE. La sigla AXE rappresenta con la lettera A l’atomo centrale e ha sempre come valore sottinteso 1. La X rappresenta quanti legami sigma si formano tra l’atomo centrale e gli atomi ad esso legati. I legami covalenti multipli (doppi, tripli, etc) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti nell’atomo centrale. La somma di X ed E, definita come numero sterico, è associata anche al numero totale di orbitali ibridati considerati dalla teoria del legame di valenza.Quì di seguito puoi trovare alcuni esempi:
![]()
![]()
![]()
![]()










Pertanto, secondo la teoria VESPR, la molecola è del tipo AX3 e non possiede doppietti elettronici liberi quindi la sua struttura è planare trigonale.


risposta corretta C
24. Utilizzando la tabella delle costanti di solubilità, indicare quale ione M2+ ha la concentrazione maggiore in una soluzione ottenuta mescolando volumi uguali di una soluzione 0,01 M di M(NO3)2 e di una soluzione 0,1 M di Na2CO3. (escludere la formazione di idrossidi)
A) Cu2+
B) Pb2+
C) Sr2+
D) Ba2+
soluzione
BaCO3 Kps=3×10-9 SrCO3 kps= 5,6 x 10-10 CuCO3 Kps= 2 x 10-10 PbCO3 Kps= 1,5 10-13
dovrebbe precipitare prima PbCO3 poi CuCO3 quindi SrCO3 ed infine BaCO3
quando inizia a precipitare CuCO3 la [ CO3= ] in soluzione è = Kps/ [Cu+2] e man mano che si susseguono le precipitazioni è evidente che lo ione preponderante nella soluzione è il Ba+2
risposta corretta D
25. Quante moli di SO2 (aq) si ottengono da 8,00 moli di KBr e 2,00 moli di H2SO4, secondo la reazione (da bilanciare)?
KBr (aq) + H2SO4 (aq) → Br2 (aq) + SO2 (aq) + K2SO4 (aq) + + H2O (l)
A) 2,34
B) 4,05
C) 3,11
D) 1,00
soluzione
la reazione è una reazione di ossidoriduzione in ambiente acido in cui Br- si ossida formando Br2 ed SO4-2 si riduce formando SO2
2Br- —> Br2 +2e
SO4-2 +2 e + 4H+ —> SO2 + 2H2O
_______________________________
2Br- +SO4-2 + 4H+ ——> Br2 + SO2 + 2H2O
la reazione bilanciata è pertanto:
2KBr (aq) + 2H2SO4 (aq) → Br2 (aq) + SO2 (aq) + K2SO4 (aq) + + 2H2O (l)
Da 2 moli di H2SO4 si ottiene 1 mole di SO2 e la quantità di KBr necessaria è solo 2 moli per cui KBr è in eccesso.
risposta corretta D
26. Quale delle seguenti soluzioni ha il più alto pH?
A) NaF 0,1 M
B) NaNO2 0,1 M
C) NH4Cl 0,1 M, NH3 0.1M
D) NaCN 0,1 M
soluzione
NaF è un sale che deriva da un acido debole HF e da un sale forte ed in acqua subisce idrolisi.
NaNO2 è un sale formato da acido debole (HNO2) ed una base forte (NaOH) ed anch’esso subisce idrolisi
Nel caso di un sale derivante da un acido debole e base forte, si ha [OH-]= √Kw x Cs /Ka pertanto per NaNO2 0,1 M Ka= 4,5 x 10-4
[OH-]= = √10-14 x 0,1 / 4,5 x 10-4 = 1,4 x 10-6
POH = 6-log 1,4 PH= 5,85
Per NaF si ha [OH-] = √(10-14 /7,2 x 10-4 )x 0,1 = √10-15/7,2 x 10-4 =√1,32 x 10-12 = 1,14 x 10-6
POH= 6- log 1,14 = 5,94 PH= 14- 5,94= 8,06
nel caso di NaCN in cui Ka= 6,2 x 10-10 si ha [OH-] =√ 10-14 x 0,1 /6,2 x 10-10 = 1,26 x 10-3
POH =3-log 1,26 = 2,9 PH= 14- 2,9 =11,1
NH3 ed NH4Cl formano una soluzione tampone per cui PH= PKa + log Ca/Cs
Essendo una base Kb=1,8 x 10-5 pertanto Ka= 10-14/1,8 x 10-5 = 5x 10-10 da cui
PKa = 10-log 5 =9,3
Essendo Ca=Cs ne consegue che PH= PKa = 9,3
dai risultati ottenuti si evince che il PH più basico è quello dell’ NaCN
Risposta corretta D
27. Un camino industriale emette fumi con una concentrazione di NO (g) pari a 25,00 μg /m3, con una portata di 120 m3/h (a 290,00 K e 1,01 ∙105 Pa) .
Quanti milligrammi di NO (g) sono emessi in 24 ore (nelle stesse condizioni di temperatura e di pressione)?
A) 92,55 mg
B) 72,00 mg
C) 31,82 mg
D) 48,50 mg
soluzione
25μg sono 0,025 mg in 1 ora vengono emessi 120 x 0,025 mg cioè 3 mg/h pertanto in 24 ore vengono emessi 72 mg
Risposta corretta B
28. Calcolare quanti kg di O2 sono contenuti in 7,21 m3 di aria misurati a 288,00 K e alla pressione di 1,01 x 105 Pa (la composizione dell’aria è: 21% v/v di O2 e 79% v/v di N2)
A) 8,15 kg
B) 4,33 kg
C) 2,04 kg
D) 7,18 kg
soluzione
7,21 m3 sono 7210 litri di aria e dal momento che l’ossigeno è contenuto per il 21% la quantità di ossigeno è
0,21 x 7210 = 1514,1 litri O2
la quantità in grammi di Ossigeno viene calcolata dall’equazione generale di stato dei gas PV=(g/PM) RT quindi
1,01 x 105 x 1514,1 = ( g/32 )x 288 x 8314 g = 1,01 x 105 x 1514,1x 32 / 288 x 8314 = 4893248000/ 2394400
g= 2044 = 2,044 Kg
risposta corretta C
29. Si consideri la seguente reazione nucleare: 74 Be + X –> 73 Li
Cosa rappresenta x?
A) un elettrone
B) un protone
C) un neutrone
D) una particella alfa
soluzione
Il berillio è unico in quanto è il solo elemento monoisotopico avente sia un numero pari di protoni, sia un numero dispari di neutroni.
sappiamo che in un atomo X si ha

A = numero di protoni + neutroni
Z= numero di protoni = numero di elettroni
Poichè il numero di massa rimane sempre uguale a 7, si deduce che X deve essere un elettrone: infatti un protone colpito da un elettrone forma un neutrone infatti p + e → n
che non modifica il numero di massa A (che rimane sempre uguale a 7) ma cambia il numero atomico Z cioè il numero di protoni che da 4 divengono quindi 3 e questo atomo è il Litio.
Risposta corretta A
30. Una pianta adulta di canna domestica è in grado di estrarre da un suolo inquinato una quantità di Cd di 7,78 mg/kg (in 1 anno). Calcolare i grammi di Cd estratti in 1 anno da un terreno agricolo di 250000 m2 ,in cui sono state trapiantate 3 piante per m2, con un peso medio delle canne di 480 g.
A) 3288 g
B) 2801 g
C) 1865 g
D) 4022 g
se in 1 m2 sono piantate 3 piante, in 250000 m2 vi sono 250000 x 3 = 750000 piante
se 1 pianta pesa 0,480 Kg 750000 piante pesano 750000 x 0,480 pesano 360000 Kg
Se 1 Kg di pianta estrae 7,78 g di Cd dal terreno 360000 ne estraggono X X = 360000 x 7,78 = 2800,8 g
X = 2801 g
Risposta corretta B
31. Quanti kg di etere etilico devono essere vaporizzati in una stanza 5m×4m×3m per avere una concentrazione di 1,7% in volume a 25 °C (limite di infiammabilità)?
A) 8,5 kg
B) 3,1 kg
C) 4,9 kg
D) 2,5 kg
soluzione
il volume della stanza è 5 x 4 x 3 metri cubi cioè 6o m3 = 60000 litri e l’1,7 % è il limite in cui l’etere etilico può essere contenuto quindi il suo volume deve essere 0,017 x 60000 = 1020 litri
PV = (g/PM) RT 1 x 1020 = ( g / 74,12 ) x 0,0821 x 298 g= 1020 x 74,12 / 0,0821 x 298 = 75602,4 /24,46 = =3091 g = 3,1 Kg
Risposta corretta B
32. Calcolare la massa atomica di X (espressa in unità di massa atomica, u) il cui composto XO3 ha una massa molecolare di 100 u.
A) 55,84 u
B) 26,98 u
C) 52,00 u
D) 69,72 u
soluzione
se in 100 u vi soni 3 x 16 u di O allora X = 100 – 48 = 52,00 u
risposta corretta C
33. Calcolare la concentrazione molare di Cl‒, in una soluzione ottenuta mescolando 250 mL di una soluzione 0,010 M di NaCl, con 150 mL di una soluzione 0,020 M BaCl2 (si considerino i volumi additivi).
A) 0,052 M
B) 0,021 M
C) 0,088 M
D) 0,067 M
soluzione
in 250 ml di una soluzione 0,01 M di NaCl vi sono 0,250 x 0,01 = 2,5 x 10-3 Moli di Cl-
in 150 ml di una soluzione 0,02 M di BaCl2 vi sono 0,150 x 0,02 = 3 x 10-3 moli di Ba ma il doppio di Cl- cioè
3 x 10-3 x 2 = 6 x 10-3 Moli di Cl-
In totale vi sono 2,5 x 10-3 + 6 x 10-3 Moli in un volume totale di 250 ml + 150 ml di soluzione finale cioè in 400 ml di soluzione. La concentrazione molare di Cl è pertanto costituita da 8,5 x 10-3 moli in 400 ml di soluzione pertanto
se in 400 ml vi sono 8,5 x 10-3 moli di Cl- in 1000 ve ne sono X X = 8,5 x 10-3 x 1000 / 400 = 0,021 moli
La soluzione finale avrà una concentrazione dì Cl- pari a 0,021 M
Risposta corretta B
34. Calcolare quanti grammi di zolfo S (s) si producono dall’ossidazione di 35 g di Na2S con un eccesso di solfito di sodio, secondo la reazione (da bilanciare):
S2‒(aq) + SO32‒ (aq) + H+(aq) → S (s) + H2O (aq)
A) 43,8
B) 21,5
C) 57,2
D) 13,9
soluzione la reazione è la seguente :
2[S-2 –> S +2e
1[SO3-2 + 4 e + 6 H+ –> S + 3H2O
2 S-2 + SO3-2 + 6H+ –> 3 S + 3H2O
70 g di Na2S contengono 32 g di S all0ra 32 g ne contengono X X= 32 x 32 /70 = 14,62 g cioè 14,62 /32 =0,45 Moli di S-2
se da 2 moli di S-2 si ottengono 3 moli di S allora da 0,45 moli se ne ottengono X X= 0,45 x 3 /2 = 0,675 moli
I grammi di S ottenuti sono pertanto 0,675x 32 = 21,6 g
Risposta corretta B
35. Calcolare quante moli di Cr(OH)3 (s) si ottengono da 4,00 moli di K2CrO4 (s), secondo la reazione (da bilanciare):
CN‒(aq) + CrO42‒(aq) + H2O (l) →CNO‒(aq) + Cr(OH)3 (s) + OH‒(aq)
A) 3,62
B) 4,00
C) 1,87
D) 2,94
la reazione è la seguente:
(in CN- il n.o. di C è +2 essendovi 3 legami con N (più elettronegativo di C quindi +3 -1 =2)
(in CNO- il n.o. di C è + 4 per i 2 legami che lo legano ad N e 2 legami che lo legano ad O N=C=O–
3[CN- + 2e + 2 OH- –> CNO- + H2O
2[CrO4-2 +3 e + 4H2O –> Cr+3 + 8 OH-
3CN- +2 CrO4-2 + 6 OH- + 8H2O –> 3 CNO- + 2 Cr+3 + 3 H2O + 16 OH-
3CN‒(aq) + 2CrO42‒(aq) + 5 H2O (l) → 3 CNO‒(aq) + 2 Cr(OH)3 (s) + 4 OH‒(aq)
quindi da 2 moli di Cr2O4-2 si ottengono 2 moli di Cr(OH)3 e da 4 moli se ne ottengono 4 di Cr(OH)3
risposta corretta B
36. Determinare la costante acida di un acido HA, il cui anione A‒forma un composto poco solubile con il metallo M+, conoscendo le costanti dei seguenti equilibri:
MA(S)+ H+(aq) → M+(aq) + HA (aq) K = 10‒8
MA(S)→ M+(aq) + A‒(aq) K = 10‒12
A) 10‒8
B) 10‒5
C) 10‒7
D) 10‒4
soluzione
se dividiamo le due equazioni abbiamo:
MA(S)+ H+(aq) → M+(aq) + HA (aq) / MA(S)→ M+(aq) + A‒(aq) = 10-8 / 10-12
H+ x A- –> HA K= 10-12/10-8 = 10-4
risposta corretta D
37. Si consideri il composto poco solubile M(OH)X (S) con costante di solubilità KS (si ricordi pKS = ‒ logKS).
Indicare i valori del logaritmo della solubilità per due valori di X.
x log (solubilità)
A B C D
1 pKs ‒ log2 ‒ 1/2 pKs 2 pKs pKs + 2
2 pKs ‒ log(4/3) ‒(1/3 pKs + 0,2) 0,5 (pKs)3 (pKs)3/4
A)A
B) B
C) C
D) D
soluzione
se X=1 allora Kps = [M+] [OH-] quindi se indichiamo con S la solubilità si avrà Kps= S2
da cui S= √kps =kps½ logS = 1/2 log Kps -logS = -1/2 logKps = -1/2 PKs
se x=2 allora kps= [M+2] [ OH-]2 da cui S (2S2) = Kps cioè 4S3 = Kps S = (Kps/4 )1/3
logS = 1/3 log Kps/4 -log S = -1/3 PKs /4 = -1/3 PKs + 1/3 log 4 -logS = -1/3 Pks + 0,2
Dai calcoli si evince che la risposta corretta è B
38. 3,0 moli di un composto di formula C2Hx reagiscono con ossigeno O2 (g) secondo la reazione:
C2Hx (g) + (2 + x/4) O2 (g) → 2 CO2 (g) + (x/2) H2O (g).
Sapendo che si producono 6,0 moli di acqua,determinare la formula del composto
A) C2H8
B) C2H6
C) C2H4
D) C2H2
soluzione
se si formano 6 di H2O devono esservi 12 atomi di idrogeno a sinistra della reazione per cui l’unica molecola in cui 3 moli forniscono 12 atomi di idrogeno è necessariamente C2H4
C2H4 (g) + (2 + 4/4) O2 (g) → 2 CO2 (g) + (4/2) H2O (g).
C2H4 (g) +3O2 (g) → 2 CO2 (g) + 2 H2O (g).
la reazione di 3 moli è:
3 C2H4 (g) +9 O2 (g) → 6 CO2 (g) + 6 H2O (g).
risposta corretta C
39. Il corpo di un uomo adulto di 65,0 kg contiene 5,00 L di sangue (densità = 1,05 g mL‒1), con una concentrazione di emoglobina del 15% in massa. Sapendo che 1,00 g di emoglobina può legare 1,34 mL di O2 (aq) a 273,15 K e 1,01 ∙105 Pa, calcolare il volume di O2 (aq) totale presente nel corpo in queste condizioni.
A) 1035 mL
B) 1090 mL
C) 1055 mL
D) 1005 mL
soluzione
Il peso di 5 litri di sangue con densità 1,05 g/mL 5000ml x 1,05 = 5250 g e l’emoglobina è il 15% di questa massa cioè 0,15 x 5250= 787,5 g
se 1 g lega 1,34 ml di O2 787 g ne legano X X = 1055 ml
Risposta corretta C
40. Quale dei seguenti alcani ha nella sua struttura un solo carbonio primario?

A) 1
B) 2
C) 3
D) 4
soluzione
un carbonio primario è un carbonio legato ad un solo altro atomo di C
Un carbonio secondario è un carbonio legato a 2 atomi di C
Un carbonio terziario è un carbonio legato a 3 atomi di C
la struttura 1 non possiede C primari la struttura 2 ne possiede 5 e la struttura 4 nepossiede 3; ciò detto si vede che solo la molecola n.4 ha un solo carbonio primario che è il CH3 (il metile del ciclopentano) in basso che termina la catena.
Risposta corretta D
Qui continuano i quesiti della classe A (41-60)
41. Indicare l’affermazione ERRATA:
A) il fluoro è l’elemento più elettronegativo della tavola periodica.
B) l’ossigeno è più elettronegativo dello zolfo.
C) il fluoro appartiene al gruppo 17 e i numeri di ossidazione che può assumere più comunemente sono
‒1, 0, +1, +3, +5, +7.
D) il cloro appartiene al gruppo 17 e i numeri di ossidazione che può assumere più comunemente sono
‒1, 0, +1, +3, +5, +7.
soluzione
la risposta A è corretta essendo il fluoro l’elemento più elettronegativo della tavola periodica degli elementi (3,98 D).
la risposta B è corretta in quanto nel gruppo l’elettronegatività diminuisce mentre aumenta solo lungo il periodo (S ha 2,59 D mentre l’O ha 3,44 D).
La risposta D è corretta in quanto il Cloro può assumere i n.o. -1,0,+1,+3,+5,+7 per es.NaCl,NaClO, NaClO2, NaClO3, NaClO4
La risposta C è errata in quanto, pur appartenendo al gruppo 17 può avere solo n.o.-1 es HF e +1 in F2O in quanto il fluoro non possiede orbitali d parzialmente occupati essendo al secondo periodo come invece avviene per il cloro.
La risposta corretta al quesito è C
42. Indicare il numero di ossidazione dell’azoto nel composto cloruro di nitrosile, di formula NOCl:
A) +1
B) +3
C) ‒1
D) 0
soluzione
Il numero di ossidazione n.o. è un numero che viene attribuito ad un atomo a seconda dell’elettronegatività dell’atomo a cui è legato seguendo le regole:
1- si attribuisce +1 per ogni legame che lo unisce ad un atomo più elettronegativo
2- si attribuisce -1 per ogni legame che lo unisce ad un atomo meno elettronegativo
3- si attribuisce 0 per ogni legame che lo unisce ad un atomo con uguale elettronegatività
la struttura di NOCl CLORURO DI NITROSILE è: Cl-N=O
essendo l’azoto legato ad 1 atomo di O più elettronegativo con 2 legami e con il cloro più elettronegativo con 1 legame, gli viene attribuito in questa molecola il n. di o. = 2+1 = 3
Risposta corretta B
43. Indicare il numero di ossidazione medio dello zolfo nel metabisolfito di sodio, di formula Na 2S2O5:
A) +2
B) ‒2
C) +4
D) 0
soluzione
Da questa struttura si evince che i 2 atomi di zolfo sono legati a 5 atomi di ossigeno, 3 con legami doppi e 2 con un solo legame. Quindi ai due atomi attribuiamo un n.o. parziale 8 .Ma essendo 2 gli atomi di S occorre dividere per 2 per ottenere il n.o. di ogni singolo atomo di S. Quindi il n.o. dello S in questa molecola è 8/2=4.
Un metodo più rapido per ottenere il n.o. dell’atomo centrale di composti ternari è moltiplicare il numero di atomi di O (in questo caso 5) per 2 (e si ottiene 10) poi si sottrae il numero di atomi di Na (che sono 2 e quindi 10-2=8) infine si divite per il numero di atomi centrali (che in questo caso sono 2).
Per es per ottenere il n.o. del Cr in K2Cr2O7 si moltiplica 7×2 =14 si sottrae 2 (numero di atomi di K) e si divide per 2 (numero di atomi di Cr) e si ha 6.
Ricordiamo che questo numero di ossidazione è riferito ad uno solo degli atomi centrali.
Risposta corretta al quesito C
44. Indicare la formula bruta dell’acido pirofosforico:
A) H3PO3
B) H3PO4
C) H4P2O7
D) HPO3
soluzione
L’acido pirofosforico, o acido difosforico, è un acido inorganico del fosforo, dove entrambi gli atomi di fosforo hanno stato di ossidazione + 5.

L’acido pirofosforico H4P2O7 è un acido tetraprotico con costante di prima dissociazione acida (Ka1) pari a 0,16: assai più elevata della prima costante di dissociazione dell’acido ortofosforico
L’acido pirofosforico H4P2O7 è ottenuto mediante disidratazione (rimozione di una molecola d’acqua) dell’ acido H3PO4:
- 2 H3PO4 ⇌ H4P2O7 + H2O
- L’acido pirofosforico può ulteriormente perdere H2O per formare l’anidride P2O5
La risposta corretta è C
45. Una bombola di ozono, allotropo dell’ossigeno di formula O3, ha un volume di 44,8 L e, alla temperatura di 273 K, il suo manometro segna una pressione interna di 20,0 bar. Indicare il numero di moli di atomi di ossigeno contenuti all’interno della bombola:
A) 6 mol
B) 40 mol
C) 80 mol
D) 120 mol
soluzione
Le moli possono essere calcolate dall’equazione generale di stato dei Gas PV=nRT
P= 20 bar
V= 44,8 L T=273 K
n= PV/RT = 20 x 44,8 / 0,0821 x 273 = 40 moli di O3
3 x 40 moli di ossigeno= 120 moli
risposta corretta D
46. Indicare la formula bruta dell’anidride fosforica:
A) PO3
B) P2O3
C) PO5
D) P2O5
soluzione
anidride fosforica significa che il fosforo possiede il suo massimo numero di ossidazione e si ottiene per riscaldamento. Si ottiene bruciando il fosforo con un eccesso di aria, in totale assenza di umidità:
4 P + 5 O₂ → 2P₂O₅
La sua formula in realtà è P4O10
Risposta corretta D
47. Indicare, tra i seguenti composti, l’anidride fluorica:
A) OF2
B) O2F2
C) O2F
D) HO2F
soluzione
il composto D non è un’anidride, il composto C non è stechiometricamente possibile, il composto O2F2 è il biossido di fluoro con struttura F-O-O-F come quella di H2O2.Si deduce che il composto OF2 è l’anidride fluorica.
risposta corretta A
48. Indicare le formule dei composti ionici che si formano quando il catione Ca2+ si lega agli anioni cloruro, solfato e fosfato:
A) CaCl2, CaSO4, Ca3(PO4)2
B) CaCl2, CaSO4, Ca2(PO4)3
C) CaCl, CaSO4, Ca3(PO4)2
D) CaCl2, Ca2SO4, Ca3(PO4)2
soluzione
le reazioni sono:
Ca+2 + 2 HCl–> CaCl2 +H2
Ca+2 +H2SO4 –> CaSO4 +H2
3Ca+2 + 2H3PO4 –> Ca3(PO4)2 + 3H2
si deduce che la risposta corretta è A
49. La molecola XeO2F2 presenta:
A) due legami doppi e due legami singoli
B) quattro legami singoli
C) un legame doppio e tre singoli
D) nessuna delle precedenti opzioni è corretta
soluzione
secondo la teoria VESPR la struttura è del tipo AX4E se ne deduce che è un bipiramide trigonale. Lo Xeno usa orbitali ibridi Sp3d e forma due legami doppi e due singoli.
La risposta corretta è A
50. I protoni, neutroni ed elettroni presenti nell’atomo di 32 16 S sono rispettivamente:
A) 16, 16, 32
B) 16, 32, 16
C) 16, 16, 16
D) 32, 16, 32
soluzione
il numero atomico che si trova in basso a sinistra ( in questo caso 16) rappresenta il numero di elettroni o di protoni mentre il numero di massa che si trova in alto (in questo caso 32) rappresenta la somma dei protoni + neutroni. Ciò detto, è chiaro che il numero di elettroni e di protoni è 16 ed il numero di neutroni è 32-16 =16 ed essendo il numero di protoni uguale a quello degli elettroni è chiaro che gli elettroni sono 16.
Risposta corretta C
51. L’energia di prima ionizzazione del fluoro è :
A) minore di quella del litio
B) maggiore di quella del He
C) minore di quella del cloro
D) maggiore di quella del silicio
soluzione
L’energia di ionizzazione è l’energia minima richiesta per allontanare un elettrone da un atomo o da una molecola e portarlo a distanza infinita, a 0 K e in condizioni di energia cinetica nulla.
X(g) → X+(g) + e− I1
essa diminuisce in un gruppo della tavola periodica ed aumenta in un periodo. Si evince quindi che il F ha energia di ionizzazione maggiore di quella del litio che si trova all’inizio del gruppo, è minore di quella dell’elio che appartiene al gruppo successivo, è maggiore di quella del cloro che è al di sotto nello stesso gruppo ed è maggiore di quella del Silicio che appartiene al gruppo 14 .
La risposta corretta è D
52. Indicare le coppie di ioni che hanno la stessa configurazione elettronica:
A) F‒e Na+; O2‒e Si4+
B) Na+ e Mg2+; Ca2+ e Be2+
C) F‒ e Cl‒; Br‒ e Cl‒
D) F‒e Na+; Si4+ e P3‒
soluzione
la configurazione di F- rispetto all’atomo F neutro ( [He] 2s22p5 ) contiene un elettrone in più quindi la struttura è:
F-= [He] 2s22p6
Il sodio Na rispetto all’atomo neutro ( [Ne] 3s1 ) ha un elettrone in meno quindi la struttura di Na+ è:
Na+= [Ne]
L’ossigeno O-2 ha 2 elettroni in più rispetto all’atomo neutro O ([He]2s22p4 ) quindi la struttura è :
O-2= [He]2s22p6
Si+4 possiede 4 elettroni in meno rispetto all’atomo neutro ([Ne] 3s23p2 ) quindi la struttura è:
Si+4= [Ne]
seguendo analogo procedimento per gli altri ioni si ha che le coppie di ioni che hanno la stessa configurazione elettronica sono: F‒e Na+; O2‒e Si4+
risposta corretta A
53. Individuare l’affermazione ERRATA:
A) molti metalli vengono ossidati dall’acido cloridrico. Durante questa reazione si riduce l’idrogeno.
B) i composti binari di un non metallo ed ossigeno sono detti anidridi
C) quando un acido reagisce con una base si ottiene un sale neutro
D) Per condizioni standard (STP) si intende una temperatura di 0 °C (273,15 K) e pressione di 1,00 bar (1,00 ·105Pa)
soluzione
le risposte corrette sono A,B,D
La risposta errata è la C in quanto NON SEMPRE da un acido ed una base si ottiene un sale NEUTRO.
Infatti si ottiene SEMPRE un sale ma può non essere neutro ad es NaOH + H3PO4 —> NaH2PO4 + H2O cioè si ottiene un sale acido e non neutro.
Inoltre, in caso di reazione di un acido debole con una base forte il risultato è un sale leggermente basico per la presenza della base coniugata dell’acido e naturalmente nella reazione tra acido forte e base debole si forma un sale leggermente acido per la presenza dell’acido coniugato della base.
54. Individuare l’affermazione CORRETTA:
A) il legame tra idrogeno e iodio in HI è più lungo del legame tra idrogeno e fluoro in HF
B) il legame tra ossigeno e cloro in HClO è meno forte del legame tra sodio e cloro in NaCl
C) il legame tra idrogeno e iodio in HI è più corto del legame tra idrogeno e cloro in HCl
D) il legame tra carbonio e ossigeno è più forte in CO2 che in CO
soluzione
La lunghezza di legame (o distanza di legame) rappresenta la distanza tra i nuclei di due atomi ed è un valore medio (perché gli atomi sono in perenne vibrazione, ciascuno attorno ad una sua posizione centrale di equilibrio).
- quanto più elettroni partecipano alla formazione del legame, tanto minore sarà la lunghezza di quest’ultimo;
- al diminuire della distanza di legame, aumenta l’energia di legame e le forze attrattive fra gli atomi;
- dipende dal tipo di ibridizzazione molecolare e dalla natura elettronica e sterica dei sostituenti;
- per la stessa coppia di atomi, il legame triplo è più corto del doppio, il quale è più corto del legame semplice;
- in un legame covalente omopolare la metà della distanza di legame è uguale al raggio covalente
Nel caso specifico, il Fluoro è più elettronegativo dello Iodio quindi il legame di HF è più breve del legame HI quindi questo è anche più grande di HCl.
La risposta corretta è A
55. L’oganesson è l’ultimo elemento dell’odierna tavola periodica. Ha numero atomico Z = 118. Indicare la configurazione elettronica di questo elemento.
A) [Rn] 4f14 5d10 7s2 7p6
B) [Rn] 5f14 6d10 7s2 7p4
C) [Rn] 5f14 6d10 7s2 7p5
D) [Rn] 5f14 6d10 7s2 7p6
soluzione
1s2 2s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p6 5f14 6d10 7s2 7p6
che corrisponde a [Rn]5f14 6d10 7s2 7p6
risposta corretta D
56. In un recipiente dal volume di 0,8 m3 ,precedentemente evacuato, venne immessa aria fino a raggiungere un contenuto di ossigeno di 5 moli, raggiungendo la pressione di 1,00 ∙105 Pa. Qual era, circa, la temperatura nel recipiente?
A) 325 K
B) 385 K
C) 305 K
D) 265 K
soluzione
I m3 è 1000 litri quindi il volume è 0,8 x 1000 = 800 L ma l’ossigeno è il 20,9 % quindi il volume di O è
800 x 0,209= 167,2 litri pertanto
la pressione corrisponde a 0,986 atmosfere quindi essendo PV=nRT 0,986 x 167,2= 5 x 0,0821 x T
T= 164 / 0,41 = 400
la temperatura è quindi circa 385
risposta corretta B
57. Il sistema A non è all’equilibrio termico con il sistema B ed il sistema B non è all’equilibrio termico con il sistema C. Di conseguenza:
A) la temperatura del sistema A è necessariamente diversa da quella del sistema C
B) la temperatura del sistema A è necessariamente uguale a quella del sistema C
C) la temperatura del sistema A può essere uguale a quella del sistema C
D) nessuna delle precedenti opzioni è corretta
soluzione
Anche se A è diverso da C tuttavia può,teoricamente, essere uguale a C infatti Ta ≠ Tb e Tb≠ Tc
è chiaro che Ta può essere uguale a Tc
Risposta corretta C
58. Calcolare il pH di una soluzione ottenuta mescolando volumi uguali di una soluzione 0,1 M di HCl e di una soluzione 0,1 M di CH3COONa.
A) 3,0
B) 4,5
C) 6,9
D) 5,7
soluzione
dai dati si osserva che HCl trasforma tutto il sale in CH3COOH quindi il PH da calcolare è quello di un acido debole
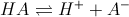
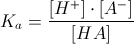
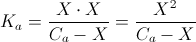
√essendo X trascurabile rispetto a Ca si ha : [H+]= √Ka x Ca
La Ca risulta diluita della metà a causa del mescolamento per cui Ca= 0,05 pertanto
[H+]= √1,8 x 10-5 x 5 x 10-2 = 9,9 x 10-4 moli/L
PH= 4-log 9,9 =3,01
risposta corretta A
59. Un individuo assume ogni giorno 2,00 L di acqua con un contenuto di As(V) pari a 6,5 μg/L. Quanti milligrammi di As(V) vengono assunti in 2 anni (considerando l’anno di 365 giorni)?
A) 4,3
B) 5,7
C) 9,5
D) 7,1
soluzione
In 2 litri vi sono 6,5×2 =13 μg che vengono assunti in 1 giorno. In 2 anni cioè in 365 x 2 = 730 gg vengono assunti 730 x 13= 9490 μg di As(V) .Poichè un μg corrisponde a 10-3 mg allora vengono assunti 9,490 mg
risposta corretta A
60. Calcolare la percentuale in massa di NaBr di una soluzione ottenuta mescolando 35 g di una soluzione al 18% in massa di NaBr con 15 g di una soluzione al 22% in massa di NaBr.
A) 20,5
B) 21,9
C) 19,2
D) 21,0
soluzione
in 35 g di una soluzione al 18% vi sono 0,18 x 35 = 6.3 g di NaBr
in 15 g di una soluzione al 22% vi sono 0,22 x 15 = 3,3 g di NaBr
in totale vi sono 9,6 g di NaBr su un totale di 35+15 g di sostanza quindi se in 50 g vi sono 9,6 g in 100 ve ne sono 19,2 %
risposta corretta C
Qui continuano i quesiti della classe B (41-60)
41. Indicare i coefficienti stechiometrici (in ordine sparso) necessari per bilanciare la seguente reazione:
As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO
A) 1, 2, 3, 8, 10, 16
B) 3, 4, 6, 9, 28, 28
C) 3, 6, 6, 9, 16, 18
D) 3, 6, 9, 16, 32, 32
soluzione
3[2As+3 +8H2O + – –> 2 AsO4-3 + 16 H+ +4e
3[3 S-2 +12 H2O —-> 3 SO4-2 + 24 e + 24 H+
As2S3 + 20H2O —->2AsO4(3-) + 3SO4(2-) + 40H(+) +28e
queste due reazioni rappresentano nell’insieme la prima delle reazioni cioè l’ossidazione, ed insieme scambiano 28 elettroni con la seconda che fornisce alla prima 3 elettroni:
3[ As2S3 + 20H2O —->2AsO4(3-) + 3SO4(2-) + 40H(+) +28e
28[NO3- +4H+ + 3e —-> NO + 2H2O
3As2S3+ 28 NO3- + 60 H2O + 112 H+ —> 6 AsO4-3 + 9 SO4-2 +28 NO + 56 H2O + 120 H+
semplificando
3As2S3+ 28 NO3- + 4 H2O —> 6 AsO4-3 + 9 SO4-2 +28 NO +8H+
la reazione bilanciata è quindi
3 As2S3 + 28 HNO3 + 4 H2O = 6 H3AsO4 + 9 H2SO4 + 28 NO
i coefficienti sono 3,4,6,9,28,28
risposta corretta B
42. Individuare la terna di molecole che NON hanno una geometria planare secondo la teoria VSEPR:
A) HCN, NH3, PCl5
B) O3, SF6, PCl5
C) SO3, XeF4, SF6
D) nessuna delle precedenti opzioni è corretta
soluzione
HCN è planare ma nè NH3 eche PCl5 lo sono. O3 non è planare così come SF6. SO3 ha struttura AX3E in cui E=0
quindi è trigonale planare XeF4 è del tipo AX4E2 quindi è planare quadrata ma SF6 ha struttura ottaedrica
In nessuna delle terne indicate vi sono tutte e tre le molecole planari quindi la risposta corretta è D
43. Secondo la teoria VSEPR, la geometria del tetrafluoruro di zolfo è:
A) ad altalena
B) tetraedrica
C) planare quadrata
D) a bipiramide trigonale
soluzione
La struttura di SF4, secondo la teoria VESPR, la forma della molecola è ad altalena, con S al centro. La coppia di elettroni non condivisa occupa una posizione equatoriale. Nella molecola sono presenti due tipi diversi di leganti F: due F sono assiali e due sono equatoriali

e gli atomi di F sono interscambiabili.
Risposta corretta A
44. Un campione sottoposto ad analisi elementare risulta composto da: 28,32% di K; 34,77% di O; 36,90% di V in massa. Indicare la formula compatibile con tale analisi:
A) KVO3
B) K3V5O14
C) K3VO4
D) K6V10O28
soluzione
dividiamo ogni percentuale per il rispettivo peso atomi ed otteniamo i grammoatomi:
28,32/ 39= 0,726 K 34,77 /16 = 2,17 O 36,9 /50,94 =0,724
dividiamo per il numero più piccolo ed abbiamo
K=1 O= 3,0 V=1
si deduce che la formula minima è KVO3
risposta corretta A
45. Partendo da 34,0 g di idrossido di alluminio si ottengono 41,8 g di solfato di alluminio secondo la seguente reazione (da bilanciare):
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Indicare la resa teorica del solfato e la resa percentuale
della reazione.
A) 74,6 g; 56,0%
B) 74,6 g; 28,0%
C) 149 g; 28,0%
D) 149 g; 56,0%
soluzione
la reazione bilanciata è : 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
da 2 moli di Al(OH)3 si ottiene 1 mole di Al2(SO4)3 quindi 34/78= moli di idrossido=0,435 moli
moli di Solfato Al2(SO4)3 = 41,8/342,1 = 0,122 moli
se da 156 g si ottengono 342,1 da 34 se ne dovrebbero ottenere X X = 34×342,1/156= 74,56 g e questa è la resa teorica (la quantità massima di un prodotto ottenibile da una certa quantità di reattivo secondo la reazione )
La resa percentuale si ottiene ricordando che se da 156 g se ne dovrebbero ottenere 342,1 g da 34 grammi se ne dovrebbero ottenere in teoria 74,6 g. Tuttavia, siccome in realtà se ne ottengono 41,8 g allora
74,6:41,8 =100 :X X = 56,0%
risposta corretta A
46. Due sostanze hanno formula rispettivamente Cu5FeS4 e Cu2S. Indicare quale tra queste affermazioni è corretta.
A) le due sostanze contengono la stessa percentuale in massa di rame
B) la percentuale in massa di rame è maggiore in Cu5FeS4
C) la percentuale in massa di rame è maggiore in Cu2S
D) la percentuale in massa di rame in Cu5FeS4 è 2,5 volte quella di Cu2S
soluzione
se in Cu5FeS4(bornite) pm 501,84 vi sono 5 Cu (5 x 63,55) in 100 ve ne sono X X= 63,31 %
se in Cu2S (159,16) vi sono 2 x 63,55 = 100 : X X = 79,8 %
la risposta corretta è C
47. Dovendo preparare 0,50 L di una soluzione di cloruro di sodio isotonica rispetto al sangue, quante moli di cloruro di sodio bisogna utilizzare? La pressione osmotica del sangue è 7,75 ∙105 Pa.
A) 0,075 mol
B) 0,20 mol
C) 0,15 mol
D) 0,30 mol
soluzione
Una soluzione può avere una pressione osmotica inferiore, uguale o maggiore a quella con cui la si paragona. Si dice allora che la soluzione è, rispettivamente, ipotonica, isotonica o ipertonica rispetto a quella a cui la si paragona.In questo caso la soluzione di NaCl deve avere una pressione osmotica pari a 7,5 x 105Pa che è la pressione osmotica del sangue.La pressione osmotica che( che è ina proprietà colligativa cioè che dipende dal numero di particelle presenti) si indica con π e per un non elettrolita è π =nRT/V, mentre nel caso di un elettrolita è necessario moltiplicare il secondo membro per il coefficiente di Van’t Hoff che si indica con i, ottenendo l’equazione di Van’t Hoff π =nRT/V x i ( i rappresenta il numero di particelle che si hanno in soluzione ad es per NaCl i=2 per CaCl2 i=3). Pertanto se operiamo a temperatura ambiente di 25 gradi C avremo 7,75 x 105 = n( 8314 x298/0,5) x 2
nx 2 = 775000 / 4955740
da cui n= 0,078 moli
48. Un gas monoatomico ideale, contenuto in un recipiente adiabatico delimitato da una parete scorrevole, viene compresso irreversibilmente da 2,0 m3 a 1,5 m3 contro una pressione esterna costante di 1,00 ∙105Pa. Durante il processo, il gas si riscalda di 50 K. Quante sono, circa, le moli di gas contenute nel recipiente?
A) 100
B) 30
C) 80
D 10
soluzione
ΔT=50 K ΔV= 0,5 L P= 1,05 x 105 Pa
Dal primo principio della termodinamica sappiamo che ΔΕ = Q -L dove L = lavoro = PΔV
In una trasformazione adiabatica non vi è scambio di calore con l’esterno per cui Q=0 e quindi ΔΕ = -L .
Il gas monoatomico in esame è sottoposto ad una compressione che ne determina una diminuzione di volume ed il calore prodotto viene utilizzato esclusivamente per aumentare l’energia cinetica del gas che si riflette in un aumento di temperatura. La ΔΕ quindi dipende dal calore specifico del gas, dalla sua quantità in moli e dalla differenza di temperatura prodotta per effetto del lavoro L compiuto ΔΕ= nCvΔT.
Abbiamo quindi che ΔΕ= nCvΔT e ΔΕ = PΔV essendo il lavoro svolto sul sistema.
Possiamo pertanto scrivere :
n CvΔT = PΔV
ma per un gas monoatomico e Cv= 3/2R dove R è la costante dei gas (ciò dipende dal fatto che il sistema ha 3 gradi di libertà ognuno dei quali assorbe energia pari ad 1/2 R ) , In definitiva
n Cv ΔT = PΔV
n = PΔV / Cv ΔT n= 1 x 105 x 0,5 / 12,471 x 50 = 50000/623,55 = 80,1 moli
Risposta corretta C
49. Si consideri la reazione in cui il composto AB2 reagisce per formare AB e B2. In determinate condizioni, la velocità con cui si produce AB è 9,0 ∙10‒3 mol/dm3 s. La velocità con cui si produce B2 è:
A) 1,8 10‒2 mol dm‒3s‒1
B) 4,5 10‒3 mol dm‒3s‒1
C) 9,0 10‒3 mol dm‒3s‒1
D) 9,0 10‒2 mol dm‒3s‒1
soluzione
la reazione è 2AB –> 2AB +B2 si deduce che la velocità di formazione di B2 è la metà di quella di AB
pertanto VB2 = 9,0 x 10-3 /2 = 4,5 x 10-3
risposta corretta B
50. Si sta studiando una reazione del tipo A → Prodotti. Si osserva sperimentalmente che il tempo di dimezzamento della concentrazione di A si riduce della metà se la concentrazione iniziale di A raddoppia. Qual è l’ordine di tale reazione?
A) secondo ordine
B) ordine zero
C) primo ordine
D) nessuna delle precedenti opzioni è corretta
soluzione
Per una reazione A ⇐⇒ prodotti
se V (la velocità di una reazione) aumenta proporzionalmente al crescere della concentrazione [A] del reagente , si dice che la reazione è del primo ordine rispetto ad A (dire che aumenta proporzionalmente significa che, se raddoppio la concentrazione, raddoppia anche la velocità; che se si riduce [A] a 1/3, si riduce a 1/3 anche la velocità); la costante di velocità k è del I° ordine ed è data dalla pendenza della retta v = K C.
Pertanto per la reazione A → prodotti
V = K [A] = -d[A]/dt da cui -d[A]/[A] = Kdt
Cioè il rapporto tra la variazione della concentrazione del reagente A, indicata dal termine d[A], rispetto alla sua concentrazione attuale (cioè nel momento che consideriamo), indicata dal termine [A], è costante se si considerano intervalli di tempo costanti; che è quanto appare dal grafico b.
Le dimensioni di K in questo caso (I° ordine): K (sec-1), poiché è K = -d[A]/[A] dt. (il rapporto di concentrazioni non ha dimensioni; resta solo il tempo al denominatore, perciò i sec sono elevati a -1).
il tempo di dimezzamento t1/2 è il tempo necessario perché la concentrazione iniziale di un reagente sia ridotta a metà.
Se integriamo l’equazione differenziale vista prima, avremo che
ln [A]/[A]0 = -K (t-t0)
(ln = logaritmo naturale) e se in questa poniamo [A] = 1/2 [A]0, (se vogliamo cioè che la concentrazione sia la metà dell’iniziale, come definito per il tempo di dimezzamento), e dato che t0 = 0 (inizio della reazione), avremo:
ln [A]/([A]0 /2)= -K (t-t0) ln2 = K t1/2 t1/2 = 0.693/k
Come si vede dalla formula, per le reazioni del primo ordine t1/2 non dipende dalla concentrazione del reagente.
In una reazione del II° ordine :
2 A ® prodotti
V = K [A]2 = -d[A]/dt da cui -d[A]/[A]2 = K dt
Se integriamo questa equazione differenziale otteniamo che

K è espressa in (sec-1 mol-1 dm3)
Una reazione del secondo ordine può essere anche del tipo :
A + B ® prodotti
V = K [A] [B] = -d[A]/dt = -d[B]/dt
Il tempo di dimezzamento in questo caso è :
A + B ® prodotti
V = K [A] [B] = -d[A]/dt = -d[B]/dt
T½ = 1/K[A]
In una reazione di Ordine Zero la velocità di reazione si mantiene costante per tutta la durata del processo.
dc/dt = v = costante
c1 – c2 = k (t2 – t1)
t½ = c1/2 k se poniamo c2 = c1/2,
Tipiche reazioni di ordine zero sono attivate dalla radiazione ultravioletta: la decomposizione della vitamina B12, la trasformazione dell’ergosterolo in vitamina D2, la trasformazione del 7-deidrocolesterolo in vitamina D3.
In questi casi, è evidente che la velocità di reazione non è legata alla quantità di substrato reattivo, bensì al fatto che l’energia luminosa abbia associata l’energia necessaria per attivare la reazione.
Riepilogando, per una reazione di :
Ordine zero: t1/2 =[ A]o /2k
Ordine I: t1/2 = ln2 /k=0.693/k
Ordine II: t1/2 = 1 /k[A]o
Poichè il quesito ci indica che il tempo di dimezzamento diminuisce se [A]0 raddoppia è evidente che la reazione è del II° Ordine
risposta corretta A
51. L’equilibrio di una reazione chimica si sposta a sinistra (verso i reagenti) se la temperatura diminuisce.
Si può quindi concludere che:
A) la reazione ha un ∆H minore di zero
B) la reazione è endotermica
C) la reazione è esotermica
D) non si può trarre alcuna conclusione in assenza di dati aggiuntivi
soluzione
A pressione costante, il calore di reazione si chiama entalpia di reazione (H) e la variazione di entalpia (ΔH) è la quantità di calore assorbito o liberato da una reazione senza variazione di pressione.
ΔHreazione = ΣHprodotti – ΣHreagenti
Se ΔH < 0 la reazione è esotermica, cioè libera calore il che significa che i prodotti possiedono una entalpia H minore di quella dei reagenti
Se ΔH > 0 la reazione è endotermica, cioè assorbe calore dall’ambiente, che si raffredda.
In una reazione A+B–>C + q cioè in una reazione esotermica la sottrazione di calore sposta la reazione verso i prodotti (infatti q deve essere ritenuto come un prodotto di reazione se diminuisce la reazione si sposta a destra) Se Invece la reazione è endotermica cioè a + B –>C + -q
la sottrazione di calore la sposta verso i reagenti perchè aumenta -q.
Al contrario se forniamo calore ad una reazione esotermica favoriamo la reazione indiretta mentre se forniamo calore ad una reazione endotermica favoriamo la reazione nel senso della formazione dei prodotti.
risposta corretta B
52. Calcolare il pH di una soluzione di HF 0,1 M a cui si aggiungono 4,0 g di NaOH solido per litro di soluzione.
A) 13,0
B) 9,8
C) 8,1
D) 7,5
soluzione
L’HF è un acido debole perchè ha il raggio atomico molto piccolo, ciò porta ad avere gli elettroni su orbitali molto ravvicinati tra di loro. In qualità di acido deve accettare un doppietto elettronico per cedere il protone e trasformarsi in anione F-. Qui entrano in gioco le forze repulsive degli orbitali di valenza (2s e 2p), così elevate che F- cede elettroni per legarsi al protone e riformare l’acido spostando quindi l’equilibrio verso i reagenti:
HF + NaOH–> NaF+ H2O
La concentrazione di HF =0,1 M e la concentrazione di NaOH è 4/40=0,1M
essendo le concentrazioni di acido e di base uguali tutto l’acido è trasformato in sale che a questo punto subisce idrolisi
il PH di idrolisi di un sale di acido debole e base forte la cui concentrazione nel caso nostro è Cs=0,1 è
Dalle tavole si ha un Ka pari a 7,2 x 10-4 per cui
[OH-]=√(Kw/Ka ) Cs = √( 10-14 / 7,2 x 10-4) x 0,1 =√0,13x 10-11 = 1,14 x 10-6
POH = -log [OH-]= -log 1,14 x 10-6 = 6-log 1,14 = 5,94 poichè PH+POH =14 il PH = 14-5,94 = 8,1
risposta corretta C
53. Una soluzione contiene Cd(NO3)2 0,1 M. Si intende recuperare Cd2+ trasformandolo in Cd (s),
mediante reazione con una lamina di metallo M (s):
Cd2+ + M (s) → Cd (s) + M2+
Considerando la tabella dei potenziali redox, quale metallo deve essere immerso nella soluzione?
A) Zn;
B) Sn;
C) Cu;
D) Co,
soluzione
dalla tabella dei potenziali standard
E° cd = -0,403 V E° Sn= -0,14 V E° Zn =-0,763 V E°Co= 1,82 V E°Cu= 0,337 V
sappiamo che l’elemento che possiede un E° più negativo (o meno positivo) agisce da riducente mentre un elemento con E° positivo (o più positivo) agisce come ossidante.
Per tale motivo l’elemento da usare per la riduzione del cadmio è lo Zinco che ha un E° pari a
Zn =-0,763 V che è più negativo di E° di Cd
Risposta corretta A
54. Una soluzione incognita contenente un catione è posta in quattro becher. Si effettuano le seguenti aggiunte:
Considerando la tabella delle costanti di solubilità, indicare il catione presente nella soluzione.

A) Ca2+
B) Zn2+
C) Ba2+
D) Sr+3
soluzione
i dati di solubilità dei vari sali sono calcolabili dai rispettivi valori di Kps infatti S= √kps e ne risulta il quadro seguente:
solubilità carbonato solfuro solfato nitrato
Ca2+ poco solubile molto solubile poco solubile completamente solubile
Zn2+ poco solubile insolubile solubile solubile
Ba2+ poco solubile molto solubile poco solubile solubile
Sr+3 poco solubile solubile poco solubile solubile
da questi dati si evince che tutti gli ioni in esame formano il rispettivo carbonato,ma solo lo Zinco può precipitare come carbonato e solfuro e non precipita come solfato e nitrato.
55- 52,3 g di un minerale contenente CeO2 riscaldati a 1500 K, formano 0,014 moli di O2 (g) secondo la reazione (da bilanciare):
CeO2 (s) → Ce2O3 (s) + O2 (g)
Calcolare la % in massa di Ce nel minerale.
A) 15,0%;
B) 21,7%;
C) 38,9%;
D) 41,8%.
soluzione
la reazione bilanciata è:
4CeO2 (s) → 2Ce2O3 (s) + O2 (g)
poichè da 4 moli di CeO2 si ottiene 1 mole di O2 da X moli si ottengono 0,014 moli di O2 cioè 0,448 g O2
I grammi di CeO2 possono essere calcoati dalla proporzione:
se in 4 x 172 di CeO2 vi sono 32 g di Ossigeno allora in X grammi ve ne sono 0,448
4 x172 : 32 = X : 0,448 X=g CeO2 =9,6 g
otteniamo adesso la quantità di Ce in 9,6 g di composto utilizzando la proporzione
se in 172 g vi sono 140 g di Ce in 9,6 ve ne sono X
172: 140=9,6 :X X= 7,8 g di Ce
Per calcolare la percentuale nel campione iniziale di 52,3 g utilizziamo la proporzione
52,3 :7,8 =100 :X X= 14,96%= 15%
risposta corretta A
56. Determinare la costante di ionizzazione di un acido debole HA sapendo che, aggiungendo 50 mL di una soluzione 0,1 M di NaOH a 50 mL di una soluzione 0,2 M di HA, si ottiene una soluzione con pH 4,5.
A) 6,8 ∙10‒7
B) 3,2 ∙10‒5
C) 8,4 ∙10‒3
D) 5,2 ∙10‒8
soluzione
le mmoli NaOH sono 50 x 0,1 =5 mmoli
le mmoli HA sono 50 x 0,2 = 10 mmoli
quindi 5 mmoli formano il sale la cui concentrazione è 5 /100 =0,05 che in 1000 sono 0,5 M
rimangono 5 mmoli di acido 5/100 = 0,05 cioè 0,5 M quindi Ca=Cs
essendo il sale in presenza dell’acido si ha una miscela tampone il cui
[H+]= Ka Ca/Cs PH = PKa log Ca/Cs Ma in questo caso Ca=Cs quindi log Ca/Cs=0
P[H+]= PKa
[H+]= 10-4,5 = Ka
Ka = 3,16 x 10-5
risposta corretta B
57. Determinare quante moli di Fe (s) sono necessarie per ridurre 2 moli di nitrobenzene, secondo la reazione
(da bilanciare):
C6H5NO2 (aq) + Fe (s) + H+(aq) → C6H5NH3 +(aq) + Fe2+(aq) + 2 H2O (aq)
A) 4,87
B) 3,21
C) 6,00
D) 9,11
6[Fe –> Fe+2 +2e
2[C6H5NO2 (aq) +6e + 4H+ –> C6H5NH3 +(aq) + 2H2O
_________________________________________________
6Fe + 2 C6H5NO2 +8H+ —> 2 C6H5NH3 + 6 Fe+2 +4H2O
per ridurre 2 moli di nitrobenzene servono 6 moli di Fe
risposta corretta C
58. Quale andamento del pH in funzione del volume di titolante si verifica nella titolazione di una soluzione
di NH3(aq) con HCl?

soluzione
NH3 acquoso forma NH4OH che in presenza iniziale di HCl forma NH4Cl e si forma un tampone ed il PH diminuisce gradualmente. Man mano che si aggiunge HCl si arriverà al punto in cui tutto NH4OH è trasformato in NH4Cl ed il PH sarè quello derivante dall’idrolisi del sale formato da una base debole ed un acido forte. Ulteriori aggiunte di HCl fanno diminuire il PH rapidamente.
Da quanto sopra si evince che il grafico A è quello corretto in quanto quello D si riferisce alla titolazione di una base forte con un acido forte:
Risposta corretta A
59. I bromo-alcossidi di formula generale
Br‒CH2(CH2)nCH2O-
possono reagire secondo un meccanismo SN2 dando una reazione intermolecolare o intramolecolare. La resa delle due reazioni in competizione è dipendente dalla concentrazione del reagente bifunzionale e dalle dimensioni del ciclo che si può formare. Individuare quale delle seguenti affermazioni è vera:
A) una bassa concentrazione di reagente favorisce la reazione intramolecolare
B) un’alta concentrazione del reagente inibisce la reazione intermolecolare
C) la formazione di cicli a sei termini favorisce la reazione intermolecolare
D) la formazione di cicli a quattro termini favorisce la reazione intramolecolare
soluzione
Reazioni intramolecolari
una reazione di condensazione intramolecolare avviene tra due gruppi funzionali presenti nella stessa molecola dando spesso luogo alla ciclizzazione con eliminazione di una molecola a basso peso molecolare.
Quando sia l’anione enolato che il Br del bromoalcossidpo sono presenti sulla stessa molecola, la reazione con un’altra molecola può portare sia ad una reazione di addizione tra 2 molecole sia alla formazione di una molecola ciclica. Questo tipo di reazione è particolarmente utile per la formazione di anelli a 5 o 6 termini poiché questi sono quelli più stabili. Più alta è la concentrazione di reattivo maggiore sarà la probabilità di reazione tra due molecole (reazione intermolecolare), mentre minore è la concentrazione del reagente maggiore è la possibilità che si formi una molecola ciclica cioè che si abbia una reazione intramolecolare.
la risposta corretta è A
60. Individuare quale delle quattro molecole riportate sotto rappresenta il prodotto della seguente serie di reazioni:

A) 1
B) 2
C) 3
D) 4
soluzione
La prima reazione è una friedel-craft che introduce nel benzene il gruppo CH3-CH2 – la successiva solfonazione è utilizzata per formare un intermedio che orienti in para il gruppo che dovrè entrare con la reazione con l’anidride acetica cioè CH3CO la terza reazione è un’idrolisi acida che elimina il gruppo SO3H- dal benzene pertanto il prodotto finale è il n. 2

Risposta corretta B


Lascia un commento