1. Indicare i coefficienti stechiometrici (in ordine sparso) necessari per bilanciare la seguente reazione:
As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO
A) 1, 2, 3, 8, 10, 16
B) 3, 4, 6, 9, 28, 28
C) 3, 6, 6, 9, 16, 18
D) 3, 6, 9, 16, 32, 32
soluzione
le reazioni redox sono:
3[2As+3 +8H2O + – –> 2 AsO4-3 + 16 H+ +4e
3[3 S-2 +12 H2O —-> 3 SO4-2 + 24 e + 24 H+
As2S3 + 20H2O —->2AsO4(3-) + 3SO4(2-) + 40H(+) +28e
queste due reazioni rappresentano nell’insieme la prima delle reazioni cioè l’ossidazione e insieme scambiano 28 elettroni con la seconda che fornisce alla prima 3 elettroni:
3[ As2S3 + 20H2O —->2AsO4(3-) + 3SO4(2-) + 40H(+) +28e
28[NO3- +4H+ + 3e —-> NO + 2H2O
3As2S3+ 28 NO3- + 60 H2O + 112 H+ —> 6 AsO4-3 + 9 SO4-2 +28 NO + 56 H2O + 120 H+
semplificando
3As2S3+ 28 NO3- + 4 H2O —> 6 AsO4-3 + 9 SO4-2 +28 NO +8H+
la reazione bilanciata è quindi
3 As2S3 + 28 HNO3 + 4 H2O = 6 H3AsO4 + 9 H2SO4 + 28 NO
risposta corretta B
2. Individuare la terna di molecole che NON hanno una geometria planare secondo la teoria VSEPR:
A) HCN, NH3, PCl5
B) O3, SF6, PCl5
C) SO3, XeF4, SF6
D) nessuna delle precedenti opzioni è corretta
soluzione
HCN è planare ma nè NH3 eche PCl5 lo sono. O3 non è planare così come SF6. SO3 ha struttura AX3E in cui E=0 quindi la sua struttura è trigonale planare. XeF4 è del tipo AX4E2 quindi è planare quadrata ma SF6 ha struttura ottaedrica
In nessuna delle terne indicate vi sono tutte e tre le molecole planari quindi la risposta corretta è D
3. Secondo la teoria VSEPR, la geometria del tetrafluoruro di zolfo è:
A) ad altalena
B) tetraedrica
C) planare quadrata
D) a bipiramide trigonale
soluzione
La struttura di SF4, secondo la teoria VESPR, poichè lo zolfo possiede un doppietto elettronico libero è del tipo AX4E quindi ha una struttura a bipiramide trigonale con S al centro del triangolo formato dai due atomi di F e dalla coppia di elettroni di non legame. La coppia di elettroni non condivisa che si trova sullo zolfo occupa una posizione equatoriale per cui i due atomi di F che sono sullo stesso piano si allontanano l’un l’altro formando angoli superiori a 120° dando alla molecola un aspetto simile ad un’altalena, Nella molecola sono presenti pertanto due tipi diversi di leganti F: due F sono assiali e due sono equatoriali

e gli atomi di F sono interscambiabili nel senso che scambiano le posizioni da equatoriale ad assiale e viceversa. Si evince che la risposta corretta è A
4. Un campione sottoposto ad analisi elementare risulta composto da: 28,32% di K; 34,77% di O; 36,90% di V in massa. Indicare la formula compatibile con tale analisi:
A) KVO3
B) K3V5O14
C) K3VO4
D) K6V10O28
soluzione
Per calcolare i rapporti elementari tra gli atomi dividiamo la percentuale di ogni atomo per il rispettivo peso atomico ed otteniamo i grammoatomi:
28,32/ 39= 0,726 K 34,77 /16 = 2,17 O 36,9 /50,94 =0,724
dividiamo per il numero più piccolo ed abbiamo
K=1 O= 3,0 V=1
si deduce che la formula minima è del composto è KVO3
Risposta corretta A
5. Partendo da 34,0 g di idrossido di alluminio si ottengono 41,8 g di solfato di alluminio secondo la seguente reazione (da bilanciare):
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Indicare la resa teorica del solfato e la resa percentuale
della reazione.
A) 74,6 g; 56,0%
B) 74,6 g; 28,0%
C) 149 g; 28,0%
D) 149 g; 56,0%
soluzione
la reazione bilanciata è : 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
da 2 moli di Al(OH)3 si ottiene 1 mole di Al2(SO4)3 quindi
da 34/78= 0,435 moli di idrossido si ottengono secondo la reazione scritta sopra, 41,8/342,1 = 0,122 moli di Solfato Al2(SO4)3
In teoria però se da 156 g di idrossido si ottengono 342,1 di solfato, da 34 se ne dovrebbero ottenere X X = 34×342,1/156= 74,56 g e questa è la resa teorica cioè la quantità massima ottenibile dal reattivo secondo la reazione data.
La resa percentuale si ottiene ricordando che se da 156 g se ne dovrebbero ottenere 342,1 g da 34 grammi se ne dovrebbero ottenere in teoria 74,6 g. Tuttavia, siccome in realtà se ne ottengono 41,8 g allora
74,6:41,8 =100 :X X = 56,0%
La resa reale in percentuale è quindi 56%
risposta corretta A
6. Due sostanze hanno formula rispettivamente Cu5FeS4 e Cu2S. Indicare quale tra queste affermazioni è corretta.
A) le due sostanze contengono la stessa percentuale in massa di rame
B) la percentuale in massa di rame è maggiore in Cu5FeS4
C) la percentuale in massa di rame è maggiore in Cu2S
D) la percentuale in massa di rame in Cu5FeS4 è 2,5 volte quella di Cu2S
soluzione
Per calcolare la % di rame nei due composti è sufficiente ricorrere alla proporzione:
se in Cu5FeS4(bornite PM= 501,84) vi sono 5 Cu (5 x 63,55) in 100 ve ne sono X X= 63,31 %
se in Cu2S (PM= 159,16) vi sono 2 x 63,55 = 100 : X X = 79,8 %
la risposta corretta è C
7. Dovendo preparare 0,50 L di una soluzione di cloruro di sodio isotonica rispetto al sangue, quante moli di cloruro di sodio bisogna utilizzare? La pressione osmotica del sangue è 7,75 ∙105 Pa.
A) 0,075 mol
B) 0,20 mol
C) 0,15 mol
D) 0,30 mol
soluzione
Una soluzione può avere una pressione osmotica inferiore, uguale o maggiore a quella con cui la si paragona. Si dice allora che la soluzione è, rispettivamente, ipotonica, isotonica o ipertonica rispetto a quella a cui la si paragona.In questo caso la soluzione di NaCl deve avere una pressione osmotica pari a 7,5 x 105Pa che è la pressione osmotica del sangue.La pressione osmotica ( una proprietà colligativa cioè che dipende dal numero di particelle presenti) si indica con π e per un non elettrolita è π =nRT/V, mentre nel caso di un elettrolita è necessario moltiplicare il secondo membro per il coefficiente di Van’t Hoff che si indica con i, ottenendo l’equazione di Van’t Hoff π =nRT/V x i ( i rappresenta il numero di particelle che si hanno in soluzione ad es per NaCl i=2 per CaCl2 i=3).
Pertanto se operiamo a temperatura ambiente di 25 gradi C avremo 7,75 x 105 = n( 8314 x298/0,5) x 2
nx 2 = 775000 / 4955740
da cui n= 0,078 moli
8. Un gas monoatomico ideale, contenuto in un recipiente adiabatico delimitato da una parete scorrevole, viene compresso irreversibilmente da 2,0 m3 a 1,5 m3 contro una pressione esterna costante di 1,00 ∙105Pa. Durante il processo, il gas si riscalda di 50 K. Quante sono, circa, le moli di gas contenute nel recipiente?
A) 100
B) 30
C) 80
D) 10
ΔT=50 K ΔV= 0,5 L P= 1,05 x 105 Pa
Dal primo principio della termodinamica sappiamo che ΔΕ = Q -L dove L = lavoro = PΔV
In una trasformazione adiabatica non vi è scambio di calore con l’esterno per cui Q=0 e quindi ΔΕ = -L .
Il gas monoatomico in esame è sottoposto ad una compressione che ne determina una diminuzione di volume ed il calore prodotto viene utilizzato esclusivamente per aumentare l’energia cinetica del gas che si riflette in un aumento di temperatura. La ΔΕ quindi dipende dal calore specifico del gas, dalla sua quantità in moli e dalla differenza di temperatura prodotta per effetto del lavoro L compiuto ΔΕ= nCvΔT.
Abbiamo quindi che ΔΕ= nCvΔT e ΔΕ = PΔV essendo il lavoro svolto sul sistema.
Possiamo pertanto scrivere :
n CvΔT = PΔV
ma per un gas monoatomico e Cv= 3/2R dove R è la costante dei gas (ciò dipende dal fatto che il sistema ha 3 gradi di libertà ognuno dei quali assorbe energia pari ad 1/2 R ) , In definitiva
n Cv ΔT = PΔV
n = PΔV / Cv ΔT n= 1 x 105 x 0,5 / 12,471 x 50 = 50000/623,55 = 80,1 moli
Risposta corretta C
9. Si consideri la reazione in cui il composto AB2 reagisce per formare AB e B2. In determinate condizioni, la velocità con cui si produce AB è 9,0 ∙10‒3 mol/dm3 s. La velocità con cui si produce B2 è:
A) 1,8 10‒2 mol dm‒3s‒1
B) 4,5 10‒3 mol dm‒3s‒1
C) 9,0 10‒3 mol dm‒3s‒1
D) 9,0 10‒2 mol dm‒3s‒1
soluzione
Dalla reazione bilanciata 2AB –> 2AB +B2 si deduce che la velocità di formazione di B2 è la metà di quella di AB
pertanto VB2 = 9,0 x 10-3 /2 = 4,5 x 10-3
risposta corretta B
10. Si sta studiando una reazione del tipo A → Prodotti. Si osserva sperimentalmente che il tempo di dimezzamento della concentrazione di A si riduce della metà se la concentrazione iniziale di A raddoppia. Qual è l’ordine di tale reazione?
A) secondo ordine
B) ordine zero
C) primo ordine
D) nessuna delle precedenti opzioni è corretta
soluzione
Per una reazione A ⇐⇒ prodotti
se V (la velocità di una reazione) aumenta proporzionalmente al crescere della concentrazione [A] del reagente , si dice che la reazione è del primo ordine rispetto ad A (dire che aumenta proporzionalmente significa che, se raddoppio la concentrazione, raddoppia anche la velocità; che se si riduce [A] a 1/3, si riduce a 1/3 anche la velocità); la costante di velocità k è del I° ordine ed è data dalla pendenza della retta v = K C.
Pertanto per la reazione A → prodotti
V = K [A] = -d[A]/dt da cui -d[A]/[A] = Kdt
Cioè il rapporto tra la variazione della concentrazione del reagente A, indicata dal termine d[A], rispetto alla sua concentrazione attuale (cioè nel momento che consideriamo), indicata dal termine [A], è costante se si considerano intervalli di tempo costanti; che è quanto appare dal grafico b.
Le dimensioni di K in questo caso (I° ordine): K (sec-1), poiché è K = -d[A]/[A] dt. (il rapporto di concentrazioni non ha dimensioni; resta solo il tempo al denominatore, perciò i sec sono elevati a -1).
il tempo di dimezzamento t1/2 è il tempo necessario perché la concentrazione iniziale di un reagente sia ridotta a metà.
Se integriamo l’equazione differenziale vista prima, avremo che
ln [A]/[A]0 = -K (t-t0)
(ln = logaritmo naturale) e se in questa poniamo [A] = 1/2 [A]0, (se vogliamo cioè che la concentrazione sia la metà dell’iniziale, come definito per il tempo di dimezzamento), e dato che t0 = 0 (inizio della reazione), avremo:
ln [A]/([A]0 /2)= -K (t-t0) ln2 = K t1/2 t1/2 = 0.693/k
Come si vede dalla formula, per le reazioni del primo ordine t1/2 non dipende dalla concentrazione del reagente.
In una reazione del II° ordine :
2 A ® prodotti
V = K [A]2 = -d[A]/dt da cui -d[A]/[A]2 = K dt
Se integriamo questa equazione differenziale otteniamo che

K è espressa in (sec-1 mol-1 dm3)
Una reazione del secondo ordine può essere anche del tipo :
A + B ® prodotti
V = K [A] [B] = -d[A]/dt = -d[B]/dt
Il tempo di dimezzamento in questo caso è :
A + B ® prodotti
V = K [A] [B] = -d[A]/dt = -d[B]/dt
T½ = 1/K[A]
In una reazione di Ordine Zero la velocità di reazione si mantiene costante per tutta la durata del processo.
dc/dt = v = costante
c1 – c2 = k (t2 – t1)
t½ = c1/2 k se poniamo c2 = c1/2,
Tipiche reazioni di ordine zero sono attivate dalla radiazione ultravioletta: la decomposizione della vitamina B12, la trasformazione dell’ergosterolo in vitamina D2, la trasformazione del 7-deidrocolesterolo in vitamina D3.
In questi casi, è evidente che la velocità di reazione non è legata alla quantità di substrato reattivo, bensì al fatto che l’energia luminosa abbia associata l’energia necessaria per attivare la reazione.
Riepilogando, per una reazione di :
Ordine zero: t1/2 =[ A]o /2k
Ordine I: t1/2 = ln2 /k=0.693/k
Ordine II: t1/2 = 1 /k[A]o
Poichè il quesito ci indica che il tempo di dimezzamento diminuisce se [A]0 raddoppia è evidente che la reazione è del II° Ordine
risposta corretta A
11. L’equilibrio di una reazione chimica si sposta a sinistra (verso i reagenti) se la temperatura diminuisce.
Si può quindi concludere che:
A) la reazione ha un ∆H minore di zero
B) la reazione è endotermica
C) la reazione è esotermica
D) non si può trarre alcuna conclusione in assenza di dati aggiuntivi
soluzione
A pressione costante, il calore di reazione si chiama entalpia di reazione (H) e la variazione di entalpia (ΔH) è la quantità di calore assorbito o liberato da una reazione senza variazione di pressione.
ΔHreazione = ΣHprodotti – ΣHreagenti
Se ΔH < 0 la reazione è esotermica, cioè libera calore, il che significa che i prodotti possiedono una entalpia H minore di quella dei reagenti
Se ΔH > 0 la reazione è endotermica, cioè assorbe calore dall’ambiente, che si raffredda.
In una reazione A+B–>C + q cioè in una reazione esotermica la sottrazione di calore sposta la reazione verso i prodotti (infatti q deve essere ritenuto come un prodotto di reazione e se q diminuisce la reazione si sposta a destra) Se Invece la reazione è endotermica cioè a + B –>C + -q
la sottrazione di calore la sposta verso i reagenti perchè aumenta -q.
Al contrario se forniamo calore ad una reazione esotermica favoriamo la reazione indiretta mentre se forniamo calore ad una reazione endotermica favoriamo la reazione nel senso della formazione dei prodotti.
risposta corretta B
12. Calcolare il pH di una soluzione di HF 0,1 M a cui si aggiungono 4,0 g di NaOH solido per litro di soluzione.
A) 13,0
B) 9,8
C) 8,1
D) 7,5
soluzione
L’acido fluoridrico è l’unico acido alogenidrico (come HCl, HI) che non è un acido forte è infatti un acido relativamente debole perchè ha il raggio atomico molto piccolo, ciò porta ad avere gli elettroni su orbitali molto ravvicinati tra di loro. In qualità di acido deve accettare un doppietto elettronico per cedere il protone e trasformarsi in anione F-. Qui entrano in gioco le forze repulsive degli orbitali di valenza (2s e 2p), così elevate che F- cede elettroni per legarsi al protone e riformare l’acido spostando quindi l’equilibrio verso i reagenti:
HF + NaOH–> NaF+ H2O
La concentrazione di HF =0,1 M e la concentrazione di NaOH è 4/40=0,1M
essendo le concentrazioni di acido e di base uguali tutto l’acido è trasformato in sale che a questo punto subisce idrolisi
il PH di idrolisi di un sale di acido debole e base forte la cui concentrazione nel caso nostro è Cs=0,1 è
Dalle tavole si ha un Ka pari a 7,2 x 10-4 per cui
[OH-]=√(Kw/Ka ) Cs = √( 10-14 / 7,2 x 10-4) x 0,1 =√0,13x 10-11 = 1,14 x 10-6
POH = -log [OH-]= -log 1,14 x 10-6 = 6-log 1,14 = 5,94 poichè PH+POH =14 il PH = 14-5,94 = 8,1
risposta corretta C
13. Una soluzione contiene Cd(NO3)2 0,1 M. Si intende recuperare Cd2+ trasformandolo in Cd (s),
mediante reazione con una lamina di metallo M (s):
Cd2+ + M (s) → Cd (s) + M2+
Considerando la tabella dei potenziali redox, quale metallo deve essere immerso nella soluzione?
A) Zn;
B) Sn;
C) Cu;
D) Co,
soluzione
dalla tabella dei potenziali standard
E° cd = -0,403 V E° Sn= -0,14 V E° Zn =-0,763 V E°Co= 1,82 V E°Cu= 0,337 V
sappiamo che l’elemento che possiede un E° più negativo (o meno positivo) agisce da riducente mentre un elemento con E° positivo (o più positivo) agisce come ossidante.
Per tale motivo l’elemento da usare per la riduzione del cadmio è lo Zinco che ha un E° Zn =-0,763 V più negativo di E° del Cd
Risposta corretta A
14. Una soluzione incognita contenente un catione è posta in quattro becher. Si effettuano le seguenti aggiunte:
Considerando la tabella delle costanti di solubilità, indicare il catione presente nella soluzione.

A) Ca2+
B) Zn2+
C) Ba2+
D) Sr+3
soluzione
i dati di solubilità dei vari sali sono calcolabili dai rispettivi valori di Kps infatti S= √kps e ne risulta il quadro seguente:
solubilità carbonato solfuro solfato nitrato
Ca2+ poco solubile molto solubile poco solubile completamente solubile
Zn2+ poco solubile insolubile solubile solubile
Ba2+ poco solubile molto solubile poco solubile solubile
Sr+3 poco solubile solubile poco solubile solubile
da questi dati si evince che tutti gli ioni in esame formano il rispettivo carbonato,ma solo lo Zinco può precipitare come carbonato e solfuro e non precipita come solfato e nitrato.
Risposta corretta B
15- 52,3 g di un minerale contenente CeO2 (s), riscaldati a 1500 K, formano 0,014 moli di O2 (g) secondo la
reazione (da bilanciare):
CeO2 (s) → Ce2O3 (s) + O2 (g)
Calcolare la % in massa di Ce nel minerale.
A) 15,0%;
B) 21,7%;
C) 38,9%;
D) 41,8%.
soluzione
la reazione bilanciata è:
4CeO2 (s) → 2Ce2O3 (s) + O2 (g)
poichè da 4 moli di CeO2 si ottiene 1 mole di O2 da X moli si ottengono 0,014 moli di O2 cioè 0,448 g O2
4 x172 : 32 = X : 0,448 X=g CeO2 =9,6 g
172: 140=9,6 :X X= 7,85
52,3 :7,85 =100 :X X=15%
risposta corretta A
16. Determinare la costante di ionizzazione di un acido debole HA sapendo che, aggiungendo 50 mL di
una soluzione 0,1 M di NaOH a 50 mL di una soluzione 0,2 M di HA, si ottiene una soluzione con pH 4,5.
A) 6,8 ∙10‒7
B) 3,2 ∙10‒5
C) 8,4 ∙10‒3
D) 5,2 ∙10‒8
soluzione
le mmoli NaOH sono 50 x 0,1 =5 mmoli
le mmoli HA sono 50 x 0,2 = 10 mmoli
quindi 5 mmoli formano il sale la cui concentrazione è 5 /100 =0,05 che in 1000 sono 0,5 M
rimangono 5 mmoli di acido 5/100 = 0,05 cioè 0,5 M quindi Ca=Cs
essendo il sale in presenza dell’acido si ha una miscela tampone il cui
[H+]= Ka Ca/Cs Ma Ca=Cs nel caso in esame quindi
[H+]= Ka
[H+]= 10-4,5 = Ka
Ka = 3,16 x 10-5
risposta corretta B
17. Determinare quante moli di Fe (s) sono necessarie per ridurre 2 moli di nitrobenzene, secondo la reazione
(da bilanciare):
C6H5NO2 (aq) + Fe (s) + H+(aq) → C6H5NH3 +(aq) + Fe2+(aq) + 2 H2O (aq)
A) 4,87
B) 3,21
C) 6,00
D) 9,11
6[Fe –> Fe+2 +2e
2[C6H5NO2 (aq) +6e + 4H+ –> C6H5NH3 +(aq) + 2H2O
_________________________________________________
6Fe + 2 C6H5NO2 +8H+ —> 2 C6H5NH3 + 6 Fe+2 +4H2O
da questa reazione si evince che per ridurre 2 moli di C6H5NO2 (nitrobenzene) occorrono 6 moli di Fe
risposta corretta C
18. Quale andamento del pH in funzione del volume di titolante si verifica nella titolazione di una soluzione
di NH3(aq) con HCl?

soluzione
NH3 acquoso forma NH4OH che in presenza iniziale di HCl forma NH4Cl e si forma un tampone ed il PH diminuisce gradualmente. Man mano che si aggiunge HCl si arriverà al punto in cui tutto NH4OH è trasformato in NH4Cl ed il PH sarè quello derivante dall’idrolisi del sale formato da una base debole ed un acido forte. Ulteriori aggiunte di HCl fanno diminuire il PH rapidamente.
Da quanto sopra si evince che il grafico A è quello corretto in quanto quello D si riferisce alla titolazione di una base forte con un acido forte:
Risposta corretta A
19. I bromo-alcossidi di formula generale
Br‒CH2(CH2)nCH2O-
possono reagire secondo un meccanismo SN2 dando una reazione intermolecolare o intramolecolare. La resa delle due reazioni in competizione è dipendente dalla concentrazione del reagente bifunzionale e dalle dimensioni del ciclo che si può formare. Individuare quale delle seguenti affermazioni è vera:
A) una bassa concentrazione di reagente favorisce la reazione intramolecolare
B) un’alta concentrazione del reagente inibisce la reazione intermolecolare
C) la formazione di cicli a sei termini favorisce la reazione intermolecolare
D) la formazione di cicli a quattro termini favorisce la reazione intramolecolare
soluzione
Reazioni intramolecolari
una reazione di condensazione intramolecolare avviene tra due gruppi funzionali presenti nella stessa molecola dando spesso luogo alla ciclizzazione con eliminazione di una molecola a basso peso molecolare.
Quando sia l’anione enolato che il Br del bromoalcossido sono presenti sulla stessa molecola, la reazione con un’altra molecola può portare sia ad una reazione di addizione tra 2 molecole sia alla formazione di una molecola ciclica. Questo tipo di reazione è particolarmente utile per la formazione di anelli a 5 o 6 termini poiché questi sono quelli più stabili. Più alta è la concentrazione di reattivo maggiore sarà la probabilità di urti tra le molecole e quindi maggiore sarà la probabilità di reazione intermolecolare, invece, minore è la concentrazione del reagente tanto minore è la possibilità di reazione intermolecolare mentre più elevata è la possibilità che si formi una molecola ciclica cioè che si abbia una reazione intramolecolare con formazione di anelli.
la risposta corretta è A
20. Individuare quale delle quattro molecole riportate sotto rappresenta il prodotto della seguente serie di reazioni:

A) 1
B) 2
C) 3
D) 4
soluzione
La prima reazione è una friedel-craft che introduce nel benzene il gruppo CH3-CH2 – la successiva solfonazione (aggiunta di SO3H ) è utilizzata per formare un intermedio che orienti in para il gruppo che dovrà entrare cioè CH3CO utilizzando la reazione con l’anidride acetica. La terza reazione è un’idrolisi acida a caldo , che elimina il gruppo SO3H- dal benzene il che porta al prodotto finale che è la molecola N.2
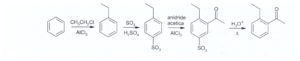
Risposta corretta B
21. In un recipiente termostatato, una soluzione di quattro gas ha la seguente composizione percentuale in massa: H2O (40,00%), SO2 (30,00%), O2 (20,00%), CO2 (10,00%). Calcolare la composizione percentuale in volume.
A) H2O = 32,70%; SO2 = 23,23%; O2 = 27,65%; CO2 = 16,42%
B) H2O = 62,70%; SO2 = 13,23%; O2 = 17,65%; CO2 = 6,42%
C) H2O = 22,70%; SO2 = 33,23%; O2 = 27,65%; CO2 = 16,42%
D) H2O = 12,70%; SO2 = 33,23%; O2 = 37,65%; CO2 = 16,42%
soluzione
supponiamo che la miscela gassosa sia a c.n.
18 g di H2O occupano 22,414 L quindi 40 g occupano un volume 18:22,414 = 40 :X V1 =49,8 L
64 g di SO2 occupano un volume di 22,414 L 30 g occupano un volume 64:22,414= 30:X V2= 10,5 L
32 g di O2 occupano un volume di 22,414 L 20 g occupano un volume 32 :22,414 = 20: X V3 = 14 L
44 g di CO2 occupano un volume di 22,414 L 10 g occupano un volume 44 : 22,414= 10:X V4= 5,1 L
il volume totale è v1 +v2+v3+v4 = 79,4 L
pertanto la % in volume di H2O è 79,4 : 49,8 =100 :X X= 62,7 %
pertanto la % in volume di SO2 è 79,4 :10,5 = 100 :X X = 13,23 %
pertanto la % in volume di O2 è 79,4 : 14 = 100 :X X= 17,65 %
pertanto la % in volume di CO2 è 79,4 : 5,1 = 100 :X X = 6,42 %
La risposta corretta è B
22. Un campione sottoposto ad analisi elementare risulta essere composto da: 18,84% di K; 34,16% di Cl
in massa. Indicare la formula compatibile con tale analisi:
A) KAuCl4
B) K2PdCl4
C) K2PtCl4
D) K2PtCl6
soluzione
il rimanente 47% può essere Au Pd o Pt
dividendo per i rispettivi pesi atomici avremo
Au = 47/197 =0,238 Pd = 47/106,4= 0,44 Pt =47/ 195 =0,23
K = 18,84/ 40= 0,471 Cl = 34,16/35,5 = 0,96
dividendo per il numero più piccolo che è 0,23 avremo K=2 Cl=4 Au=1 Pd= 2
Dai calcoli effettuati il metallo potrebbe essere Au oppure Pt
Tuttavia vediamo che il rapporto relativo al K nei due casi risulta essere K=2 Au=1 e per Cl=4 pertanto l’Au è da escludere perchè la formula sarebbe K2AuCl4 e non KAuCl4 . Quindi la risposta A è da escludere. Analogo ragionamento si può fare per il Pd che nei calcoli risulta essere Pd2 e quindi anche la formula K2PdCl4 è da escludere.
Il Pt invece è Pt1 quindi si deduce che la formula corretta è K2PtCl4 cioè la risposta corretta al quesito è C
23. Calcolare la quantità di SnCl2 necessaria per reagire con 4,80 g di H2S secondo la reazione, da bilanciare:
SnCl2 + H2S → SnS + HCl
A) 64,5 g
B) 34,5 g
C) 32,0 g
D) 26,8 g
soluzione
la reazione bilanciata è una reazione di doppio scambio
SnCl2 + H2S → SnS + 2HCl
si deduce che da 1 mole cioè 189,6 g reagiscono stechiometricamente con 34 g di H2S quindi la quantità di SnCl2 necessaria a far reagire 4,8 g di H2S è :
189,6 : 34 = X = 4,8 X= 26,8 g
risposta corretta D
24. Indicare i coefficienti stechiometrici (in ordine sparso) necessari per bilanciare la seguente reazione:
ZnS + HNO3 + HCl → ZnCl2 + S + NO + H2O
A) 1, 1, 2, 2, 2, 3, 5
B) 2, 2, 3, 3, 3, 4, 6
C) 2, 3, 3, 3, 4, 4, 6
D) 3, 3, 4, 4, 6, 16, 18
soluzione
3[S-2 —>S +2 e
2[NO3- +3 e + 4 H+ —>NO +2H2O
____________________________
3S-2 +2NO3- + 8H+ —> 3S + 2NO + 4H2O
la reazione bilanciata è:
3ZnS + 2HNO3 +6 HCl → 3ZnCl2 + 3S + 2NO + 4 H2O
i coefficienti sono : 3,2,6,3,3,2,4
risposta corretta B
25. Indicare l’affermazione ERRATA:
A) una molecola è polare se la somma vettoriale dei momenti di dipolo in essa contenuti è diversa da zero
B) condizione necessaria ma non sufficiente affinché una molecola sia polare è la presenza in essa di legami
covalenti polari
C) una molecola ABn è sempre polare se l’atomo centrale A presenta coppie solitarie
D) se in una molecola sono presenti solo legami covalenti apolari, la molecola è sicuramente apolare
soluzione
Se in una molecola biatomica( ad es. HCl) esiste una differenza di elettronegatività tra gli atomi, il legame è polare cioè possiede un momento dipolare μ. Il momento dipolare è rappresentato da un vettore e come tale possiede modulo,direzione e verso.In una molecola poliatomica la polarità dipende oltre che dal momento dipolare tra l’atomo centrale e gli altri atomi, anche dalla geometria della molecola. Infatti i vari vettori che rappresentano i momenti dipolari di ogni legame si sommano vettorialmente e se il vettore risultante ha modulo diverso da zero la molecola nel complesso è polare. Pertanto anche se in essa vi son legami fortemente polari se la somma dei vettori risulta essere zero la molecola è apolare.
Ciò detto è chiaro che la frase errata è la C in quanto la presenza di doppietti solitari non è condizione necessaria e sufficiente per determinare la polarità di una molecola.
La risposta corretta al quesito è C
26. Utilizzando un campione di polivinilpirrolidone con massa molare media di 6 kg mol‒1 si vuole preparare una soluzione acquosa con pressione osmotica di 2,00 kPa alla temperatura di 25,0 °C. Quale massa di polimero deve essere sciolta per preparare 200 mL di soluzione?
A) 0,097 g
B) 3,1 g
C) 0,31 g
D) 0,97 g
soluzione
La pressione osmotica è una proprietà colligativa di una soluzione ed è pari a π V =( g/PM) x RT x i
dove i è il numero di particelle in soluzione.
Nel caso in esame i=1 quindi se la soluzione deve avere una pressione osmotica pari a 2,0 KPa avremo
2,0 x 0,2 = g/6000 x 8,314 x 298 g= 2400/2477.5 = 0,97 g
Risposta corretta D
27. Per una certa reazione il ΔH° è di 12 kJ mentre il ΔS° è di 15 J K‒1 ; valori che possono essere considerati indipendenti dalla temperatura. A quale temperatura la costante di equilibrio è unitaria?
A) 1200 K
B) 800 K
C) 400 K
D) non è possibile che sia unitaria
soluzione
la costante di equilibrio è in realzione a ΔG° secondo l’equazione ΔG° =ΔH° -T ΔS°
esprimendo le unità in Jaules
ΔG° =12000 J – T x 15 J= -RT lnK
se K=1 allora -RT lnK è zero quindi 1200J -15J xT=0 da cui -15 J x T= – 12000 T= 12000/15 = 800 K
risposta corretta B
28. La costante cinetica della decomposizione termica dell’etilammina a 500 °C, secondo la reazione
C2H5NH2 → C2H4 + NH3
è k= 1,57 10‒3 s‒1
In un esperimento a volume costante la pressione iniziale dell’etilammina era 4,7 kPa. Quale pressione, circa, fu raggiunta nel recipiente dopo 30 minuti?
A) 4,5 kPa
B) 2,2 kPa
C) 9,0 kPa
D) 18 kPa
soluzione
sappiamo che per una cinetica del primo ordine si ha [A1] = [A°] x e -kt
in tal caso dobbiamo conoscere [A° ] per cui sappiamo che se V= K e lo poniamo pari ad 1 litro avremo
4700 Pa = (n/1) R T da cui n= [A°] = 4700 Pa/ 8,314 x 777 = 4700/ 6460 = 0,727 moli/L
dopo 30 minuti cioè 1800 secondi [A1] = 0,727 x e – 0,00157 x 1800 = 0,727 x e -2,826
[A1] = 0,727 x 0,059
[A1] = 0,043 moli /L
[A°] = 0,727 moli/L
Le moli presenti nel recipiente sono 0,043 di etilamina (1-α) e 0,727 -0,043 = 0,684 di C2H4 e 0,684 di NH3 = 1,368 moli /L
la pressione è pertanto
P = 1,368 x 8,314 x 773 = 8791 Pa = 8,79 KPa
P= 0,043 x 8,314 x 773 = 243 Pa
La P in KPa = 0,243 + 8,79= 9,033 KPa
La risposta corretta è C
29. Determinare il ∆H° della seguente reazione:
4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (l)
sapendo che le entalpie molari standard di formazione di acqua, monossido di azoto ed ammoniaca sono rispettivamente ΔΗH2O =‒285,83 kJ mol‒1, ΔΗNO =90,25 kJ mol‒1 e ΔΗNH3 = ‒46,11 kJ mol‒1
A) ‒1170 kJ
B) ‒1559 kJ
C) ‒197 kJ
D) 1559 kJ
soluzione
dalla reazione si evince che ΔΗ reaz= (4 x ΔΗNO + 6 x ΔΗH2O ) – (4 ΔΗNH3 )
quindi ΔΗreaz = (4 x 90,25 + 6 x -285,83 ) – 4 x -46 = ( 361 – 1714,98 ) +184 = -1169,98 = –1170 kJ
Risposta corretta A
30. La pressione parziale di A nella reazione
A→Prodotti
mostra la dipendenza riportata di seguito.
t (sec) kPa lnP
5 3,3 1,19
7 2.0 0,693
11 0,69 -0,371
15 0,23 -1,469
21 0,045 -3,1
24 0,020 -3,91
Determinare l’ordine della reazione e la pressione di A all’inizio della reazione.
A) primo ordine; pA° = 13 kPa
B) secondo ordine; pA° = 13 kPa
C) primo ordine; pA° = 8,2 kPa
D) secondo ordine; pA° = 8,2 kPa
soluzione
Una reazione del primo ordine è una reazione la cui velocità dipende linearmente dalla concentrazione di un reagente Si può dimostrare che detta [A] la concentrazione iniziale del reagente A e detta [Ao] la concentrazione del reagente A dopo un certo tempo t si ha:
ln[A]/[Ao] = -kt
Se la reazione avviene in fase gassosa si possono sostituire ad [A] e ad [Ao] le rispettive pressioni. Sapendo che PV=nRT che p/RT = n/V
pA/RT = nA/V = [A]
E analogamente pO/RT = [Ao]
Si ha quindi:
ln (pA/RT / pO/RT) = – kt
E semplificando ln pA / pO= – kt
Da cui ln pA = – kt + ln po che rappresenta una retta di pendenza –k e con intercetta ln po
Calcoliamo la pendenza della retta
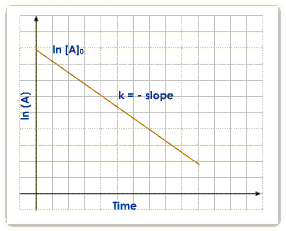
lnP-lnPiniz / t2-t1 =k dove t2 e t1 sono i tempi in secondi dello stato finale e quello iniziale.
-3,91 -1,19 / 24-5 = k= -0,27 s-1
la pendenza k che si ottiene dai dati successivi (espressa in sec-1) è :
-0,693 -0, 371/7 -11 = – 0,27
-1,469- 0,371 / 15-11 = -0,27
-3,1 — 1,469 /6 = -0,27
-3,91 — 3,1 /3 = -027
i dati dimostrano che si tratta di una reazione del primo ordine.
La pressione iniziale P° ricordando che lnPA = -kt + ln P° = -3,91 =-0,27 x 24 + lnP°
da cui lnP° = 6,48 -3,91= 2,57 da cui P° = e2,57 = 13,0 kPa
Risposta corretta al quesito A
31. Quale affermazione sulla dissoluzione di un solido in un liquido è corretta?
A) il volume della soluzione risultante è uguale a quello del liquido iniziale più quello del solido
B) il volume della soluzione risultante è uguale a quello del liquido iniziale
C) il volume della soluzione risultante è sempre maggiore di quello del liquido iniziale
D) nessuna delle precedenti opzioni è corretta
soluzione
Il processo di solubilizzazione consiste nella dispersione delle particelle che compongono il soluto nel solvente.La solubilità di un certo soluto in un certo solvente dipende, oltre che dalle caratteristiche delle due sostanze, dalla temperatura e dalla pressione.Perché un solido si sciolga, occorre che il solvente rompa tutte le interazioni attrattive che i componenti del solido possiedono nel reticolo cristallino. Se il solido si scioglie in un liquido il volume può rimanere uguale ma potrebbe anche aumentare o diminuire a seconda delle interazioni tra soluto e solvente. Si deduce che le risposte A,B,C sono errate e la risposta corretta è D
32. Una macchina termica di Carnot svolge, ad ogni ciclo, un lavoro di 2 kJ assorbendo 5,7 kJ dal serbatoio caldo. Il serbatoio freddo ha una temperatura di 25 °C.
Qual è la temperatura del serbatoio caldo? Assumere che tutte i processi siano reversibili.
A) 186 °C
B) 200 °C
C) 459 °C
D) 630 K
soluzione
Per una macchina termica ideale che esegue il suo ciclo operando tra le temperature estreme Tmin, TMax,assorbendo il calore Qa dal serbatoio (sorgente) a temperatura TMax e cedendo il calore Qc al serbatoio a temperatura Tmin, sussistono le seguenti relazioni
η = 1- Tmin /Tmax η =1 -Qceduto / Qassorbito
cioè Tmin/Tmax = Qceduto/Qassorbito
Qassorbito= Lavoro eseguito + Qceduto
5,7 Kj =2,0 Kj +Qceduto
Qceduto= 5,7 – 2,0 = 3,7 Kj
pertanto essendo
Qceduto/Qassorbito= Tmin/Tmax si ha : 3,7/5,7 = 298/X X=Tmax= 298/0,649 = 459° K
cioè Tmax = 459-273= 186 C°
risposta corretta A
33. Un campione di 5,317 g di naftalene(PM= 128,16) è sciolto in 100,0 cm3 di benzene alla temperatura di 21 °C, il volume finale della soluzione è 101,3 cm3. Calcolare la molarità e la molalità della soluzione. La densità del benzene puro a questa temperatura è 876 kg m‒3.
A) 0,321 mol dm‒3 ; 0,329 mol kg‒1
B) 0,409 mol dm‒3; 0,473 mol kg‒1
C) 0,329 mol dm‒3; 0,322 mol kg‒1
D) 0,409 mol dm‒3; 0,403 mol kg‒1
soluzione
ricordando che la Molarità= moli /Volume allora
moli in 100 ml=(5,317/128,16)/101,3=0,0415 /101,3= 4,09 x 10-4 moli
M=0,409 moli/dm3
Per calcolare la Molalità = moli /Kg di solvente
Nel quesito,la densità del benzene è espressa in Kg/m3 ma nel quesito vengono usati i ml di benzene per cui bisogna trasformare le unità della densità da Kg/m3 in g/ml.
Pertanto, essendo 1Kg/m3 = 0,001 g/ml allora la densità del benzene è d= 0,876 g/ml
Essendo la Molalità espressa in moli/Kg di solvente dobbiamo conoscere i grammi di benzene che corrispondono a 100 ml .
I grammi di benzene in 100 ml sono calcolati dalla densità = 0,876 g/ 1 ml e quindi dalla proporzione:
se in 1 ml vi sono 0,876 g allora in 100 ml vi saranno X g X= 100 x 0,876 = 87,6 g
Le moli di naftalene sono 5,317/ 128,16 = 0,04148 moli che sono contenute in 87,6 g di solvente
la molalità possiamo adesso calcolarla con la proporzione:
se in 87,6 g di solvente sono disciolte 0,04148 moli in 1000 g ve ne sono X
X= 0,473 la molarità è Molalità=o,473 moli/Kg Pertanto :
Molarità = 0,409 moli/L
Molalità= 0,473 moli/Kg
risposta corretta B
34. Il teorema degli stati corrispondenti asserisce che sostanze diverse hanno uguale comportamento in condizioni di:
A) coordinate critiche uguali
B) uguale fattore di compressibilità
C) coordinate ridotte uguali
D) uguale temperatura critica
soluzione
L’equazione di stato di un gas ideale è p Ṽ = RT dove Ṽ è il volume molare del gas. Un gas ideale è un gas che supponiamo formato da molecole puntiformi, non subiscono attrazioni o repulsioni tra loro e con le pareti del recipiente effettuano solo urti elastici . Si definisce fattore di comprimibilità Z di un gas il rapporto Z= pṼ/RT che per un gas ideale è 1.
L’equazione PV=nRT è però valida solo a pressioni sufficientemente basse e ciò significa che si osservano deviazioni dal comportamento ideale nel caso in cui la pressione aumenti.
La legge di Boyle PV =k nel piano p-V ha la forma di un’iperbole equilatera mentre per un gas reale, notiamo che solo ad alta temperatura e pressione bassa le isoterme si avvicinano ad una forma di iperbole.
In certe condizioni di temperatura e pressione le particelle di un gas subiscono attrazioni tanto forti da formare uno stato liquido per cui il gas subisce un processo di liquefazione. Pertanto, per liquefare un gas, possiamo aumentare la pressione o diminuire la temperatura infatti, in queste condizioni le particelle di gas si muovono meno rapidamente e sono soggette a forze di attrazione più intense. Per ogni gas esiste una temperatura detta temperatura critica al di sopra della quale esso non può essere liquefatto, qualunque sia la pressione applicata (gas supercritico). Alla temperatura critica il gas può essere ancora liquefatto alla pressione critica.
La liquefazione di un gas è un processo che può essere compreso studiando l’equazione di Van der Waals che non è altro che l’equazione di stato dei gas per i gas reali PV= RT che comprende quindi i parametri di attrazione o repulsione tra molecole ed il volume stesso occupato da una molecola (covolume):
[p + n2a/V2)(V-nb) ]= nRT
Il grafico ottenuto dall’equazione sopra scritta per varie temperature e pressioni è il seguente
in questo grafico il punto C corrispondente ai valori Pc e Vc corrisponde al punto critico e Pc e Vc sono la pressione critica ed il volume critico.
Per i gas reali i valori C Pc e Vc sono delle vere e proprie costanti fisiche caratteristiche di ciascun gas e conoscendo i valori sperimentali possiamo calcolare i valori a e b che compaiono nell’equazione di van der Waals
[p + n2a/V2)(V-nb) ]= nRT
mettendoli in relazione con i dati di compressibilità per poter valutare se ad un gas è possibile applicare l’equazione..
Secondo il teorema degli stati corrispondenti ottenuto a partire dall’equazione di van der Waals tutti i gas messi a confronto nelle stesse condizioni si comportano allo stesso modo purché i parametri siano espressi in termini ridotti. In generale si definisce proprietà termodinamica ridotta il rapporto tra la grandezza assoluta e il valore assunta da essa nel punto critico. Pertanto la temperatura ridotta è data da Tr = T/Tc, la pressione ridotta è data da pr= p/pc e il volume ridotto è dato da Vr=V/Vc dove Tc, pc, e Vc rappresentano rispettivamente la temperatura, la pressione e il volume nel punto critico.
Dall’equazione di van der Waals si ottiene anche la relazione :
pr = 8Tr/ 3Vr -1 – 3/Vr2
Tale equazione consente di calcolare le proprietà ridotte di un gas anche se i valori di a e b non sono noti, inoltre, per il teorema degli stati corrispondenti il fattore di compressibilità ZA di una sostanza A può essere determinato conoscendo il fattore di compressibilità ZR di una sostanza di riferimento R di cui è noto il comportamento.
Da quanto esposto si evince che la risposta corretta al quesito è C
35. Un corpo di piombo inizialmente a 75,00 °C,viene immerso in un contenitore termicamente isolato che contiene 8,00 kg di acqua a 22,00 °C. Raggiunto l’equilibrio termico, un termometro ad alcool con il bulbo immerso nell’acqua segna 25,00 °C. Qual è la massa del corpo? La capacità termica del piombo è 0,128 J K‒1 g‒1 mentre quella dell’acqua è 4,184 J K‒1 g ‒1.
A) 15,7 kg
B) 8 kg
C) 22,3 kg
D) 22,3 g
soluzione
sappiamo che Q= massa x calore specifico x (T2-T1) quindi
per il piombo Q1= m 0,126 x (75-25)
per l’acqua Q2 = 8 x 4,184 x ( 25-22)
ma all’equilibrio deve essere Q1=Q2 pertanto
m x 0,126 x 50 = 8 x 4,184 x 3
m= 100,416/6,4 = 15,7 Kg
risposta corretta A
36. Per la transizione
NH4NO3 (α-rombico) → NH4NO3 (β-rombico)
Findlay ha determinato i seguenti stati di equilibrio:
p (kPa) 9,8 1960 3920
T (°C) 32,0 38,5 45,4
È inoltre noto che il ∆V è 0,220 cm3 g‒1 . Calcolare l’entalpia della transizione di fase.
A) 160 kJ mol‒1
B) 32000 J mol‒1
C) 320 J mol‒1
D) 1600 J mol‒1
soluzione
L’energia libera è certamente la funzione di stato che è la base dello studio di ogni equilibrio chimico.Infatti, se consideriamo una reazione esotermica che comporta un aumento dell’ordine, la variazione di entalpia tende a rendere la reazione spontanea, mentre la variazione di entropia tende ad ostacolare la reazione stessa. Se consideriamo una reazione endotermica che dà luogo a disordine allora la variazione di entropia favorisce una reazione spontanea, al contrario della variazione di entalpia. Come è possibile stabilire se una reazione può avvenire o meno? A tal fine Gibbs ha introdotto una grandezza definita energia libera, il cui valore ci permette di stabilire se una reazione avviene o no.
L’energia libera di Gibbscostituisce l’energia di una reazione che può essere utilizzata per produrre lavoro ed è una funzione di stato, rappresentata dal simbolo G, quindi, ΔG rappresenta una variazione dell’energia libera di Gibbs, che viene definita in termini di entalpia ed entropia secondo l’equazione:
G = H – TS → ∆G = ∆H – T∆S
TS rappresenta la parte di energia entropica non utilizzabile per produrre lavoro in quanto serve al sistema per mantenere se stesso.In una trasformazione spontanea ∆G è sempre negativa; se ∆G < 0 la reazione è definita esoergonica; una reazione con ∆G > 0 è invece definita endoergonica. Se una reazione avviene a bassa temperatura e comporta una piccola variazione di entropia, il termine T∆S sarà trascurabile e ∆G dipenderà in gran parte da ∆H, la variazione di entalpia. La maggior parte delle reazioni chimiche che avvengono spontaneamente a temperatura ambiente hanno di conseguenza un ∆H negativo.
Nel caso del quesito essendo ∆Greaz = ∆H = PΔV cioè il lavoro compiuto sul sistema ed essendo
ΔV = 2,2 ·10‒4 m3/kg nel caso in cui T= 32°C =305 K si ha
ΔG(305) = PΔV = 9800 ·2,2 ·10‒4 = 2,156 J/kg
nel caso in cui T= 45,4°C = 318,4 K si ha :
ΔG(318,4) = PΔV = 3920 ·103·2,2 ·10‒4= 862,4 J/kg
Dalla relazione ΔG = ΔH – TΔS i
ΔS = (ΔH – ΔG)/T ma essendo ΔS e ΔH costanti, si può scrivere:
(ΔH – ΔG1)/T1 = (ΔH – ΔG2)/T2 da cui
ΔH = (ΔG1T2 – ΔG2T1)/ΔT pertanto
ΔH = (2,156 ·318,4 – 862,4 ·305)/13,4 = 19578 J/kg
dato che il peso molecolare del nitrato di ammonio è PM = 80 g mol‒1 allora si ha :
ΔH = 19578 ·80/1000 = 1566 J mol‒1
Risposta corretta D
37. In soluzione acquosa la reazione
H+ + HNO2 + C6H5NH2 → C6H5N2+ + 2 H2O
È catalizzata dagli ioni bromuro. Per questa reazione è stato proposto il meccanismo:
H+ + HNO2 ⇆ H2NO2+ reazione veloce
H2NO2+ + Br‒ → ONBr + H2O lenta
ONBr + C6H5NH2 → C6H5N2++ H2O + Br‒ veloce
Con quale legge cinetica, determinabile sperimentalmente, il meccanismo proposto è compatibile?
La velocità v è definita come d[C6H5N2+]/dt.
A) v = k [H+] [ONBr] [Br‒]
B) v = k [H+] [HNO2] [Br‒]
C) v = k [H+] [HNO2] [C6H5NH2]
D) v = k [HNO2] [Br‒]
soluzione
Lo step limiting di una reazione è determinato dalla fase lenta del meccanismo di reazione. In questo caso la reazione limitante è
H2NO2+ + Br‒ → ONBr + H2O
quindi la velocità dipende dalla concentrazione di Br- e di H2NO2+. Quest’ultima specie chimica tuttavia dipende sia dalla concentrazione di H+ che di HNO2 quindi in definitiva la cinetica della reazione è regolata dalla legge :
v = k [H+] [HNO2] [Br‒]
risposta corretta B
38. I due composti A e B formano una soluzione ideale. La tensione di vapore di A è 420 Pa. Qual è la tensione di vapore di B se una soluzione contenente 5 moli di A e 9 moli di B bolle a 510 Pa? La temperatura dei due liquidi puri e della miscela è uguale e costante.
A) 580 Pa
B) 610 Pa
C) 560 Pa
D) 540 Pa
Soluzione
Una soluzione bolle quando la sua tensione di vapore uguaglia la pressione P che grava sulla sua superficie.
La tensione di vapore del composto A nella miscela AB dipende dalla tensione di vapore di A puro e dalla sua frazione molare nella miscela AB.
Pertanto pA = 420 Pa xA = nA/(nA+nB)
la frazione molare di A è 5 / 5+9 = 5/14 = 0,357 e quella di B è 9/14 = 0,643
Essendo la pressione della miscela P = 510 Pa ed essendo P= fraz mol A x PA + fraz.mol B x PB cioè
Pt = xApA + xBpB
510 -xAPA /xB = PB
PB= (510 – 0,357 · 420)/0,643
PB= 560 Pa
Risposta corretta C
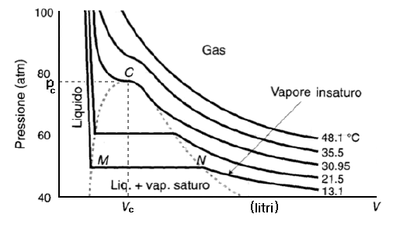
39. La lega per saldature Pb/Sn contiene una percentuale in massa approssimativamente uguale dei due metalli. Raffreddando la lega fusa, a quale temperatura (circa) si inizia ad osservare la formazione di solido e qual è la sua composizione? Si riporta di seguito il diagramma di fase delle miscele Pb/Sn.

A) 180 °C; 35 % in massa di piombo
B) 180 °C; 50 % in massa di piombo
C) 320 °C; piombo quasi puro
D) 220 °C; 84 % in massa di piombo
soluzione
Considerando il grafico e osservando la concentrazione al 50% abbiamo il punto descritto in figura

si osserva che il punto nel grafico corrisponde ad una temperatura di 220° alla quale si osserva la precipitazione del Pb alfa con una concentrazione che si legge sull’asse X pari a 84% ed ovviamente con una concentrazione del 16 % di Sn.
La risposta corretta è D
40. A pressione atmosferica, un campione di esano bolle a 69 °C, con una corrispondente variazione entalpica di 34,46 kJ mol‒1. Qual è l’entropia di ebollizione dell’esano a questa temperatura?
A) 100 cal /mol K
B) 100 J/ mol K
C) 500 J/mol K
D) 500 J/ g K
soluzione
Sappiamo che variazione di entalpia ed entropia sono in relazione attraverso la relazione
ΔG = ΔH – TΔS
Il sistema in esame risulta essere all’equilibrio per cui sappiamo che ΔG = 0
Pertanto ΔH – TΔS =0 ΔH = TΔS ΔS = ΔH/T pertanto
ΔS = 34460/(69+273) = 100, 7 J mol K
Risposta corretta B
41-Una sostanza S viene titolata con il reagente T, formando il prodotto ST secondo la reazione:
S (aq) + T (aq) → ST (aq)
Le specie S, T e ST hanno gli spettri di assorbimento UV-VIS riportati in figura:

Indicare la variazione dell’assorbanza misurata a 400 nm in funzione del volume di titolante T aggiunto (si trascuri la variazione di volume della soluzione)

Soluzione
Durante la titolazione sparisce S (che assorbe abbastanza a 400 nm) e si forma ST (che non assorbe a 400 nm): questo comporta una diminuzione di assorbanza durante la reazione. Dopo il punto di equivalenza, l’assorbanza aumenta per l’assorbimento di T . Il grafico che rispecchia questo andamento di assorbanza è quello B .
Risposta corretta B
42. Ad una soluzione incognita, posta in quattro becher, si aggiungono le seguenti soluzioni:

soluzione
il quesito si risolve valutando i valori di Kps dei rispettivi sali dai quali si evince che l’unico ione che precipita sotto forma di carbonato e fosfato è il Bario.
risposta corretta C
43. L’acido urico ha una solubilità in acqua di 3,57 ∙10‒5 M ed una costante acida Ka = 4,0 ∙10‒6. Calcolare il pH di una soluzione satura di acido urico (si trascurino altri equilibri).
A) 4,9
B) 5,8
C) 4,2
D) 8,4
soluzione
L’acido urico è un acido debole del tipo HA⇐⇒ H+ + A- per cui
Ka = [H+] [A-] / [HA] da cui si può ottenere [H+]² = Ka Ca [H+] = √Ka Ca
Pertanto nel caso in esame Ca corrisponde alla solubilità dell’acido in acqua (ricordiamo che è espressa in moli/L ) per cui [H+] = √ 4,0 x 10-6 x 3,57 x 10-5 = 12 x 10-6 M
PH = -log 12 x 10-6 = 6 – log 12 = 4,9
risposta corretta A
44. Qual è la particella x nella seguente reazione nucleare?
![]()
A) elettrone
B) protone
C) neutrone
D) fotone
soluzione
valutiamo la massa dei nucleoni scritti a sinistra della freccia: vediamo che l’Uranio ha massa 235 ed il neutrone n ha massa 1 pertanto la massa a sinistra in totale è 236.
Valutiamo adesso la massa dei nucleoni scritti a destra della freccia: vediamo che la massa del Kripto è 94 mentre quella del Bario è 139 . In totale la massa è 94+39 = 233
Si osserva che nella trasformazione nucleare vi è una differenza di massa pari a 236-233 = 3
Questa differenza di massa non può essere dovuta ai protoni in quanto si osserva che a sinistra il numero di protoni è 92 così come 92 è a destra.
Se non sono protoni, necessariamente i nucleoni che fanno la differenza di massa devono essere Neutroni.
Risposta corretta C
45. Una soluzione contiene sia SO42‒sia S2‒, entrambi a concentrazione 0,005 M. Indicare quale catione potrebbe essere utilizzato per separare SO42‒e S2‒, mediante precipitazione.
A) Sr2+
B) Pb2+
C) Na+
D) Mg2+
soluzione
esaminiamo i Kps dei solfati e dei solfuri degli ioni in esame:
SrSO4 2,8 10-7 SrS precipita solo a [Sr+2] elevate
PbSO4 1,8 10-8 PbS 3 x 10-28
Na2SO4 molto solubile in H2O non precipita
MgSO4 molto solubile in H2O non precipita
si osserva che il catione che serve a precipitare solo il solfato e non il solfuro in modo che SO4-2 ed S-2 possano essere separati è esclusivamente lo Sr+2.
Risposta corretta A
46. Il composto marcato con deuterio riportato sotto subisce deidroalogenazione con etossido di sodio formando il 3-metilcicloesene non deuterato. Quale delle seguenti affermazioni spiega correttamente questo risultato?

A) l’eliminazione di DBr è dovuta, per effetto isotopico, alla maggiore acidità del deuterio rispetto all’idrogeno.
B) l’eliminazione di DBr è in accordo con i requisiti del meccanismo E2, essendo la disposizione dei legami C-D
e C-Br anti-coplanare.
C) l’eliminazione di DBr consente di formare l’alchene più stabile.
D) l’eliminazione di DBr è in accordo con i requisiti del meccanismo E1, procedendo con la formazione del carbocatione più stabile.
soluzione
La reazione di eliminazione in cui il nucleofilo attacca un idrogeno beta piuttosto che il carbonio compete con la reazione di sostituzione nucleofila. L’eliminazione viene relativamente più favorita in presenza di basi forti come HO–, RO–,H2N– essendo queste ultime particolarmente reattive verso l’idrogeno. In questo caso l’etossido favorisce l’eliminazione.
Le reazioni di sostituzione nucleofila cineticamente del primo ordine e monomolecolari, sono caratterizzate da racemizzazione e riarrangiamenti ed il meccanismo prevede la formazione di un carbocatione.Esse vengono chiamate reazioni SN1, ma queste reazioni sono sempre accompagnate in qualche misura da β- eliminazione che segue anch’essa una cinetica del primo ordine, procede attraverso un intermedio carbocationico e viene chiamata E1.
L’etossito di sodio che agisce da nucleofilo ha sia la possibilità di attaccare il carbocatione che rimuovere un idrogeno in β rispetto al carbocatione per produrre un alchene. Se la base può attaccare due idrogeni non equivalenti in β, l’atomo di idrogeno che si stacca è di solito quello che porta all’alchene più ramificato (regola di Zaitsev).
La β eliminazione si osserva anche quando le reazioni avvengono con un meccanismo SN2 ed in tal caso sono chiamate reazioni E2. L’eliminazione E2 è concertata, nel senso che è contemporanea alla formazione del doppio legame quindi la reazione E2 , non passando attraverso un carbocatione, non è accompagnata da riarrangiamenti come accade nella E1.Basi forti e solventi poco polari fanno prevalere i processi E2 e SN2 rispetto ai processi E1 e SN1 e generalmente l’E2 prevale sull’SN2.
La reazione E2 è stereospecifica come dimostrato sperimentalmente con atomi di H sostituiti con Deuterio ed è accertato che si verifichi una trans eliminazione cioè vengono eliminati l’alogenuro e l’idrogeno che non è complanare ad esso ma in posizione trans.
Da quanto esposto è evidente che si ha una trans eliminazione in quanto il deuterio è in trans rispetto al Br .
La risposta corretta è pertanto B
47. Quale diene e dienofilo si devono utilizzare nella sintesi di Diels-Alder del seguente composto?

A) 2,3-dimetil-1,3-butadiene e cis-butendiale
B) 2,3-dimetil-1,3-butadiene e trans-butendiale
C) 5,6-dimetil-1,3-cicloesadiene e trans-butendiale
D) 2-butino e trans-butendiale
soluzione

soluzione
La reazione di Diels–Alder è una reazione di cicloaddizione tra un diene coniugato ed un alchene recante gruppi elettron-attrattori che nella reazione è chiamato dienofilo.
Un esempio è il seguente

nel caso specifico per ottenere i composti di partenza dobbiamo considerare due parti della molecola ottenuta e quindi
 e
e 


2 1
I composti utilizzati sono il 2-3 -dimetil-1-3-butadiene (1) ed il transbuten-2- endiale (2)
risposta corretta B
48. Quale dei seguenti prodotti si può ottenere per reazione di 3,4-epossi-3-metilciclopentanolo con un solo equivalente di etilmagnesio bromuro, seguita da acidificazione?

soluzione
Questo quesito è stato annullato in quanto non si ottiene un prodotto tra quelli descritti bensì un polimero: infatti la reazione non si ferma all’alcossido in quanto 2 e più molecole condensano per ottenere un prodotto polimerico.


49. Tenendo conto dei requisiti di planarità e della regola di Hückel (4n+2 elettroni π), quali delle seguenti molecole è aromatica?

A) 2, 4, 5
B) 1, 3, 6
C) 2, 3, 4
D) 3, 4, 6
soluzione
Una molecola è aromatica quando presenta un sistema ciclico di orbitali ibridi SP2 che si trovano sullo stesso piano ( che formano legami π ) e contengono 4n+2 elettroni nel ciclo.
La molecola 1 ha 6 elettroni π di cui 4 elettroni provenienti da doppio legame e 2 dal C al vertice del pentagono ed è quindi aromatica
La molecola 2 ha 8 elettroni π di cui 6 provenienti da 3 doppi legami e 2 dall’ O ibrido Sp2 e quindi non è aromatica.
La molecola 3 ha 6 elettroni π provenienti da 3 doppi legami ed è aromatica
La molecola 4 non può essere aromatica perchè il sistema ha un atomo sp3 che non può formare legami π
La molecola 5 ha solo 4 elettroni π e quindi non è aromatica
La molecola 6 ha 14 elettroni π che è conforme al concetto di aromaticità in quanto n=3 e quindi 4 x 3 +2 = 14 pertanto è aromatica
Ne consegue che la risposta corretta è B (1,3,6)
50. Quale tra i seguenti composti è il prodotto della reazione di condensazione aldolica incrociata tra acetone e 2 equivalenti di benzaldeide in soluzione etanolica di NaOH ?

soluzione
Quando un enolo o un enolato si addiziona ad un carbonile di un’aldeide o di un chetone la reazione è nota come addizione aldolica. Quando si tratta un’aldeide contenente idrogeni in alfa al carbonile con un catalizzatore basico ( NaOH acquoso) si verifica una reazione di auto condensazione ma nel caso dell’acetone il gruppo chetonico è poco reattivo e non può condensare con se stesso. Nel caso del quesito, la base estrae un α-protone dell’acetone che , con la sua carica negativa attacca il C del gruppo aldeidico positivo della benzaldeide.( La benzaldeide non può reagire con se stessa perchè non possiede atomi di idrogeno in alfa)
Pertanto, l’acetone attacca il C del gruppo aldeidico per azione di OH- ed etanolo e si forma un idrossichetone

A questo punto viene eliminata una molecola di acqua e si forma

quest’ultimo, in presenza di OH- e di un’altra molecola di benzaldeide forma il composto C

risposta corretta C
51. La procedura sintetica denominata “sintesi malonica” permette di preparare acidi acetici sostituiti, utilizzando come reagente di partenza l’estere malonico (propandioato dietilico) e sfruttandone, nella fase iniziale, la particolare acidità. Individuare quale delle seguenti molecole può essere facilmente ottenuta mediante “sintesi malonica”.

soluzione
la molecola D è da escludere in quanto non possiede un gruppo COOH.
La sintesi malonica è un tipo di sintesi utilizzata per preparare derivati mono- e di-sostituiti dell’acido acetico. La prima fase della reazione è la formazione di un anione ( estere sodio-malonico, stabile per risonanza) ottenuto per azione di una base forte (ad esempio etossido di sodio EtONa ) sul malonato di etile

Con un alogenuro alchilico ad es RX si ha la reazione seguente:

nel nostro quesito usiamo l’anione malonico e lo mettiamo a reagire con cloro propene-1
 questo composto viene fatto reagire ancora con ETONa e si ha l’anione
questo composto viene fatto reagire ancora con ETONa e si ha l’anione
 questo a sua volta vien fatto reagire con CH3-CH2-Cl e si ha la reazione
questo a sua volta vien fatto reagire con CH3-CH2-Cl e si ha la reazione


La reazione pertanto porta al composto C
52. La sintesi del toliprololo è mostrata nel seguente schema. Individuare la struttura del toliprololo tra quelleproposte:

soluzione
Essendo il fenolo acido, con NaOH si forma il fenolato e la reazione procede secondo lo schema seguente:

Il composto ottenuto è D
53. Una trasposizione sigmatropica è una reazione intramolecolare in cui si rompe un legame σ nel reagente, si forma un nuovo legame σ nel prodotto e gli elettroni π subiscono un riarrangiamento. Il legame σ che si rompe può essere un legame C-H, C-C, oppure C-O, C-S, C-N. Individuare quale tra le seguenti reazioni è una trasposizione sigmatropica:

![]()
soluzione
La reazione A comporta la formazione di un legame σ per formare il ciclo, ma non si ha alcuna rottura di altro legame quindi la reazione non è sigmatropica.
La reazione B così come la reazione D sono reazioni di addizione al doppio legame con formazione di legami sigma, tuttavia anche in questo caso nessun legame sigma viene rotto quindi anche queste reazioni non sono sigmatropiche.
La reazione C è invece una reazione sigmatropica in cui si spezza un legame sigma e se ne forma un altro secondo quanto descritto:

risposta corretta C
54. L’idrolisi totale di un grasso otticamente attivo produce acido palmitico (C16) in quantità doppia rispetto all’acido stearico (C18). Individuare la struttura del grasso:


soluzione
Contiamo il numero di atomi di C degli acidi nelle molecole A,B,C,D ed osserviamo che :
nella molecola A l’acido che è nella parte superiore ha 18 atomi di C (16 CH2 + 1 CH3 + 1 COO-), quello nella parte centrale ha 16 atomi (14 CH2 + 1 CH3 + 1 COO-) e quello nella parte inferiore ha 18 atomi di C (16 CH2 + 1 CH3 + 1 COO-). Questa potrebbe essere la risposta ma continuiamo.
La molecola B ha nella parte superiore 16 atomi di C (14 CH2 + 1 CH3 + 1 COO-), nella parte centrale 18 atomi di C (16 CH2 + 1 CH3 + 1 COO-) e nella parte inferiore 16 atomi di C (14 CH2 + 1 CH3 + 1 COO-). Anche questa molecola potrebbe essere la soluzione.
La molecola C possiede invece nella parte superiore ed in quella centrale 18 atomi di C (16 CH2 + 1 CH3 + 1 COO-) e nella parte inferiore 16 atomi di C (14 CH2 + 1 CH3 + 1 COO-), quindi è da escludere.
La molecola D presenta invece 1 solo acido grasso che si trova nella parte centrale, mentre nella parte superiore ed inferiore manca il carbonile acido per cui questa molecola è da escludere.
In definitiva le molecole che possono essere all’origine degli acidi ottenuti sono la A e la B.Per decidere quale delle due sia la soluzione corretta al quesito sappiamo che il grasso originario è otticamente attivo e questa proprietà la si osserva solo in molecole in cui vi è un atomo di C asimmetrico. Tra le molecole A e B quella B è simmetrica mentre A è asimmetrica infatti se consideriamo il piano che divide in due la molecola notiamo che in B è sovrapponibile mentre A non lo è .
Risposta corretta A
55. Confrontando le velocità delle due reazioni di sostituzione nucleofila mostrate sotto, si verifica che la reazione 1 è molto più veloce della 2. Quale tra le seguenti affermazioni spiega tale comportamento?

A) l’azoto esercita un effetto coniugativo elettron-attrattore che rende più elettrofilo il carbonio legato al cloro, facilitando la sostituzione.
B) la maggiore velocità della reazione 1 dipende da una più favorevole disposizione spaziale del reagente contenente l’azoto.
C) il meccanismo comporta la formazione di un intermedio in cui l’azoto agisce da catalizzatore nucleofilo, facilitando la sostituzione.
D) la basicità dell’azoto fa aumentare in soluzione la concentrazione degli ioni OH‒, facilitando così la sostituzione.
soluzione
La risposta A è palesemente errata in quanto la coniugazione elettronica presuppone la presenza di orbitali ibridi SP2 che però non si riscontra nella molecola contenente l’azoto. La velocità maggiore invece dipende dal doppietto elettronico libero dell’azoto (SP3) che attira il protone dell’H2O rendendo così più disponibile (perchè reso leggermente positivo) l’attacco al C in cui vi è il Cloro.
La risposta B è errata perché le due molecole hanno la stessa disposizione spaziale degli atomi.
La risposta D è anch’essa errata perchè la reazione non dipende dalla quantità di OH- in soluzione ma dall’effetto induttivo di N.
La risposta C è la risposta corretta in quanto è proprio in doppietto elettronico dell’Azoto che agisce come un catalizzatore.
56. Quando il D-aldoesoso X è trattato con HNO3 si ottiene un acido aldarico otticamente inattivo. La degradazione di Ruff dell’aldoesoso X produce un aldopentoso, che ossidato con HNO3 fornisce un acido aldarico otticamente inattivo. Individuate la struttura dell’aldoesoso X

Soluzione
lo zucchero D ha una struttura di tipo Levo (L) e non Destro (D) pertanto è da escludere.
Poichè si ottiene un prodotto otticamente inattivo, la struttura dello zucchero deve essere simmetrica e ciò ci permette di scartare anche il composto B che è asimmetrico.
Infine sappiamo che la degradazione di Ruff elimina l’atomo di C all’estremità superiore dello zucchero e quindi i gruppi OH che rimangono devono essere D e simmetrici . Se osserviamo la molecola di zucchero C vediamo che non possiede gli OH nella parte superiore simmetrici quindi è da scartare.
La molecola che risponde al quesito è quella dello zucchero A.
57. Un composto incognito, contenente solo C, H e O, mostra, nello spettro IR, una banda larga di assorbimento tra 3200-3500 cm-1. Reagisce con bromuro di metilmagnesio liberando metano. Lo spettro di massa EI mostra uno ione molecolare poco intenso a 116 m/z e il picco di un frammento a 98 m/z. Cosa rivelano queste informazioni?
A) la presenza di un gruppo alcolico
B) la presenza di una funzione eterea
C) la presenza di un carbonile chetonico
D) la presenza di un gruppo amminico
soluzione
Sappiamo che lo stretching del gruppo OH produce un assorbimento nella zona IR tra 3200-3500 cm-1 il che denota la presenza di OH
Il reattivo CH3MgBr reagisce con l’idrogeno del gruppo alcolico staccando l’OH e formando CH4 ed un alcossido RO-
Infine i dati di spettrometria di massa ad impatto di elettroni ( EI ) indicano la frammentazione della molecola fornendo due picchi con un rapporto m/Z = 116 e un picco con m/Z pari a 98, e ciò significa che la molecola spezzandosi ha eliminato H2O infatti 116 -98 =18 .
Il composto è quindi un alcol
risposta corretta A
58. I valori di chemical shift dell’idrogeno legato al C-4 negli spettri 1HNMR di nitrobenzene (1), toluene (2) e anilina (3) sono (in ordine sparso) 6,52, 7,06 e 7,65 ppm. Sulla base di considerazioni elettroniche attribuisci a ciascun composto il corrispondente valore di chemical shift.
A) 6,52 (1) 7,06 (2) 7,65 (3)
B) 7,65 (1) 7,06 (2) 6,52 (3)
C) 7,06 (1) 6,52 (2) 7,65 (3)
D) 7,65 (1) 6,52 (2) 7,06 (3)
soluzione

La risonanza dovuta ai gruppi nitro ed ammino, crea in para al benzene parziali cariche sul C .
Nel nitrobenzene l’idrogeno in para è quindi impoverito di elettroni che si spostano verso il C, e ciò comporta che l’idrogeno sente con più forza il campo magnetico applicato risuonando a frequenze maggiori (7,65) rispetto al toluene.
Nell’anilina si ha l’effetto inverso cioè , l’idrogeno attira di più gli elettroni e sente di meno il campo magnetico applicato risuonando a frequenze minori (6,52) rispetto al toluene.
Risposta corretta B
59-L’idrogenazione catalitica del limonene produce l’1-isopropil-4-metilcicloesano. Trattando il limonene con ozono e poi con zinco in acido acetico, si isolano formaldeide e il seguente composto:

soluzione
la reazione di ozonizzazione potrebbe attaccare qualsiasi dei due doppi legami dei terpeni proposti, ma risolo uno forma il prodotto suggerito, infatti solo il composto A può fornire il risultato richiesto:



Risposta corretta A
60. Un composto incognito ha formula molecolare C3H6O2. Ha un unico gruppo funzionale che assorbe all’IR tra 3200-3500 cm-1, e nella sua struttura nessun carbonio lega più di un atomo di ossigeno. Inoltre può esistere in due sole forme stereoisomeriche. Individuare la struttura del composto incognito

soluzione
Il gruppo funzionale è un gruppo OH che assorbe nell’IR tra 3200 e 3500 cm-1 e tutte le molecole possiedono il gruppo OH. Le molecole B e C possiedono un atomo di C che si lega a due atomi di O in quanto emiacetali. Le possibili molecole sono quindi A e D ma il dato che possano esistere due forme stereomeriche ci indica che la possibilità di formare due composti è esclusiva del composto D e non di A perchè il sostituente nel ciclo può trovarsi sopra o sotto il piano, pertanto la risposta corretta al quesito è D.
Lascia un commento