1. Un nastrino di magnesio di 48,6 g viene sciolto in un eccesso di acido solforico. Il gas che si forma viene fatto reagire quantitativamente con un eccesso di ossigeno molecolare. Indicare la sostanza che si forma in quest’ultima reazione e la sua quantità:
A) SO3; 80,1 g
B) SO3; 160,2 g
C) H2O; 18,0 g
D) H2O; 36,0 g
Soluzione
L’acido solforico reagisce con il magnesio formando solfato di magnesio MgSO4 secondo la reazione:
Mg + H2SO4 → MgSO4 + H2
Il gas H2 che si sviluppa viene fatto reagire con O2 in eccesso e forma H2O.Il composto ottenuto è quindi l’acqua la quantità ottenuta è calcolata dalla reazione di cui sopra.Infatti da 1 mole di Mg si ottiene 1 mole di H2 quindi da 48,6 / 24,3 = 2 moli di Mg si ottengono 2 moli di H2 ed ovviamente 2 moli di H2O che corrispondono a 2 x 18 = 36 g di H2O.
risposta corretta D
2. Indicare il numero di molecole di ossigeno che reagiscono con 53,96 g di alluminio per ottenere l’ossido di alluminio.
A) 6,022 ∙1023
B) 9,033 ∙1023
C) 18,07 ∙1023
D) nessuna delle precedenti opzioni è corretta
Soluzione
la reazione di formazione dell’ossido di alluminio è :
3[O2 + 4 e‒ → 2 O‒2
4[Al → Al3+ + 3 e‒
___________________
3 O2 + 4 Al → 2Al2+3 + 6O-2
La reazione è pertanto 3O2 + 4Al → 2Al2O3
Si deduce che per 4 atomi di Al (4 x 26,98 ) occorrono 6 di O (6 x 16) quindi per 53,96 g ne occorrono X 107,92 : 96 = 53,96 :X X= 48 g di O cioè 1,5 moli di O
se in 1 mole vi sono 6,02 x 1023 molecole in 1,5 ve ne sono X
X= 9,03 x 1023 molecole
risposta corretta B
3. Indicare i coefficienti stechiometrici (in ordine sparso) necessari per bilanciare la seguente reazione:
P4O6 + Al + HCl ⇆ PH3 + AlCl3 + H2O
A) 1, 2, 4, 8, 8, 8
B) 2, 2, 6, 6, 8, 8
C) 2, 4, 4, 6, 6, 24
D) 1, 4, 6, 8, 8, 24
soluzione
Questa è una ossidoriduzione, le due semireazioni sono:
3[4 P3+ + 24 e‒ → 4 P3‒
24[Al → Al3+ + 3 e‒
cioè
1 [4 P3+ + 24 e‒ → 4 P3‒
8 [Al → Al3+ + 3 e‒
______________________
4P+3 +8 Al → 4 P-3 + 8 Al+3
la reazione è pertanto P4O6 + 8 Al + 24 HCl → 4 PH3 + 8 AlCl3 + 6 H2O
I coefficienti sono 1,8,24,4,8,6
Risposta corretta D
4. Il dottor McCoy sta analizzando le energie di ionizzazione di una sostanza elementare. Queste sono:
1a: 786,5 kJ/mol; 2a : 1577,1 kJ/mol;
3a: 3231,6 kJ/mol; 4a: 4355,5 kJ/mol;
5a: 16091 kJ/mol; 6a: 19805 kJ/mol;
7a: 23780 kJ/mol; 8a : 29287 kJ/mol.
Ne deduce che il gruppo di appartenenza è il seguente:
A) 2
B) 13
C) 14
D) 15
soluzione
L’energia di ionizzazione di un atomo è la minima energia richiesta per allontanare un elettrone e portarlo a distanza infinita, a 0 K e in condizioni energia cinetica nulla. Quindi l’energia necessaria per far avvenire il seguente processo:
-
- X(g) → X+(g) + e− I1
L’energia per staccare il primo elettrone si definisce di prima ionizzazione e quindi di seconda ionizzazione,terza ionizzazione ecc. e si indicano con EI1 EI2 ecc.
-
- X+(g) → X2+(g) + e− EI2
-
- X2+(g) → X3+(g) + e− EI3
Dai dati del quesito si osserva che l’aumento di EI del doppio sino alla quarta ionizzazione ma il valore della quinta ionizzazione ha un valore di molto superiore alla quarta ( EI4: 4355,5 kJ/mol; EI5 : 16091 kJ/mol) .Questo significa che gli elettroni esterni dell’atomo devono essere 4 in quanto il quinto elettrone deve essere più interno e quindi essendo più vicino al nucleo ne risente di più l’attrazione e pertanto, per essere staccato, necessita di maggior energia rispetto ai primi 4 elettroni. L’atomo con 4 elettroni esterni deve quindi appartenere al gruppo 14.
risposta corretta C
5. Uno studente sta pesando 0,5080 g di iodio, che appare sotto forma di cristalli viola. A quante moli di iodio corrisponde tale massa?
A) 2,00 mmol
B) 4,00 mmol
C) 2,00 mol
D) 4,00 mol
5. Soluzione
Lo iodio molecolare I2 esiste sotto forma di cristalli di color viola.Il PM = 2 ∙ 126,9 = 253,8 g
Le moli che corrispondono a 0,508 g sono: n = 0,508 / 253,8 = 2 x 10-3 moli= 2 mmoli
Risposta corretta A
6. Indicare i coefficienti stechiometrici (in ordine sparso) necessari per bilanciare la seguente reazione:
Ca3(PO)4 + SiO2 + C ⇆ P4 + CaSiO3 + CO
A) 1, 2, 2, 6, 6, 10
B) 1, 2, 6, 6, 10, 10
C) 2, 6, 6, 10, 10, 10
D) 2, 2, 6, 6, 10, 10
soluzione
si tratta di una reazione redox in cui il P si riduce da +5 (in P2O4-2) a 0 (P), il C si ossida da 0 a +2 e le semireazioni sono:
2[4 P5+ + 20 e‒ → 4 P cioè 1 [4 P5+ + 20 e‒ → 4 P
20[C → C2+ + 2 e 10[C → C2+ + 2 e
quindi si ha
4 P+5 + 10 C → 4P° + 10 C+2
la reazione è pertanto 2 Ca3(PO4)2 + 6 SiO2 + 10 C → 6 CaSiO3 + 10 CO + P4
I coefficienti sono 2,6,10,6,10,1
Risposta corretta B
7. Indicare le molecole disposte in ordine crescente di angolo di legame:
A) BH3 CH4 NH3 H2O
B) CH4 NH3 BH3 H2O
C) H2O NH3 CH4 BH3
D) CH4 BH3 NH3 H2O
Soluzione
Per giustificare alcune proprietà delle molecole ed in particolare per spiegare la formazione degli angoli di legame si ricorre alla teoria dell’ibridizzazione. Sappiamo che ogni atomo N,C,O,B possiede orbitali di tipo s,p,d,f ma la loro disposizione spaziale non può dare origine ad angoli di legame che si osservano nei composti che il quesito propone. Effettuiamo allora un semplice procedimento matematico sulle funzioni d’onda che rappresentano gli orbitali atomici e chiamiamo questo procedimento “Ibridizzazione”. Con questo procedimento creiamo orbitali definiti orbitali ibridi ed il numero di ibridi che si formano è uguale al numero di orbitali che utilizziamo nel procedimento. Un orbitale ibrido è in realtà una combinazione lineare di orbitali atomici (somma di orbitali atomici) che è anch’essa soluzione dell’equazione di Schrodinger. La forma di un orbitale ibrido è quindi del tipo
Ψ= aS + bX + cY + Cz o meglio Ψ=as + √aS-a2 P
dove a,b,c,d rappresentano il contributo degli orbitali atomici fornito per la combinazione (cioè a rappresenta la parte di orbitale s ceduta all’ibrido, b,c,d, la parte di orbitali P ceduti all’ibrido) ed in cui P è un orbitale 2P. L’angolo θ tra due orbitali ibridi i ed j dipende dai valori di b,c,d con cui gli orbiati atomici P contribuiscono all’ibrido ed è dato da :
cos θij = bibj +cicj+ didj / √bi2 +ci2 +di2 √bj2+cj2 +dj2
dove a,b,c,d sono i coefficienti della combinazione lineare degli orbitali atomici.
Naturalmente mentre nel metano gli ibridi sono ad energia uguale ad es t1=t2=t3=t4 quindi i parametri a1=a2=a3=a4 l’ibridizzazione è detta simmetrica e ne risulta un angolo di 109°,28′ ; nell’NH3 uno degli orbitali ibridi è diverso per cui si ha t1,=t2,=t3 ma t4 è differente ne risulta dai calcoli che cos θij = -0,294 che corrisponde ad un angolo di 107°.
L’H2O a sua volta ha un’ibridizzazione asimmetrica degli orbitali dell’ossigeno con due orbitali uguali a coppie e l’angolo dei legami è diverso. Infatti due degli orbitali hanno un doppietto elettronico libero mentre altri due no. Questo comporta che l’ angolo tra i due atomi di idrogeno è ancora più piccolo di quello dell’ NH3 (105°)
Per spiegare gli angoli che il Boro forma in BH3 bisogna combinare 1 orbitale s e 2 soli degli orbitali P del Boro e quindi in questo caso si formano 3 orbitali ibridi e l’ ibridizzazione è definita di tipo SP2 .In questo caso il valore dell’angolo θ tra gli orbitali SP2 risultano essere di 120°.
Da quanto espresso sopra, l’ordine crescente dell’angolo di legame è H2O 105°, NH3 (107), CH4 (109,8), BH3(120)
risposta corretta C
8. L’Economia Atomica (Atom Economy, AE) è un metodo con misurare la sostenibilità di una
reazione e fu introdotta con la nascita della Green Chemistry. Essa è una misura di quanti atomi,
contenuti nei reagenti, finiscano efficacemente nei prodotti. L’AE si misura mediante la formula:
AE = 100 ∙ (massa molare del prodotto desiderato x coefficiente stechiometrico)/(somma delle masse molari dei reagenti, ognuno moltiplicato per il suo coefficiente stechiometrico).
Più è alta questa percentuale e meno atomi andranno sprecati in prodotti indesiderati, generando così una minore quantità di sottoprodotti. Un chimico dovrebbe progettare le sue reazioni in modo da massimizzare questo valore (oltre a rispettare gli altri 11 principi della Green Chemistry). Tra le seguenti reazioni quantitative, indicare quella che produce solfato di calcio (prodotto desiderato) con efficienza atomica più alta.
A) H2SO3 (aq) + Ca(OH)2 (aq) → CaSO3 (aq) + 2 H2O (l)
B) Ag2SO3 (aq)+ CaCl2 (aq) → CaSO3 (aq) + 2 AgCl (s)
C) H2SO4 (aq) + Ca(OH)2 (aq) → CaSO4 (aq) + 2 H2O (l)
D) Ag2SO4 (aq) + CaCl2 (aq) → CaSO4 (aq) + 2 AgCl (s)
soluzione
Le reazioni A e B possono essere eliminate perchè il solfato di Calcio ha formula CaSO4
Nella reazione C i prodotti ottenuti sono CaSO4 e 2 H2O,
Nella reazione D i prodotti sono CaSO4 e 2 AgCl, che pesano molto più dell’H2O
L’’economia atomica AE, è:
AE = 100 ∙ PMprodotto / ( aPMreagente1 + bPMreagente2)
dove a e b rappresentano i coefficienti stechiometrici, pertanto nel nostro caso si ha:
Reazione C: AE = 100 ∙ 136 / (98 + 74) = 79%
Reazione D: AE = 100 ∙ 136 / (371 + 111) = 28%
Da questi dati si evince che il Valore di Economia Atomica maggiore è dato dalla reazione C
Risposta corretta C
9. Indicare la sequenza di numeri quantici che può descrivere l’elettrone di un orbitale 3d:
A) n = 4, l = 4, ml = +2, ms = +l/2
B) n = 4, l = 3, ml = ‒2, ms = +l/2
C) n = 3, l = 2, ml = +2, ms = +l
D) n = 3, l = 2, ml = ‒2, ms = +1/2
soluzione
Sappiamo che la funzione d’onda Ψ che rappresenta un orbitale è soluzione dell’equazione di Schrodinger HΨ = EΨ solo quando i numeri quantici che in essa compaiono assumono valori ben definiti ed in relazione tra loro: infatti:
n =numero quantico principale deve avere valori interi da 1 a infinito
l= numero quantico angolare deve avere tutti i valori compresi tra 0 ed n-1
m= numero quantico magnetico deve avere valori compresi tra +l,0,-l
s = numero quantico di Spin, può assumere solo valori +1/2 e -1/2
Pertanto quando n =1 il valore di l è uno solo e deve essere l = n-1= 0. Ogni volta che abbiamo un valore di l=0 si ha un orbitale simmetrico di tipo s .In questo caso, essendo n= 1 si ha l’orbitale Ψ1s
quando n= 2 i valori di l possono essere 2 cioè l=0 ed l= 1
Quando l=0 come sappiamo si ha un orbitale simmetrico Ψ2s (ricorda che 2 rappresenta il valore di n)
Poichè si ha anche l=1 allora vi sono gli stati m che sono tanti quanti sono i numeri compresi tra + l,0,-l ed in 1questo caso m= +1 m=0, m=-1
I tre stati corrispondono ad orbitali di tipo P Ψ2px Ψ2py Ψ2pz (ricorda che n=2)
Qando n=3 i valori di l possono essere tre e cioè l=0 e sappiamo che se l=0 abbiamo lo stato Ψ3s l=1 ed in questo caso abbiamo 3 stati Ψ3px Ψ3py Ψ3pz (ricorda che n=2) quando l=2 abbiamo che i valori di m possono essere 5 cioè m=+2, m=+1, m=0, m=-1, m=-2 ed ognuno di essi è uno stato d cioè riassumendo si hanno i cinque orbitali Ψd seguenti:

Da quanto esposto, le risposte A,B, sono errate e la risposta al quesito potrebbe sembrare la C; ma l’ultimo numero quantico s leggiamo che ha valore 1 cioè lo spin=1 ma noi sappiamo che il numero quantico s di un elettrone può assumere solo uno dei due valori cioè +1/2 oppure -1/2 pertanto la risposta C è da escludere.
Si deduce che la risposta corretta è D
10. Completare la seguente espressione:
L’emissione di una particella β¯ da parte del nucleo di un atomo comporta…
A) un aumento di una unità del numero atomico
B) una diminuzione di una unità del numero atomico
C) un aumento di una unità del numero di massa
D) una diminuzione di quattro unità del numero atomico
soluzione
La particella β¯ è un elettrone emesso dal nucleo (emissione beta) ed in particolare da un neutrone che a sua volta si trasforma in un protone, protone che ha una carica positiva. Questo processo è detto decadimento Beta e determina l’aumento di un protone e la diminuzione di un neutrone.Dato che la massa del protone è uguale a quella del neutrone è evidente che il numero di massa rimane costante mentre il numero atomico aumenta di un’unità per l’aumento del numero di protoni.
Risposta corretta A
11. In un recipiente vengono posti 18 g di idrogeno e 56 g di azoto affinché reagiscano per dare
ammoniaca secondo la reazione da bilanciare: H2 + N2 ⇆ NH3
Indicare l’affermazione corretta:
A) l’idrogeno è il reagente in eccesso.
B) l’azoto è il reagente in eccesso.
C) i reagenti sono in quantità stechiometriche esatte.
D) la resa teorica è di 74 g di ammoniaca.
11. Soluzione
La reazione è la seguente: 3 H2 + N2 → 2 NH3
da questa si osserva che per ogni mole di N occorrono 3 moli di H.
56 g di N corrispondono a 56/28= 2 moli di N
18g di H corrispondono a 18/2 = 9 moli di H
Dalla reazione si evince che per 2 moli di N servirebbero 6 moli di H quindi avendo invece 9 moli di H è chiaro che è questo l’elemento in eccesso.
risposta corretta A
12. Indicare il legame covalente più polare:
A) legame H‒F
B) legame B‒F
C) legame C‒F
D) legame O‒F
soluzione
Quando un legame covalente si forma tra due atomi che presentano un diverso valore di elettronegatività, la nube degli elettroni che costituiscono il legame è più concentrata sull’atomo più elettronegativo. Si forma quindi nella molecola un dipolo permanente ed il momento di dipolo (che si indica generalmente con μ ) è dato dal prodotto della carica per la distanza di legame e si misura in coulomb·metro. Se la differenza di elettronegatività tra due atomi è minore di 1,9 il legame si definisce covalente polare.
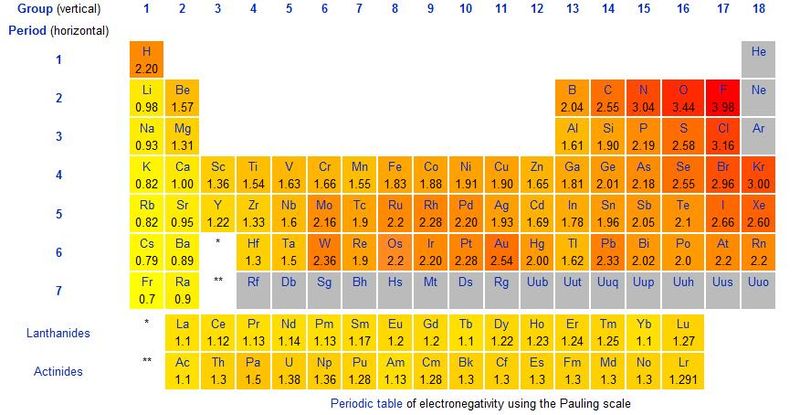
Tra gli atomi proposti l’atomo con maggiore negatività(secondo Pauling) è il Fluoro ( 3,98D), il boro ha un valore 2,04 mentre il C e l’ossigeno possiedono rispettivamente un valore di 2,55 e 3,44.
Da questi dati possiamo concludere che il legame più polare tra quelli proposti è B-F I
Risposta corretta B
13. Individuare la massa di rutenio costituita da 1,204 ∙1021atomi.
A) 202,0 g
B) 202,0 mg
C) 101,0 g
D) 101,0 mg
Soluzione
Sappiamo che in una quantità pari alla massa atomica (Peso Atomico) cioè 101 g sono contenute
6,02 x 1023 atomi, quindi in una quantità paria X vi saranno 1,204 ∙1021atomi.
101 : 6,02 x 1023 = X : 1,204 ∙1021
X= 202 g
Risposta corretta B
14. Indicare l’elemento che forma con il cloro il legame covalente più polare:
A) Li
B) K
C) Ce
D) nessuna delle precedenti opzioni è corretta
Soluzione
Quando un legame covalente si forma tra due atomi che presentano un diverso valore di elettronegatività, la nube degli elettroni che costituiscono il legame è più concentrata sull’atomo più elettronegativo. Si forma quindi nella molecola un dipolo permanente ed il momento di dipolo (che si indica generalmente con μ ) è dato dal prodotto della carica per la distanza di legame e si misura in coulomb·metro.

Se la differenza di elettronegatività tra due atomi è minore di 1,9 il legame si definisce covalente polare altrimenti il legame ha carattere ionico. Nel caso in esame vediamo dalle tabelle di elettronegatività che il cloro ha elettronegatività 3,16 ,mentre Li(0,98); K(0,82); Ce(1,12).
Vediamo che la differenza di elettronegatività tra LiCl, KCl, CeCl sono rispettivamente:
2,18 ; 2,34 ; 2,04 . Questo significa che il legame è certamente ionico e non covalente.
Risposta corretta D
15. Indicare il legame polarizzato mostrato in maniera corretta:
A) Hδ+‒ Mgδ‒
B) Iδ+‒ Clδ‒
C) Iδ‒‒ Clδ+
D) Oδ‒‒ Fδ+
soluzione
Guardando la tabella

possiamo osservare che l’idrogeno (2,2)è più elettronegativo del magnesio(1,3) quindi la risposta A è errata.
Il cloro(3,16) è più elettronegativo dello iodio(2,66) pertanto la risposta B è corretta
Il cloro è più elettronegativo dello iodio per cui la risposta C è errata
Il fluoro(3,98) è più elettronegativo dell’ossigeno(3,44) per cui la risposta D è errata
Risposta corretta B
16. Indicare la molecola in cui è presente almeno un legame doppio:
A) Cl2O
B) ONF
C) SbH3
D) SCl2
soluzione
La presenza di un doppio legame indica che due atomi sono uniti da un orbitale σ e da un orbitale di tipo π. Secondo la teoria della valenza ciò presuppone una ibridizzazione degli orbitali atomici di tipo SP2.
La molecola di Cl2O possiede una struttura simile a quella di H2O. In questo composto l’ossigeno usa orbitali ibridi SP3 che si dispongono secondo gli angoli di un tetraedro e due orbitali ibridi contengono gli elettroni spaiati dell’ossigeno. I due atomi di cloro formano due legami sigma con un angolo di 110° che è superiore a quello dell’H2O 105° perchè la repulsione tra i due atomi di Cl è nettamente superiore alla repulsione tra le due coppie di elettroni spaiati dell’ossigeno (In assenza di repulsioni come ad es. in molecole come il metano l’angolo SP3 è 109°)i.La molecola di SCl2 ha struttura simile a quella di Cl2O, e la molecola di BF3 è simile alla molecola di NH3 in cui si hanno legami sigma ed una struttura tetraedrica. Nella molecola di ONF invece,sia l’ossigeno che l’azoto utilizzano orbitali Sp2 e la molecola presenta un doppio legame tra i due atomi O=N che risuona col legame del Fluoro secondo la figura seguente
![]()
Risposta corretta B
17- Sulla base dell’analisi delle forze intermolecolari, identificare quale tra le seguenti sostanze ha il punto di ebollizione più elevato:
A) H2O
B) CH4
C) KCl
D) HCl
Soluzione
H2O, CH4 e HCl sono molecole con legami covalenti polari, e grazie ai momenti di dipolo si osservano tra le molecole sia legami dipolo-dipolo, sia legami idrogeno (vedi H2O) sia forze di van der waals. Nei cristalli ionici, i legami tra gli ioni si estendono per tutto il cristallo ionico quindi è necessaria un maggior energia per spezzare i legami del cristallo rispetto ai legami dipolo-dipolo , forze di vander waals e legami idrogeno. Infatti, sono necessarie temperature molto elevate affinché l’agitazione termica possa rompere i forti legami ionici.
Si evince che la risposta corretta è C
18. Secondo la teoria VSEPR, la geometria della specie chimica CH3+ è:
A) piramidale trigonale
B) a T
C) trigonale planare
D) nessuna delle precedenti opzioni è corretta
18. Soluzione
Sappiamo che la molecola CH4 è una molecola in cui il C utilizza orbitali ibridi SP3 con una disposizione spaziale tetraedrica ma in una molecola come il catione CH3+ il carbonio utilizza orbitali ibridi SP2 la cui struttura è planare con angoli di 120°.

Ogni orbitale ibrido forma un legame con un atomo di H mentre la carica positiva rimane sull’orbitale Pz non ibrido.
Secondo la teoria VESPR e la reagola AXE in questo caso la struttura è del tipo AX3 non essendoci alcuna coppia elettronica lone pair (solitaria) e pertanto la teoria prevede una struttura trigonale planare

Risposta corretta C
19. Indicare il numero di atomi di calcio che costituiscono un campione di carbonato di calcio dal peso di 200 mg.
A) 1,20 ∙1021 atomi di calcio
B) 1,20 ∙1024 atomi di calcio
C) 6,02 ∙1020 atomi di calcio
D) 6,02 ∙1023 atomi di calcio
Soluzione
Sappiamo che in una quantità in grammi peri al PM di una molecola vi sono 6,02 x 1023 molecole. Ne consegue che se in 100 g (PM CaCO3) vi sono 6,02 x 1023 molecole allora in 200 ve ne sono 3 x 6,02 x 1023 = 1,2 x 1021 molecole
Risposta corretta A
20. Indicare i coefficienti stechiometrici (in ordine sparso) necessari per bilanciare la seguente
reazione:
Fe2O3 + CO ⇆ Fe + CO2
A) 1, 2, 2, 3
B) 1, 2, 3, 3
C) 2, 2, 2, 3
D) 2, 2, 3, 3
soluzione
La reazione è una reazione redox e le due semireazioni sono:
2[2 Fe3+ + 6 e‒ → 2 Fe
6]C2+ → C4+ + 2 e‒
cioè
1[2 Fe3+ + 6 e‒ → 2 Fe
3]C2+ → C4+ + 2 e‒
_______________________
2Fe+3 + 3 C+2 → 2 Fe + 3 C+4
la reazione bilanciata è quindi :
Fe2O3 + 3 CO → 2 Fe + 3 CO2
I coefficienti sono : 1, 2, 3, 3
Risposta corretta B
21. Individuare il solido nella cui soluzione satura c’è la concentrazione di ioni OH‒ più elevata:
A) Sn(OH)4 (s)
B) Pb(OH)2 (s)
C) Cu(OH)2 (s)
D) Sn(OH)2 (s)
21. Soluzione
I valori di Kps tabulati sono:
Sn(OH)4 =1,0 ∙10‒57 Pb(OH)2 =2,8 ∙10‒16; Cu(OH)2 =1,6 ∙10‒19 Sn(OH)2 (2,0 ∙10‒26).
da questi dati è possibile calcolare [OH-]
Indicando con X la [OH-]
Sn(OH)4(s) ⇔ Sn4+ + 4 OH‒ Kps = [Sn4+] [OH‒]4
KPs= X x X4 = X5
Pb(OH)2 (s)⇔ Pb+2 + 2 OH- Kps= [pb+2] [OH-]2 Kps= X3
Cu(OH)2 (s)⇔ Cu+2 +2OH- Kps= [Cu+2][OH-]2 Kps = X3
Sn(OH)2 (s)⇔ Sn+2 + 2OH- Kps= [Sn+2] [OH-]2 Kps= X3
X=[OH‒] = 5√Kps = 5√1,0 ∙10‒57 = 6 x10-13
X=[OH‒] = 3√2,8 ∙10‒16= 1,4 x 10-2,51
X=[OH‒] =3√1,6 ∙10‒19 = 1,08 x 10-2,67
X=[OH‒] =3√2,0 ∙10‒26= 1,25 x 10-2,96
Il sale che produce la concentrazione di ioni OH‒ più elevata è, quindi, Pb(OH)2.
Risposta corretta B
22. Calcolare quante moli di NaBr si ottengono mettendo a reagire 3,00 moli di BrO2 (g) e 5,00 moli di NaOH(aq) secondo la reazione (da bilanciare):
BrO2(g) + NaOH(aq) → NaBr(aq) + NaBrO3(aq) + H2O(l)
A) 3,22 mol
B) 0,50 mol
C) 1,48 mol
D) 2,22 mol
soluzione
In questa reazione di dismutazione si hanno le due semireazioni:
Le due semireazioni sono:
1[Br+4 + 5 e‒ → Br‒
5[Br+4 + 6 OH+ → Br+5O3- + e‒ + 3 H2O
_______________
6BrO2 +6 OH- → 5BrO3- + Br- + 3 H2O
la reazione è quindi
6 BrO2 + 6 NaOH → NaBr + 5 NaBrO3 + 3H2O
da questa reazione si vede che da 6 moli di BrO2 si ottiene 1 mole di NaBr quindi da 3 moli si ottengono X moli X= 3/6 = 0,5 moli
Risposta corretta B
23. Individuare nella soluzione acquosa 0,1 M di quale sale la solubilità di AgBr(s) è minore:
A) NaCl
B) CaBr2
C) NaBr
D) AgNO
soluzione
NaCl non influenza la solubilità di AgBr mentre gli altri tre sali, per effetto dello ione a comune ne diminuiscono la solubilità. Essendo sali completamente solubili il sale che porta in soluzione più ioni in comune ad AgBr è CaBr2 incui [Br-]=0,2M
infatti se [Ca+2]=0,1 [Br-]= 2 [Ca+2]=0,2M
Risposta corretta B
24. Dai valori riportati nella tabella allegata dei potenziali redox standard, indicare quale dei seguenti composti non è stabile:
A) AuI3 (s)
B) LiMnO4 (s)
C) FeI2 (s)
D) NaBiO3 (s)
24. Soluzione
Ricordando che un elemento con E° più positivo o meno elettronegativo agisce da ossidante possiamo notare che Au+3 possiede un E°= 1,5 V. Lo Iodio ad esso legato ha un potenziale E°= 0,5V e questo rende instabile il composto AuI3 in quanto Au ossida I- ad I2 si avrà quindi la reazione spontanea
2 AuI3 → 2 Au + 3 I2.
Il ferro ha un E° Fe2+/Fe = -0,44 V inferiore a quello dello iodio e quindi lo iodio non potrà mai essere ossidato. Gli altri composti sono tutti stabili .
Risposta corretta A
25. Indicare l’ordine crescente di concentrazione dei cationi in tre soluzioni sature di Ag2SO4 (s),
BaSO4 (s) e Hg2SO4 (s).
A) [Ag+] < [Ba2+] < [Hg22+]
B) [Ba2+] < [Hg22+] < [Ag+]
C) [Hg22+] < [Ba2+] < [Ag+]
D) [Ba2+] < [Ag+] < [Hg22+]
soluzione
I Kps sono: Ag2SO4 (1,7 ∙10‒5); BaSO4 (1,1 ∙10‒10); Hg2SO4 (6,8 ∙10‒7)
Ag2SO4 → 2 Ag++ SO42-
Kps = [Ag+]2[SO42‒] =[Ag+]2 x 1/2 [Ag+]= 1/2 [Ag+]3
[Ag+] = ³√2 Kps=³√3,4 ∙10‒5
[Ag+] = 3,2 ∙10‒2 M
BaSO4 → Ba2+ + SO42‒ Kps = [Ba2+] [SO42‒] =[Ba2+]2 [Ba2+] =√Kps
[Ba2+] = √1,1 ∙10‒10
[Ba2+] = 1,0 ∙10‒5 M
Hg2SO4 → Hg22+ + SO42‒ [Hg22+] =√Kps [Hg22+] =√6,8 ∙10‒7
[Hg22+] = 8,2 ∙10‒4 M
Dai calcoli effettuati risulta che la concentrazione maggiore è quella di [Ag+] seguita da [Hg2+2] ed infine da [Ba2+] .
Risposta corretta B
26. Dalla liquefazione dell’aria si ottiene azoto liquido. Quale volume d’aria (a 295 K e a 1,01 ∙105
Pa) occorre liquefare per ottenere 1000,0 kg di N2 (l)? (l’aria contiene il 21,0% v/v di O2 ed il 79,0% v/v di N2)
A) 3500 m3
B) 1100 m3
C) 2500 m3
D) 8400 m3
soluzione
Il volume deve essere calcolato dall’equazione generale di stato dei gas PV= nRT
P= 1,01 x 105 Pa T=295 K V= X n= 1000 g/ 28 = 35,7 moli
Pertanto V= V = nRT/P V = 35,7 ∙103 ∙ 8,314 ∙ 295/1.01 ∙105=866,5 ∙m3
Tuttavia l’N2 nell’aria è contenuto al 79,0% quindi il volume di azoto è
Le moli di N52 in 1000 kg sono 106 g/28 g mol‒1 = 35,7 ∙103 mol. Queste occupano un volume in m3: V = nRT/P V = 35,7 ∙103∙ 8,314 ∙ 295/1.01 ∙105 V = 866,5 ∙m3 di N2 che corrispondono a
V= 866,5 ∙ 100/79 = 1100 m3 di aria.
Risposta corretta B
27. Il limite inferiore di infiammabilità del metano è uguale a 5,00% v/v (a 298 K e alla pressione di 1,01 ∙105Pa) ed è il valore minimo di concentrazione nell’aria per provocare un’esplosione. Quante bombole di metano da 400,0 L (a 298 K e 200,0 ∙105 Pa) devono essere svuotate in un capannone lungo 50,00 m, largo 10,00 m ed alto 9,51 m, affinché si raggiunga tale condizione di pericolo?
A) 5
B) 3
C) 13
D) 25
soluzione
Il volume del capannone è di 50 x 10 x 9,51 = 4755 m3
Il 5% di questo volume è 237,8 m3.
Per la legge di Boyle PV=K si ha V= K/V volume del gas della bombola necessario per riempire il capannone. Pertanto PcVc = PbVb
dove c si riferisce al gas del capannone e b si riferisce al gas della bombola.Da questa formula si ha: Vb = Pc Vc / Pb da cui sostituendo i valori :
Vb = 1,01 ∙105 237,8 / 200 ∙105 Vb = 1,2 m3= 1200 litri
siccome ogni bombola contiene 400 litri di gas allora occorrono 3 bombole infatti
3 x 400 = 1220 L
Risposta corretta B
28. La densità di un certo gas è 3,18 g/L. La densità dell’idrogeno, nelle stesse condizioni, è 0,090 g/L. Calcolare la massa molare del gas.
A) 71,2g/mol
B) 87,5 g/mol
C) 96,1 g/mol
D) 66,3 g/mol
Soluzione
per il gas H la densità= massa/Volume cioè dH =mH/VH
Per il gas X la densità è dx = mx/Vx
I due gas si trovano nelle stesse condizioni per cui dH/ dx = mH VH/ mx/Vx
se consideriamo volumi uguali di gas allora VH = Vx quindi dH/dx = mH /mx
dove m rappresentano le masse molari(peso molecolare) pertanto
mH=0,09 g /PMH mx = 3,18 /PMx da cui 0,09 /2,016 = 3,18/ PMx
PMx= 2,016 x 3,18/ 0,09 = 71,2
Risposta corretta A
29. In una soluzione di HCl 1 M, Sn2+ può reagire con Fe3+ secondo le reazioni
2 Fe3+(aq) + Sn2+(aq) ⇆ 2 Fe2+(aq) + Sn4+(aq)
2 Fe3+(aq) + 3 Sn2+(aq) ⇆ 2 Fe (s) + 3 Sn4+(aq)
La reazione produce Fe2+(aq) e non Fe (s). Fornire una spiegazione.
A) Sn2+(aq) non è un riducente forte
B) Sn2+(aq) non è un ossidante forte
C) Sn2+(aq) è un riducente forte
D) Sn2+(aq) è un ossidante forte
soluzione
per rispondere a questo quesito dobbiamo valutare i Valori di E° per le rispettive reazioni:
Fe3+(aq) + e- ==> Fe2+(aq) E°= 0,771 V
Fe2+(aq) + 2 e- ==> Fe(s) E°= -0,44 V
Sn4+(aq) + 2 e- ==> Sn2+(aq) E°= 0,15 V
Sappiamo che :
1-l’elemento con E° più positivo (o meno negativo) agisce da ossidante
2-l’elemento con E° più negativo (o meno positivo) agisce da riducente
Valutando i dati di E° vediamo che lo stagno ha un E° = 0,15 V che è meno positivo della coppia
Fe3+(aq) + e- ==> Fe2+(aq) E°= 0,771 V quindi agisce su Fe+3 riducendolo ad Fe+2
la coppia Fe2+(aq) + 2 e- ==> Fe(s) ha un valore di E°= -0,44 V
quindi lo Stagno non può mai ridurre il Fe+3 ad Fe(s) perchè questa coppia ha un E° maggiore di quella dello stagno (perchè la riduzione potesse avvenire, la coppia dello stagno avrebbe dovuto avere un E° < -o,44 V).
Risposta corretta A
30. Quante moli di acido nitrico sono necessarie per ottenere 25,00 moli di zolfo, secondo la reazione (da bilanciare):
P2S3(s) + HNO3(aq) + H2O(l) ⇆ H3PO4(aq) + S(s) + NO(aq)
A) 34,0 mol
B) 11,0 mol
C) 27,8 mol
D) 18,9 mol
soluzione
la reazione redox è la seguente :
10[NO3- + 3 e‒ + 4H+ → NO + 2H2O
3[3S-2 → 3 S + 6 e
3[2P +3 + 8H2O →2 PO4-3 + 16H+ +4 e ___________________________________________________
10NO3- + 9 S-2 + 6P+3 + + 4H2O→ 10NO + 9S + 6PO4-3 +8H+
quindi
10NO3- + 9 S-2 + 6P+3 + 4H2O → 10NO + 9S + 6PO4-3 + 8 H+
3 P2S3(s) + 10 HNO3(aq) + 4 H2O(l) ⇆ 6 H3PO4(aq) + 9 S(s) + 10 NO(aq)
Pertanto se da 10 moli di HNO3 si ottengono 9 moli di S da X moli se ne ottengono 25,0
X= 10 x 25 / 9= 27,8
Risposta corretta C
31. Nella figura seguente i becher contengono volumi uguali di una stessa soluzione. Aggiungendo le due soluzioni indicate si ottengono gli effetti riportati. Consultando la tabella delle costanti di solubilità, indicare che cosa c’è nella soluzione.

A) [OH‒] = 0,05 M
B) [NO3‒] = 0,05 M
C) [PO43‒] = 0,05 M
D) [F‒] = 0,05 M
soluzione
I Kps tabulati per Ag ed Sr sono :
Kps(Ag3PO4) = 1,3 10‒20
Kps(Sr3(PO4)2) = 1,0 10‒31
Kps(Ag2O) = 2,0 10‒8
Sappiamo che un composto precipita quando il prodotto delle concentrazioni delle specie ioniche nella soluzione uguaglia il valore di Kps.
La quantità minima di Ag+ necessaria per precipitare il fosfato è calcolata da
Kps=[Ag+]3 [PO4-3] = 1,3 x 10-20 [Ag+] = 4√1,3 x 10-20 = 1,06 x 102,11
Analogo calcolo si effettua per il Sr3(PO4)2
Dai dati si evince che se vi fosse il fosfato nei due becher avremmo due precipitati quindi PO4-3 è da escludere così come sono da escludere F- ed NO3- in cui sia Ag che Sr non precipitano.Da questo si evince che nelle due soluzioni deve essere presente OH- ed infatti solo se presente OH- si forma Ag2O mentre Sr non precipita.
Risposta corretta A
32. Calcolare le moli di zolfo necessarie per produrre 7,00 moli di solfuro di sodio, secondo la
reazione (da bilanciare):
S (s) + NaOH (aq) ⇆ Na2S (aq) + Na2S2O3 (aq) + H2O (aq)
A) 18,54 mol
B) 10,47 mol
C) 23,11 mol
D) 14,00 mol
soluzione
Si tratta di una reazione di dismutazione e le due semireazioni sono:
2[ S +2e → S-2
1[2S + 6OH- → S2O3-2_3H2O +4 e
______________________________________
4 S + 6OH- → 2S-2 + S2O3-2 + 3H2O
cioè
4 S + 6 NaOH → 2 Na2S + Na2S2O3 + 3 H2O
da 4 atomi di S si ottengono 2 di Na2S da X moli se ne ottengono 7
X= 14 moli
Risposta corretta D
33. Quale delle seguenti quattro reazioni ha la costante di equilibrio maggiore
A) HNO2 (aq) + NH3 (aq) ⇆ NO2(aq) + NH4+(aq)
B) CN‒(aq) + H2O (aq) ⇆ HCN (aq) + OH‒
C) BrO‒(aq) + H2O (aq) ⇆ HBrO (aq) + OH‒(aq)
D) N3‒(aq) + H2O (aq) ⇆ HN3 (aq) + OH‒(aq)
soluzione
HCN, HBrO e HN3 sono acidi più forti di H2O quindi la reazione è spostata a sinistra per cui la Keq è bassa.Nella prima reazione possiamo notare che si forma HNO2 che è un acido abbastanza più forte delle altre specie chimiche.
Da quanto esposto la reazione più spostata a destra e con una Keq più alta è la A
34. Si consideri un acido debole HA, con costante acida Ka. Stabilire quale colonna riporta i valori di pH corretti per i due valori di [A‒]/[HA] (pKa = ‒ logKa).

A) A
B) B
C) C
D) D
soluzione
HA ⇔ H++ A‒ Ka= [H+ ][A-] / [HA] [H+] = Ka [HA][A-]
PH= PKa -log [HA][A-]
PH= PKa + log [A-]/[HA]
sostituendo i valori ad [A-][HA] 100, 10 si ha nei due casi PH= PKa+ 2 e PH=PKa+1
La risposta corrente è D
35. Calcolare il rapporto [ClO‒]/[HClO] in una soluzione di NaClO a pH = 6,8.
A) 0,224
B) 0,541
C) 0,887
D) 0,332
soluzione
sappiamo che per un acido debole come HClO il cui Ka = 3,5 10‒8 per cui PKa= ‒ log Ka = 7,46 si ha:
PH= PKa + log [A-]/[HA] log [A-]/[HA] = PH-Pka = 6,8 -7,46 =-0,66
[A-]/[HA] = 0,224 cioè [ClO]/[HClO] =0,224
risposta corretta A
36. Quale tipo di perturbazione viene applicata al tempo t1 ad una soluzione satura di PbI2 (s), che possa giustificare l’andamento delle concentrazioni nel tempo indicato in figura?

A) aggiunta di PbI2 (s)
B) aggiunta di NaI (s)
C) variazione di temperatura
D) diluizione con acqua
soluzione
Dando un’occhiata al grafico, notiamo che al punto t lo iodio aumenta del doppio rispetto a Pb+2, quindi nella soluzione si è sciolto ulteriore PbI2 . Apparentemente verrebbe da pensare che l’aumento sia dovuto all’aggiunta di PbI2 o di NaI ma la soluzione non è una soluzione qualunque, ma è una soluzione satura di PbI2. Questo significa che l’aggiunta di ulteriore PbI2 o di NaI farebbe precipitare il composto. Non può essere causa di un aumento di I- la diluizione con H2O anzi la farebbe diminuire. Si deduce quindi che l’aumento di I è dovuto all’aumento di temperatura che scioglie il corpo di fondo.
Risposta corretta C
37. In un recipiente chiuso, mantenendo costante la pressione, un gas con comportamento ideale viene riscaldato fino a raddoppiarne la temperatura (misurata in K). Si osserva che:
A) le molecole del gas tendono ad associarsi
B) il volume raddoppia
C) il gas si decompone
D) l’energia cinetica delle molecole del gas diminuisce
soluzione
sappiamo che per un gas ideale che si trova in due condizioni di temperatura e pressione e volume si può scrivere
P1V1/T1=P2V2/T2 essendo P=k si può scrivere V1/T1 = V2/T2 da questa espressione se T2=2T1 allora V2 diviene 2 V1 cioè il volume raddoppia.
Risposta corretta B
38. Viene fornita una quantità di calore pari a 12 kJ a 11 moli d’acqua per riscaldarli fino a 80 °C.
Qual era la temperatura iniziale dell’acqua? La capacità termica specifica dell’acqua è 4,184 J/ Kg‒si trascuri il contributo delle dispersioni e della capacità termica del contenitore.
A) 65,5 °C
B) 60,5 °C
C) 55,5 °C
D) 50,5 °C
soluzione
sappiamo che Q = c m (T2-T1) cove c= capacità termica m massa T la temperatura e qu è la quantità di calore del processo
trasformiamo le moli in grammi m= 11 x 18 (PMH2O)= 198 T2= 80° C = 4,184 J/Kg Q= 12 KJ=12000 J
pertanto 12000 = 198 x 4,184 x (T2-T1 )
T2-T1= 12000 / 198 x 4,184 = 12000 /828 = 14,5
T2-T1= 80-T1 = 14,5 da cui T1 =80 – 14,5 = 65,5
Risposta corretta A
39. Il tetrafluoruro di xeno ha una geometria (posizione media relativa degli atomi):
A) piramidale trigonale
B) quadrata planare
C) tetragonale
D) a cavalletto
soluzione
Lo xeno possiede una struttura con due doppietti elettronici liberi (lone Pair) e per la teoria VESPR il metodo AXE prevede una struttura AX4E2 che come sappiamo ha una struttura planare quadrata.

Risposta corretta B
40. Disporre in ordine di acidità crescente i seguenti alcoli, tenendo conto dell’effetto induttivo
elettronattrattore degli atomi di cloro.

A) 2, 3, 1, 4
B) 3, 1, 4, 2
C) 4, 1, 2, 3
D) 3, 2, 1, 4
soluzione
Il cloro ha un effetto elettronattrattore e questo spsota gli elettroni del legame O-H dell’alcol verso di sè rendendo così l’idrogeno del gruppo alcolico molto più acido cioè rendendolo facilmente staccabile, e quando H+ si allontana si forma l’alcossido RO- che così viene stabilizzato. Più vicino è al gruppo OH più importante è l’effetto induttivo del Cloro. Tra gli alcoli indicati il più acido, è l’alcol 4 con i due atomi di cloro ambedue in posizione 1 rispetto ad OH ; subito dopo si ha l’alcol con i due atomi di cloro in posizione 1-2 rispetto sempre ad OH e quindi si ha l’acido con gli atomi di cloro in posizione 3-3 , infine si ha l’alcol con gli atomi di cloro in posizione 3-4.
L’ordine di acidità crescente è 3,2,1,4
Qui continuano i quesiti della sola classe A (41-60)
41. Indicare la risposta in cui entrambe le coppie di atomi NON formano legami covalenti, quando i due elementi si combinano in un composto binario:
A) idrogeno e fluoro; potassio e fluoro
B) idrogeno e silicio; idrogeno e sodio
C) idrogeno e fluoro; idrogeno e silicio
D) idrogeno e sodio; potassio e fluoro
41. Soluzione
Abbiamo già visto che un legame covalente si forma quando la differenza di elettronegatività è inferiore ad 1,9 D.Dai dati tabulati

vediamo che silicio ed idrogeno hanno elettronegatività molto simili ( 2,2 D per H e 1,9 D per Si) e formano legami covalenti quindi dobbiamo escludere le risposte B e C.
Potassio e fluoro, hanno elettronegatività molto diverse ( 0,82 D e 3,98 D) e formano legami ionici e non covalenti . Potassio e fluoro sono presenti nelle risposte A e D e quindi bisogna individuare quale tra HF ed NaH formano legame covalente o ionico. La differenza di elettronegatività (4,0 – 2,1 = 1,9) tra H ed F sarebbe tale da far dire che si formi un legame ionico, tuttavia la specie HF è un gas ed allo stato gassoso HF forma un legame covalente polare.
Idrogeno e sodio hanno una differenza di elettronegatività (2,1 – 0,9 = 1,2), e quindi il composto NaH è un composto cristallino nel quale troviamo gli ioni Na+ e H.
Risposta corretta D
42. Indicare i legami covalenti ordinati secondo valori di polarità decrescente:
A) O‒P; P‒N; N‒O
B) P‒N; N‒O; O‒P
C) O‒P; N‒O; P‒N
D) N‒O; P‒N; O‒P
42. Soluzione
Quando un legame covalente si forma tra due atomi che presentano un diverso valore di elettronegatività, la nube degli elettroni che costituiscono il legame è più concentrata sull’atomo più elettronegativo. Si forma quindi nella molecola un dipolo permanente ed il momento di dipolo (che si indica generalmente con μ ) è dato dal prodotto della carica per la distanza di legame e si misura in coulomb·metro. Se la differenza di elettronegatività (secondo Pauling) tra due atomi è minore di 1,9 Debay il legame si definisce covalente polare.La polarità del legame dipende quindi dalla differenza di elettronegatività tra i due atomi.Dalla tabella delle elettronegatività riportata nel quesito precedente, vediamo che l’ossigeno ha elettronegatività 3,88 D ; l’azoto ha elettronegatività 3,04 D il fosforo ha elettronegatività 2,19 D quindi :
ΔO-P = 3,44 – 2,19= 1,25 D
ΔN-P =3,04- 2,19 = 0,85 D
ΔO-N = 3,44 – 3,04 = 0, 4 D
l’ordine, in termini di polarità decrescente del legame, è :
O-P (∆ 1,25); P-N (∆ 0,85); N-O (∆ 0,4).
Risposta corretta A
43. Identificare l’acido astatidrico tra le seguenti molecole:
A) As2H3
B) AsH3
C) HAtO
D) HAt
Soluzione
As è il simbolo dell’arsenico, quindi le risposte A e B sono da escludere.Il simbolo dell’astato è At Sappiamo che quando il nome di un acido termina in IDRICO significa che il composto è composto da due soli atomi (composto binario) di cui uno è certamente l’idrogeno. Pertanto la risposta C è da escludere perchè HatO è un acido ternario (contiene 3 atomi). L’acido astartico deve essere necessariamente Ht perchè è binario e contiene H e l’elemento astato, quindi l’acido richiesto è HAt.
Risposta corretta D
44. La formula del nitrito di magnesio è:
A) Mg(NO2)2
B) Mg(NO3)2
C) Mg(NO)2
D) Mg(HNO)2
44. Soluzione
Quando il nome di un sale finisce in ITO, come in questo caso, si tratta di un sale ternario contenente ossigeno e l’atomo centrale possiede un numero di ossidazione immediatamente inferiore a quello massimo che l’atomo può assumere. Nel caso specifico il sale è un Nitrito quindi ricordando che l’N può avere n.o. +5,+3 +1 ,0,-3,-2,-1 si evince che l’ N nel nitrito deve avere n.o. +3 . Essendo l’azoto legato all’ossigeno, e dovendo avere l’azoto un n.o.+3, il nitrito deve essere uno ione negativo con formula NO2- infatti la carica negativa permette al Mg+2 di legarsi ad esso Mg+2 +NO2- → Mg(NO2)2.
La risposta corretta è A
45. Facendo reagire il diossido di carbonio con monossido di idrogeno, si ottiene:
A) una base
B) un acido
C) un tampone
D) nessuna delle precedenti opzioni è corretta
45. Soluzione
Il diossido di carbonio, detto comunemente anidride carbonica è un ossido cosiddetto acido perchè con l’H2O forma un acido. In questo caso il monossido di idrogeno non è altro che H2O cioè l’acqua, quindi la reazione che è: CO2 + H2O → H2CO3 Si forma quindi acido carbonico e pertanto la risposta corretta è B
46. Indicare i numeri di ossidazione del fosforo nei seguenti composti:
NaH2PO4, P4, P2O5, Na2HPO3.
A) +5, 0, +5, +5
B) +5, 0, ‒5, +3
C) +5, +l, +5, +3
D) +5, 0, +5, +3
soluzione
il numero d’ossidazione di un atomo in un composto dipende dall’elettronegatività dell’atomo o degli atomi a cui è legato e viene calcolato attribuendo il valore 0 (zero) per ogni legame con un atomo dello stesso tipo (es Cl-Cl , C-C ecc.),+1 per ogni legame con un atomo con maggiore elettronegatività, -1 per ogni legame con un atomo che possiede minore elettronegatività.
Da quanto detto possiamo subito dire che in P4 il fosforo ha n.o.=0
in NaH2PO4 ogni atomo do Ossigeno è legato al fosforo con 2 legami ed è più elettronegativo del fosforo quindi abbiamo 4 x 2 =8 per i legami con l’O. Abbiamo anche – 1 per ogni legame con l’H che è meno elettronegativo del P quindi si ha 2 x -1 =-2 ed infine si ha 1 x -1 per il sodio Na meno elettronegativo del P.
In definitiva il P nel composto NaH2PO4 ha n. o. = 8 -2-1 = 8-3= +5
Si può semplificare semplicemente moltiplicando il numero di atomi di Ossigeno e sottraendo le cariche degli elementi positivi legati all’atomo centrale( se vi sono) che in questo caso è il fosforo.
Nel composto P2 O5 secondo questo metodo si ha 5 x 2 =10 ma si hanno 2 atomi di fosforo quindi per avere il n.o. di un atomo di fosforo nel composto bisogna dividere per 2 . Il n.o. del P in P2O5 è 10/2 = +5
In Na2HPO3, seguendo il nostro metodo, si ha 3 x 2 =6 ma bisogna sottrarre le cariche portate da 2 atomi di Na (quindi 1 x 2 essendo il sodio +1 quindi 2) e la carica dell’idrogeno che è +1.
In definitiva nel composto Na2HPO4 il P ha n.o. = 6 – 2 – 1 = 6-3=+3
La risposta al quesito è D
47. Indicare i coefficienti stechiometrici (in ordine sparso) necessari per bilanciare la seguente
reazione:
Al2(SO4)3 + CaCl2 ⇆ AlCl3 + CaSO4
A) 1, 2, 2, 3
B) 1, 2, 3, 3
C) 2, 2, 2, 3
D) 2, 2, 3, 3
soluzione
Possiamo notare che i numeri di ossidazione degli elementi impegnati nella reazione non cambiano, quindi non si tratta di una reazione redox. E semplicemente una reazione di doppio scambio e basta bilanciare le massa degli elementi.
A sinistra vi sono 2 atomi di Al ma a destra ne abbiamo solo 1 quindi a destra dobbiamo porre 2 davanti all’alluminio : Al2(SO4)3 + CaCl2 ⇆ 2AlCl3 + CaSO4
a sinistra vi sono 3 gruppi SO4 ed a destra solo 1 quindi dobbiamo porre un 3 davanti a CaSO4
Al2(SO4)3 + CaCl2 ⇆ 2AlCl3 + 3CaSO4
adesso a sinistra vi è un solo atomo di Ca mentre a destra vi sono 3 atomi quindi dobbiamo porre un 3 davanti a CaCl2
Al2(SO4)3 + 3CaCl2 ⇆ 2AlCl3 + 3CaSO4
infine il cloro è bilanciato perchè a sinistra vi sono 6 atomi così come a destra.
la reazione bilanciata è:Al2(SO4)3 + 3CaCl2 ⇆ 2AlCl3 + 3CaSO4
La risposta corretta è B
48. L’isotopo 2713 Al possiede:
A) 13 neutroni e 13 protoni
B) 13 protoni e 14 elettroni
C) 14 protoni e 13 neutroni
D) nessuna delle precedenti opzioni è corretta
soluzione
Sappiamo che 27 è il NUMERO DI MASSA e 13 IL NUMERO ATOMICO.
Pertanto essendo la massa = numero di protoni + neutroni ed essendo 13 il numero di protoni (uche è uguale a quello degli elettroni) allora vi sono 13 protoni e 14 neutroni
Da quanto esposto la risposta corretta è D
49. Lo ione F‒ ha:
A) lo stesso numero di protoni di Ne
B) lo stesso numero di neutroni di O2‒
C) lo stesso numero di elettroni di Na+
D) lo stesso numero di elettroni di Ne+
49. Soluzione
O2‒ F‒ e Na+ possiedono lo stesso numero di elettroni del gas nobile Ne cioè [He] 2s22p6 oppure 1s2 2s22p6
infatti l’O-2 è un ossigeno con 2 elettroni in più quindi essendo la struttura di O [He] 2s2 2p4 se aggiungiamo i 2 elettroni otteniamo la struttura di O2- =[He] 2s22p6
Il sodio a sua volta ha la struttura [Ne] 3s¹ quindi Na+ ha 1 elettrone s in meno, pertanto la struttura di Na+ = [Ne] = [He] 2s22p6
Il Fluoro ha la struttura [He] 2s2 2p5 ed F- possiede un elettrone in più quindi la strutture elettronica di F- è = [He] 2s2 2p6
Come si vede, sia Na+ che F- possiedono struttura identica quindi la risposta al quesito è C
50. L’energia di prima ionizzazione del sodio è:
A) maggiore di quella del potassio e minore di quella del litio
B) minore di quella del potassio e maggiore di quella del litio
C) maggiore di quella del potassio e maggiore di quella del magnesio
D) minore di quella del potassio e maggiore di quella del magnesio
Soluzione
L’energia di ionizzazione di un atomo è la minima energia richiesta per allontanare un elettrone e portarlo a distanza infinita, a 0 K e in condizioni energia cinetica nulla. Quindi l’energia necessaria per far avvenire il seguente processo:
-
- X(g) → X+(g) + e− I1
L’energia per staccare il primo elettrone si definisce di prima ionizzazione e quindi di seconda ionizzazione,terza ionizzazione ecc. e si indicano con EI1 EI2 ecc.
-
- X+(g) → X2+(g) + e− EI2
-
- X2+(g) → X3+(g) + e− EI3
L’energia di prima ionizzazione diminuisce dall’alto verso il basso in ogni gruppo e da sinistra a destra nei periodi (con poche eccezioni). Gli andamenti descritti possono essere messi in relazione con le dimensioni atomiche e quindi con il valore del raggio atomico.Ciò è comprensibile in quanto più gli elettroni sono lontani dal nucleo meno energia è necessaria per staccarli.Nel caso in esame EI diminuisce: Li > Na > K e spostandosi a destra lungo il periodo EI aumenta per cui si ha Na < Mg.
Si deduce quindi che l’EI1 del sodio è maggiore di quella del potassio e minore di quella del litio Li > Na > K
Risposta corretta A
51. Il raggio ionico di S2‒ è:
A) minore di quello dello ione Cl‒
B) maggiore di quello dello ione P3‒
C) minore di quello dello ione O2‒
D) minore di quello dello ione P3‒
Soluzione
Anche i raggi ionici, come i raggi atomici, mostrano andamento periodico con il numero atomico: il raggio ionico aumenta dall’alto verso il basso lungo un gruppo della tavola periodica e diminuisce da sinistra verso destra lungo un periodo. Pertanto P, S e Cl che appartengono al terzo periodo possiedono un raggio maggiore degli elementi del secondo periodo.I raggi atomici hanno questo andamento P > S > Cl (a causa dell’aumentare dei protoni nel nucleo). Per gli ioni, l’andamento generale è uguale a quello degli atomi neutri ma all’aumentare della carica negativa aumentano le dimensioni per cui si ha P3‒>> S2‒>> Cl‒
Risposta corretta D
52. Individuare la specie chimica che NON ha configurazione elettronica ls2 2s2 2p6:
A) Na+
B) N3‒
C) Al3+
D) O‒
Soluzione
Abbiamo già visto che Na+ ha la struttura 1s2 2s2 2p6
N3- possiede 3 elettroni in più rispetto all’atomo neutro quindi la sua struttura è N3- 1s2 2s2 2p6
Al+3 ha struttura con 3 elettroni in meno rispetto all’atomo neutro quindi da [Ne] 3s² 3p¹ si ha
Al+3 = [Ne] =1s2 2s2 2p6
L’ O ha una struttura [He] 2s2 2p4 ma lo ione O- ha un elettrone in più e la sua struttura è : [He] 2s2 2p5 quindi diversa dal Neon
Risposta corretta D
53. Indicare gli ioni disposti in ordine decrescente di raggio ionico:
A) Cs+
Rb+
K+
Na+
Li+
B) Li+K+Na+Rb+Cs+
C) Li+Na+K+Rb+Cs+
D) Cs+Rb+Na+K+Li+
Soluzione
Abbiamo già visto che i raggi ionici, come i raggi atomici, mostrano andamento periodico con il numero atomico: il raggio ionico aumenta dall’alto verso il basso lungo un gruppo della tavola periodica e diminuisce da sinistra verso destra lungo un periodo.Possiamo aggiungere che cambiano le dimensioni degli atomi nel senso che all’aumentare della carica divengono più piccole, ma l’andamento generale tranne qualche eccezione è sempre lo stesso.
Le dimensioni dei cationi sono inferiori a quelle degli atomi neutri, ma aumentano andando verso il basso lungo il gruppo: Cs+> Rb+> K+> Na+> Li+.
Risposta corretta A
54. Un’unità di massa atomica (u) equivale a:
A) 6,022 ∙1023 g
B) 1,66 ∙1023 g
C) 1,66 ∙10‒23 g
D) nessuna delle precedenti opzioni è corretta
Soluzione
numero di Avogadro N è il numero di unità di massa atomica u in un grammo,
N = g/u. da cui 1/N = u/g.
1/N = 1/ 6,022 ∙1023 = 0,166 ∙10‒23 g.
Risposta corretta D
55. Identificare la reazione che NON è di ossidoriduzione:
A) 2 Mn (s) + SnCl4 (aq) → 2 MnCl2 (aq) + Sn (s)
B) 3 Cl2 (g) + 6 NaOH (aq) → NaClO3 (aq) + 5 NaCl (aq) + 3 H2O (aq)
C) 2 Na2O2 (s) → 2 Na2O (s) + O2 (g)
D) BaCl2(aq) + (NH4)2SO4(aq) → BaSO4(s) + 2 NH4Cl(aq)
soluzione
Nelle reazioni di ossidoriduzione gli elementi cambiano il loro numero di ossidazione, ed osservando le reazioni A,B,C possiamo affermare che in esse gli elementi mutano il numero di ossidazione e quindi si tratta di reazioni redox.
Nella reazione A infatti Mn passa da n.o.zero a n.o. +2 ; nella reazione B vediamo che Cl2 da n.o.zero passa a -1 e + 5 (dismutazione) , nella reazione C vediamo O2 che da O2-2 passa ad O-2 ed O2 n.o. zero.
Concludendo, le reazioni A,B,C sono reazioni redox mentre la reazione non redox è
BaCl2(aq) + (NH4)2SO4(aq) → BaSO4(s) + 2 NH4Cl(aq)
che è una reazione di doppio scambio.
risposta corretta D
56. Una pasta di grano duro contiene un residuo di glifosato (un erbicida) pari a 16,1 μg/kg di
prodotto. Mangiando 0,100 kg di pasta al giorno, i?n quanti mesi un individuo ingerisce 1,00 mg di glifosato? (considerare 1 mese = 30 giorni)
A) 32,1 mesi
B) 17,8 mesi
C) 40,5 mesi
D) 20,7 mesi
soluzione
56. Soluzione
In 0,1 kg di pasta 100 g vi sono 1,61 μg di glifosato. La quantità di 1000 μg è contenuta in
100 g : 1,61 μg= Xg : 1000μg X= 100000/1,61 = 62112 g cioè in 62,11 Kg
se in 1 giorno si ingeriscono 0,1 Kg in x giorni si ingeriscono 62,11 kg
62,11/0,1 = 621,1 giorni cioè 621,1 / 30= 20,7 mesi
risposta corretta D
57. Qual è la concentrazione di una soluzione ottenuta mescolando 1,00 mL di una soluzione di HCl 10,00 M con 99,00 mL di acqua? (Assumere che i volumi siano additivi).
A) 0,0999 M
B) 0,101 M
C) 0,100 M
D) 0,0101 M
soluzione
se in 1000 ml vi sono 10 moli di HCl prelevando 1 ml prelevo 10/1000 moli = 0,01 moli
Queste moli sono aggiunte a 99 ml di H2O per formare 100 ml. di soluzione, pertanto, se in 100 ml vi sono 0,01 moli di acido in 1000 ve ne sono X X= 0,01 x 1000 /100 = 0,1 M
Risposta corretta C
58. In un recipiente da 1,00 L, contenente inizialmente 0,64 moli di NOBr (g), avviene la reazione (da bilanciare):
NOBr (g) ⇆ NO (g) + Br2 (g)
Se all’equilibrio ci sono 0,46 moli di NOBr(g), calcolare la costante Kc della reazione (espressa in
molarità).
A) 0,077
B) 0,014
C) 0,554
D) 0,133
soluzione
La reazione bilanciata è
2Br- si ossida a Br2 mentre N+3 si riduce a NO
La reazione bilanciate è quindi
2NOBr ⇔ 2NO + Br2
la Keq= [NO]2 [Br2]/[NOBr]²
moli [NOBr] [NO] [Br2]
iniziali 0,64 — —
prodotte — 0,64-0,46 0,64 – 0,23 /2 (la metà di NO)
rimaste 0,46 0,18 0, 09
Keq= (0,18)² 0,09 / (0,46)² Keq = 0,00292 / 0,2116 Keq= 0,0138
risposta corretta B
59. Qual è la pressione all’interno di un recipiente chiuso dal volume di 10 dm3 che contiene 0,4 kg diidrogeno a 28 °C?
A) 50 atm
B) 50 Pa
C) 50 kPa
D) 50 MPa
soluzione
V = 10 L; T = 273 + 28 = 301 K.
Dalla legge dei gas PV = nRT P = nRT/V P
n= 400/2 = 200 mol
V = 10 L;
T = 273 + 28 = 301 K.
P = 200 ∙0,0821 ∙ 301/10
P = 494 atm trsformiamo le atm in Pa
P = 494×1,013 105 = 500 x105
Pa = 50 106
Pa = 50 MPa
risposta corretta D
60. Un recipiente chiuso e rigido con volume di 1,0 dm3 , termostatato a 60 °C, contiene 5,0 g di un gas ideale. La pressione all’interno del recipiente è 3,0 ∙105 Pa. Qual è la massa molare del gas?
A) 36 g mol‒1
B) 66 g mol‒1
C) 56 g mol‒1
D) 46 g mol‒1
Soluzione
Dobbiamo calcolare il PM del gas.
I dati sono T = 273 + 60 = 333 K; P(atm) = 3,0 ∙105/1,013 105 = 2,96 atm.
Dalla legge dei gas PV = nRT
ricavo il numero di moli n = PV/RT n = 2,96 ∙ 1/0,0821 ∙ 333 n = 0,1083 mol.
Noto il valore di n =g/PM quindi otteniamo PM = 5/0,1083 = 46,2 g/mol
Risposta corretta D
Lascia un commento