GIOCHI DELLA CHIMICA 2012 FASE NAZIONALE CLASSI A-B
1- Indicare l’elemento con maggiore energia di prima ionizzazione:
A) Na
B) Al
C) Ca
D) P
soluzione
L’energia di ionizzazione di un atomo o di una molecola è l’energia minima richiesta per allontanarne un elettrone e portarlo a distanza infinita, a zero gradi K e in condizioni di energia cinetica nulla.
X(g) → X+(g) + e− I1
Quanto più un catione è carico positivamente, tanto più difficile è strappare un ulteriore elettrone,
L’energia di prima ionizzazione è una proprietà periodica, infatti,muovendosi lungo un periodo della tavola periodica da sinistra verso destra I1 aumenta, mentre scendendo in uno stesso gruppo diminuisce. Vi è molta regolarità in questo andamento nei blocchi principali.
Na , Al e P si trovano tutti nel terzo periodo ed il P possiede la maggiore Ei. Il Ca invece è il secondo elemento del quarto periodo e siccome all’aumentare del numero del periodo o lungo un gruppo che dir si voglia, Ei diminuisce il Ca ha una Ei più bassa del P anche se il suo valore è maggiore di Na e Al.
2- Indicare il composto che dà soluzioni acquose colorate:
A) BaCl2
B) CrCl3
C) KOH
D) KBr
Soluzione
Il Cloruro di Bario a temperatura ambiente si presenta sotto forma di cristalli bianchi e dà una soluzione incolore
KOH è solubile in acqua e dà una soluzione incolore
KBr A temperatura ambiente si presenta come un solido bianco inodore, solubile in acqua, in cui è completamente dissociato formando una soluzione incolore
- CrCl3 anidro è un solido colorato insolubile in acqua ma solubile in acol
- Cr(H2O)4Cl2]Cl•2H2O di colore verde scuro, è la forma più comune, reperibile in commercio. I dati riportati nel riquadro a fianco si riferiscono a questo isomero.
- [Cr(H2O)5Cl]Cl2H2O di colore verde chiaro;
- [Cr(H2O)6]Cl3di colore violetto.
- Queste forme colorate sono solubili in acqua ed impartiscono il colore alla soluzione
- Lo spettro di assorbimento pubblicato da Bjerrum nel 1990 mostra un minimo a 480 nm (blu) per l’esaidrato ed un massimo di 510 nm (verde) il complesso monocloro pentaidrato
Lo spettro integrato forma i colori che però variano con la concentrazione, lo spessore del mezzo e col cammino ottico)
3- Quando l’atomo di un metallo si combina con quello di un non metallo, l’atomo del non metallo:
A) perde elettroni e diminuisce in grandezza
B) perde elettroni e aumenta in grandezza
C) acquista elettroni e diminuisce in grandezza
D) acquista elettroni e aumenta in grandezza
Soluzione
Un metallo tende sempre ad acquistare elettroni quando si trova vicino ad un non metallo. Ad esempio Na2S, H2O molecole in cui l’ossigeno e lo zolfo mettono a disposizione del metallo 2 coppie di elettroni. Ovviamente con l’acquisto degli elettroni il metallo aumenta l’occupazione dei propri orbitali aumentando così la propria grandezza.
4-Indicare la quantità chimica di H2O che si ottiene se si bruciano 2,72 mol di H2 in presenza di un eccesso di O2:
A) 2,36 mol
B) 2,72 mol
C) 4,72 mol
D) dipende dalla quantità in eccesso di O2
Soluzione
Sappiamo che la reazione di ossidazione è H2 + ½ O2 -à H2O
Quindi da 1 mole si ottiene 1 mole di H2O quindi da 2,75 moli si ottengono 2,75 di H
5-Una soluzione acquosa di HCl al 28,0 % ha d = 1,14 g cm -3 . Indicare il volume di soluzione necessario per far sciogliere Al (1,87 g) e ottenere AlCl3:
A) 23,8 cm3
B) 47,6 cm3
C) 11,9 cm3
D) 8,0 g
Soluzione
La reazione da considerare è
Al + 3Cl- à AlCl3
27 g + 3 x 35,5 g à 133,5 g
Per 27 g di Al sono necessari 106,5 g di Cl- che devono provenire da HCl quindi per 1,87 g saranno necessari X g X= 7,38 g
l ma HCl è un liquido quindi devo prelevare i ml corrispondenti a 7,38 g. I ml si ottengono dal valore della densità=g/ml quindi ml=g/densità
7,38 g corrispondono a 7,38 / 1,14 = 6,48 ml ma ciò sarebbe valido se l’HCl fosse al 100% ma è invece al 28 % per cui la quantità in ml si ottiene dalla proporzione
Se prendendo 100 ml in realtà ne prendo 28 di acido allora quanto ne devo prelevare per avere una quantità pari a 6,44 ml?
100 :28 = X :6,48 X = 9432/28 =23,13 ml
Risposta corretta A
6- Un droghiere prepara un rosolio diluendo 25,0 cm3 di etanolo anidro puro (C2H5OH; d = 0,789 g cm -3 ) con acqua per ottenere 250,0 cm3 di rosolio. Indicare la molarità dell’etanolo nel rosolio:
A) 1,71 M
B) 0,428 M
C) 0,850 M
D) 0,345 M
Soluzione
La Molarità è il numero di moli in 1000 ml di soluzione. Essendo moli= g / PM
Calcoliamo prima i grammi di etanolo dai dati di densità
d= g/volume
Volume x densità= grammi quindi 25 x 0,789 =19,72 g
Moli = 19,72 / PM = 19,72 /46 = 0,428 MOLI IN 250 ml
La Molarità è calcolata dalla proporzione
Se in 250 ml vi sono 0,428 moli in 1000 ve ne sono X
X= 1,712 M
Risposta corretta A
7-Gli atomi degli elementi di uno stesso gruppo della tavola periodica hanno proprietà chimiche molto vicine. Ciò è dovuto principalmente:
A) al loro numero atomico
B) al numero di elettroni del core
C) al numero di elettroni di valenza
D) alla massa atomica degli atomi
Soluzione
Se consideriamo ad esempio il gruppo I del sistema periodico vediamo che la struttura atomica presenta in ogni atomo un elettrone spaiato nell’orbitale s
H 1s1
Li 1s2 2 s1
Na 1s2 2s2 2p6 3s1
Ecc .
Da questa osservazione deriva che tutti gli atomi del primo gruppo si comportano chimicamente allo stesso modo.Pertanto, possiamo dire che il comportamento chimico degli atomi è dovuto agli elettroni più esterni di un atomo che possono essere ceduti o acquistati o messi in comune per formare orbitali con 2 elettroni (ogni coppia di elettroni rappresenta un legame chimico).
La risposta corretta è quindi C
8-Indicare l’atomo più elettronegativo tra N, Si, S, Cl:
A) Si
B) N e S a pari merito
C) S
D) Cl
Soluzione
L’elettronegatività è la capacità che ha un atomo di attrarre gli elettroni del legame in cui è impegnato.
Se consideriamo molecole formate da atomi uguali, gli elettroni del legame si dispongono in modo da essere condivisi equamente tra i due atomi mentre in molecole di atomi differenti la densità elettronica del legame è maggiore dalla parte in cui si ha un atomo più elettronegativo. Per esempio in HCl in forma gassosa, la densità elettronica del legame è spostata più sul cloro che sull’idrogeno generando quindi un dipolo permanente
Esistono 3 diverse scale per misurare l’elettronegatività degli atomi e cioè:
- scala di Pauling
- scala di Mulliken
- scala di Allred-Rockow
Ognuna di esse si basa su formule differenti di calcolo.
Se consideriamo due atomi A e B che prendono parte a un legame covalente, secondo Pauling la differenza di elettronegatività tra questi due atomi è pari a
|XA – XB |= 0,102√Δ
dove:
- XB sono le singole elettronegatività degli atomi A e B.
- Δ è detto “surplus di energia”, ed è dato da: Δ = EAB –√EAA – EBB
Dove EAB è l’energia di legame del composto A-B, EAA l’energia di legame del composto A-A, e EBB l’energia di legame del composto B-B.
- il coefficiente 0,102 è dovuto al fatto che originariamente Pauling utilizzò elettroniVolts(eV) mentre attualmente l’unità di misuraSI è KJ/mol. Se espressa invece in kcal/mol il coefficiente assume il valore di 0,208.
La scala si costruisce quindi attribuendo all’elettronegatività di un elemento un valore arbitrario e ricavandone i valori relativi attraverso la formula precedente. L’elettronegatività dell’Idrogeno preso come valore di riferimento è 2,1 eV(quindi nella formula precedente XB= 2,1)
La scala di Mullikan si costruisce, invece, facendo la media tra l’energia di ionizzazione e l’affinità elettronica di un atomo
XA = ½ (Ei + I) dove I è l’affinità elettronica
La scala di Allred- Rockow si basa sulla forza di Coulomb esercitata dal nucleo verso gli elettroni
F= Ze x e / 4πr²εₒ
dove Z= carica nucleare efficace ed r = raggio covalente
E l’elettronegatività è proporzionale a questa forza F
XAR = 0,359 Z / R² + 0,744
Tornando al quesito proposto, si osserva che le elettronegatività secondo Pauling sono Cl= 3,16 N =3,04 Si =1,9 e S= 2,58
Si deduce che la risposta esatta al quesito è
9 -Indicare la proprietà non periodica degli elementi:
A) energia di ionizzazione
B) numero atomico
C) energia di affinità per l’elettrone
D) numero di ossidazione
Soluzione
A,B e C sono proprietà periodiche infatti sia A che C aumentano nel periodo e diminuiscono lungo il gruppo, il numero atomico aumenta sia lungo il periodo che lungo il gruppo.
Il numero di ossidazione è invece un numero che viene attribuito ad un atomo a seconda dll’elettronegatività dell’atomo a cui è legato.
Infatti si attribuisce il valore zwero se un atomo è legato ad un altro dello stesso tipo es H2 O2 ecc.
Si attribuisce +1 per ogni coppia di elettroni (1 legame) con un atomo più elettronegativo
Per es in HCl all’H si attribuisce il n.o. +1 perché legato con 2 elettroni al cloro che è più elettronegativo.
Si attribuisce il valore -1 se è legato ad un atomo meno elettronegativo.
Nell’esempio HCl al Cloro è attribuito un n.o -1 perché legato all’idrogeno che è meno elettronegativo.
Si evince che la risposta corretta è D che non può essere una proprietà periodica
10- A una soluzione acquosa di AgNO3 in eccesso si aggiunge un volume di 25,0 cm3 di una soluzione acquosa di K2CrO4 0,250 M. Indicare la massa di Ag2CrO4 che precipita, ammettendo che il sale precipiti in modo quantitativo:
A) 4,14 g
B) 1,03 g
C) 2,07 g
D) 3,21 g
Soluzione
La reazione è
2 AgNO3 + K2CrO4 à Ag2CrO4 + 2KNO3
Da ciò si deduce che da 1 mole di K2CrO4 si ottiene 1 mole di Ag2CrO4
Dobbiamo trasformare le moli iniziali di cromato di potassio in grammi :
ricordando che Volume in ml x Molarità = millimoli,
Le millimoli iniziali di Cromato sono 0,25 x 25 =0,00625 millimoli = 0,00625 x 194,2 = 1,214 g
Osservando la reazione possiamo dire che
Da 194,2 g (1 mole) di K2CrO4 si ottengono 331.7 g (1 mole) di Ag2 CrO4 quindi da1,214 g se ne ottengono :X
X= 1,214 x 331,7 / 194,2 = 2,07 g
Risposta corretta C
11-Il PCl3 è un prodotto di partenza per la sintesi di pesticidi e viene preparato per reazione diretta del fosforo con cloro. Indicare la massa di cloruro che si ottiene dalla reazione di 125g di P con 325g di Cl2:
A) 420,0 g
B) 554,7 g
C) 404,0 g
D) 306,7 g
Soluzione
La reazione è :
P4 + 6 Cl2 → 4 PCl3
i pesi molecolari sono PCl3 = 137,33g quindi 4PCl3= 549,32g
6 Cl2 = 6 x 70,9 = 425,4g
4P = 30,97 x 4 = 123,88g
se da 425,4 di cloro si ottengono 549,32 di PCl3 da 325 se ne otterranno X
425,4 : 549,32 = 325 :X
X= 419,6
12-Se si fa reagire il metilciclopentanolo (C6H11OH) con H2SO4, si ottiene un metilciclopentene (C6H10) con una resa dell’83%. Indicare la massa di alcool necessario per ottenere 25 g di alchene:
A) 37,0 g
B) 34,0 g
C) 74,0 g
D) 18,5
Soluzione
Da 100 g (peso molecolare di C6H11OH) si ottengono 82 g (Peso molecolare di C6H10) quindi da X g si ottengono 25 g
100 : 82 = X : 25 X= 30,5 g di alcool
Se la resa di reazione fosse stata del 100% saremmo dovuti partire da 30,5 g di alcool, però la resa è dell’ 83% quindi per ottenere 30,48 g effettivi dobbiamo usare
100 : 83 = X :30,5
X = 36,7g cioè 37,0
13-Indicare l’elemento che si può trovare in natura libero:
A) Ca
B) Ag
C) Au
D) Al
Soluzione
Il più comune composto del calcio che si trova sulla Terra è il carbonato di calcio.
l’Ag si trova in natura sia puro che sotto forma di minerale e l’allumino esiste in natura sotto forma di minerale bauxite Al2O3· 2 H2O, e criolite dove è presente sotto forma di Na3AlF6.
L’oro invece si trova in naturapuro sempre sotto forma di pepite, grani e pagliuzze nelle rocce e nei depositi alluvionali e non sotto forma di minerale..
Pertanto la risposta corretta è l’oro cioè C
14 Indicare il composto binario:
A) solfuro di idrogeno
B) acido solforico
C) solfuro di ammonio
D) clorato di potassio
Soluzione
I composti binari sono costituiti da due atomi diversi:
H2S è costituito da 2 atomi idrogeno ed ossigeno
H2SO4 è un composto ternario perché costituito da tre atoi diversi :idrogeno,zolfo ed ossigeno
(NH4)2 S è un composto ternario perché costituito da tre atomi diversi: azoto, idrogeno e zolfo
KClO4 è anch’esso un composto ternario costituito da potassio, cloro ed ossigeno
La risposta esatta è A
15- Si consideri la reazione: SO3 2- + MnO4 – + H+ → SO4 2- + Mn2+ + H2O Indicare la proposta che riporta i coefficienti delle specie che vi partecipano, sapendo che sono riportati in ordine errato:
A) 3, 2, 5, 2, 6, 5
B) 4, 1, 4, 3, 5, 6
C) 2, 3, 4, 5, 6, 3
D) 2, 3, 4, 7, 3, 4
Soluzione
5 [SO3-2 +H2O -à SO4-2 + 2 e + + 2H+
2 [MnO4- + 5 e + 8 H+ à Mn+2 + 4H2O
5SO3-2 +2MnO4- + 5H2O +16 H+ à 5 SO4-2 + 2 Mn+2 + 10 H+ + 8H2O
Semplificando
5SO3-2 +2MnO4- + 6 H+ à 5 SO4-2 + 2 Mn+2 + 3H2O
I coefficienti sono : 5,2,6,5,2,3
La risposta corretta è A
16-Uno studente ossida completamente un pezzo di Fe purissimo dal peso di 0,1568 g a Fe2+ . Quindi titola la soluzione contenente gli ioni di Fe(II) con 26,24 cm3 di KMnO4. Indicare la molarità della soluzione di KMnO4:
A) 2,140 ·10-2 M
B) 4,280 ·10-1 M
C) 1,070 ·10-3 M
D) 3,210 ·10-3 M
Soluzione
La reazione di ossidazione del ferro(II) è:
1 [MnO4- +5 e +8H+ à Mn+2 + 4H2O
5[Fe+2 à Fe+3 + e
__________________________________
MnO4- +5Fe+2 + 8 H+ à 2MnO4- + 5Fe+3 + 4 H2O
Nel caso specifico il permanganato titola tutto il ferro (II) che inizialmente è 0,1568 g=156,8mg
156,8 mg /55,84 = 2,808 mmoli
Dalla reazione sopra scritta il Fe titolato dal KMnO4 è 2,808/5 =0,562mmoli
Ricordando che V x M = moli
Quindi 26,24 x M = 0,562 da cui M= 0,562 / 26,24 M= 0,0214=2,14 x 10-2
17-Indicare la sequenza che riporta le specie chimiche nell’ordine di dimensioni crescenti, prevedibile sulla base delle generalizzazioni accettate nel descrivere i raggi ionici e atomici:
A) S2- < Ca2+ < K+ < Ar < Cl
B) Ca2+ < K+ < Ar < Cl < S2-
C) K+ < Ca2+ < Ar < Cl < S2-
D) S2- < K+ < Ar < Ca2+ < Cl
Soluzione
I numeri atomici sono :
S 16 Cl 17 Ar 18 K 19 Ca 20
Si deduce quindi che la risposta corretta è B
18-Indicare la formula corretta dell’ossido di azoto, un vecchio e temuto inquinante, noto con il soprannome di ossido nitrico, oggi studiato anche per le sue proprietà favorevoli all’uomo:
A) NO
B) N2O
C) NO2
D) N2O3
Soluzione
L’ossido di azoto è NO (monossido)
l monossido di azoto è un ossido neutro e non un’ anidride Il monossido di azoto presenta nella molecola un elettrone spaiatoche conferisce al gas un comportamento paramagnetico. Il monossido di azoto è stabile in modo inusuale per una molecola con un elettrone dispari, ma reagisce spontaneamente con l’ossigeno per dare il biossido . E’ utilizzato dall’organismo per dilatare vene ed arterie.
19-Indicare il composto molecolare:
A) CaO
B) CO
C) Li2O
D) Al2O3
Soluzione
L’unico composto molecolare è CO monossido di carbonio.Esso è anche chiamato Carbonile (o gruppo carbonile). Data l’alta differenza di elettronegatività il gruppo carbonilico è polare: si forma infatti una nube carica negativamente sull’ l’ossigeno ed una zona positiva sul carbonio. In un organismo che respira monossido di carbonio l’emoglobina al posto dell’ossigeno lega di preferenza il CO perché questo dona una coppia di elettroni al ferro dell’emoglobina e sostituisce l’ossigeno in quanto il CO con i suoi orbitali di antilegame forma un ciclo con gli orbitali d del ferro per cui i due elettroni donati entrano in un ciclo molto stabile (Back Donation) e per questo l’ossigeno alla pressione atmosferica non può più legarsi al ferro. Ciò comporta che l’emoglobina non può più trasportare l’ossigeno alle cellule e l’organismo può morire se non si interviene tempestivamente..
20-Indicare il pH di una soluzione 0,10 M di HCl:
A) 1,0
B) 2,0
C) 7,3
D) 9,0
Soluzione
PH= -log [H+] quindi PH= -log 10-1 =-(-1) –log 10 = 1 – log 10 = 1
Risposta corretta A
21-Indicare il nome internazionale dei seguenti ossidi, MnO, Mn2O7, CO, CO2:
A) ossido di manganese(II), ossido di manganese(VII); ossido di carbonio(I), ossido di carbonio(II)
B) ossido di manganese(II), eptaossido di dimanganese; ossido di carbonio, diossido di carbonio
C) ossido di manganese, eptaossido di dimanganese; ossido di carbonio(I), ossido di carbonio(II)
D) ossido di manganese, ossido di manganese(VII); monossido di carbonio, diossido di carbonio
Soluzione
La risposta corretta è B
22- Indicare l’affermazione ERRATA secondo la nomenclatura comune e IUPAC:
- A) gli acidi che contengono H, O e un altro elemento sono detti Ossoacidi (Oxoacidi)
- B) quando HCl è gassoso o liquido puro è detto cloruro di idrogeno, ma in soluzione acquosa, dove esiste come Cl,H3O + è detto acido cloridrico
- C) il nome degli anioni in cui uno o più, ma non tutti gli atomi di idrogeno sono rimossi devono indicare il numero di atomi di idrogeno presenti
- D) quando si rimuovono, come ioni H+ , tutti gli atomi di idrogeno di un ossoacido “-oso”, il nome dell’anione termina con “-ato”
Soluzione
A,B,C sono risposte corrette mentre D è errata.
Se consideriamo H2SO3 chiamato acido solforoso lo ione corrispondente SO3-2 si chiama anione solfito e non solfato perchè la desinenza ato è da attribuire al sale dell’acido che termina in ICO
Es. in H2SO4 SO4-2 è infatti lo ione solfato
23-Indicare tra i seguenti i composti che più probabilmente sono ionici: LiF, BaCl2, B2H6, KF, C2H4, HCl, KCN:
A) LiF, BaCl2, KF, HCl, KCN
B) LiF, BaCl2, KF, KCN
C) LiF, C2H4, HCl
D) LiF, BaCl2, HCl
Soluzione
I composti B2H6 e C2H4 non sono ionici quindi la risposta corretta è B in quanto HCl è ionico solo in soluzione acquosa.
24-Le masse atomiche dei nuclidi 3 6Li e 3 7Li sono rispettivamente 6,0151 u e 7,0160 u. Se ne deduce, sapendo che la massa atomica media del litio è 6,941 u, che l’abbondanza naturale dei due isotopi in % è vicina a:
A) 15% e 85%
B) 1,5% e 98,5%
C) 7,5% e 92,5%
D) 2,5% e 97,5%
Soluzione
In natura molti elementi si trovano sotto forma di miscela di isotopi (elementi con ugual numero di protoni ma con diverso numero di neutroni). Per esempio il cloro in natura è costituito dal 75,8% di 35Cl e dal 24,2 di 37Cl. La massa di ogni isotopo è data somma delle masse dei protoni e dei neutroni infatti la massa di 35Cl è 34,969 u e quella del 37Cl.è 36,966 u. Sulla tavola periodica però si trova il valore 35,45 u ma questo è il risultato della media tra il prodotto della massa dei singoli isotopi moltiplicati per la loro abbondanza in natura. Nel caso del Cloro abbiamo allora:
media della massa del cloro = (massa 35Cl x 75,8 + massa 37Cl. X 24,2)/ 100
media della massa del cloro= 34,969 x 75,8 + 36,966 x 24,2 /100 = 2650,6 + 894,577 /100= 3545,177 /100 = 35,45 u
pertanto
6,0151 X + 7,0160 Y / 100 = 6,941 u
Y = 100 –X
6,0151X + 7,0160(100-X) /100 = 6,941
6,015 X + 701,6 – 7,016X / 100 = 6,941
-1,001 X + 701,6 = 694,1
1,001 X = 7,5
X= 7,425 %
Y= 92,575 %
Risposta corretta C
25-Indicare l’affermazione ERRATA:
A) La misura di 279,4 mm, ottenuta nella valutazione di un lato di un foglio di carta A4 con un metro che ha una suddivisione in mm, ha quattro cifre significative
B) se la misura della risposta A fosse effettuata con un metro avente suddivisioni di 1 cm invece che di 1 mm, la misura sarebbe di 27,9 cm
C) il numero di cifre significative di una grandezza misurata è correlata alle caratteristiche dell’apparecchio di misura
D) nella valutazione delle cifre significative di un dato, tutti gli zeri prima della virgola sono significativi, quelli dopo no
soluzione
le risposte A,B,C sono corrette mentre quella errata è D in quanto glizeri prima della virgola non hanno significato che invece hanno gli zeri dopo la virgola
27-Indicare la massa d’acqua che bisogna aggiungere a 1 kg di una soluzione acquosa di HNO3 al 56,5% per portarla al 20%:
A) 0,910 kg
B) 1,36 kg
C) 2,51 kg
D) 1,82 kg
soluzione
Utilizziamo il sistema a croce
56,5 20
20
H2O 36,5
ciò indica che ogni 20 parti di acido bisogna usare 36,5 parti di acqua per ottenere una soluzione al 20% .
pertanto se per 20 g di acido ne devo usare 36,5 di acqua allora per 1000 g ne dovrò usare X
X= 36,5 x 1000 /2 = 1825 g cioè 1,825 Kg
risposta corretta D
27-Un neutrone ha all’incirca la stessa massa di:
A) una particella alfa
B) una particella beta
C) un elettrone
D) un protone:
soluzione
un PROTONE ha la stessa composizione in quarks di un NEUTRONE ciò che cambia è la carica ma non la massa infatti :
protone = 2 quarks up + 1 quark down
carica del protone= 2 x 2/3 – 1/3 = 4/3 -1/3 = 3/3 = + 1
neutrone = 2 down + 1 up ; carica del neutrone : 2 x –1⁄3e. + 2/3 = 0
Nota importante!!!
Se sommiamo le masse dei tre quark, sia per il protone che per il neutrone, il totale risulta essere solo l’1% della massa del protone e del neutrone: il 99% della massa del protone sembra non esserci nonostante le misure dimostrino il contrario. Insomma, esiste molta più massa di quella che è possibile misurare. Tanto è vero che Albert Einstein pubblicò un articolo in cui dimostrò che massa ed energia sono due aspetti indissolubilmente legati e commutabili E= mC2. Le scoperte di Einstein permisero di comprendere il motivo per cui la massa del protone risulta maggiore della somma dei 3 quarks. I tre quark all’interno del protone giustificano solo l’1% della sua massa, però sono legati tra loro da forze eccezionalmente intense, quindi la maggior parte della massa del protone scaturisce dall’energia in gioco nel movimento dei quark al suo interno e dall’energia del legame che li tiene uniti.
risposta corretta D
28- Indicare la proposta che riporta isotopi:
A) C-14 e N-14
B) O-16 e O-18
C) I-131 e Tc-131
D) Rn-222 e Ra-222
soluzione
sappiamo che gli isotopi di un elemento differiscono esclusivamente per la massa cioè per il numero di neutroni e non per il numero di protoni o elettroni, quindi tra le proposte presentate gli isotopi sono solo O-16 e O-18 che differiscono tra loro solo per la massa( 16 il primo e 18 il secondo).
29-Uno ione con 5 protoni, 6 neutroni e carica 3+ ha numero atomico:
A) 5
B) 6
C) 8
D) 11
soluzione
Un atomo X è così rappreentato:
![]()
dove A= numero di massa(somma tra protoni e neutroni)
Z numero atomico (numero di protoni)
Il numero atomico (indicato solitamente con Z, dal termine tedesco Zahl, che significa numero, e detto anche numero protonico) corrisponde al numero di protoni contenuti in un nucleo atomico. In un atomo neutro il numero atomico è pari anche al numero di elettroni. In uno ione con carica +3 vi sono 3 elettroni in meno rispetto all’atomo neutro, ma il numero atomico rimane sempre uguale.
30-Indicare la triade di gruppi del sistema periodico che contiene il maggior numero di elementi classificati come semimetalli (o metalloidi, termine sconsigliato da IUPAC) :
A) 1, 2 e 13
B) 12, 13 e 14
C) 14, 15 e 16
D) 16, 17 e 18
soluzione

i semimetalli sono quegli elementi le cui caratteristiche sono a volte quelle dei metalli ed a volte dei non metalli e quindi possiedono carattere anfotero.Nella tavola periodica che vedi sopra, i semimetalli si trovano lungo la linea immaginaria che unisce il boro con il polonio che separa il celeste dal verde.
Si deduce che la risposta corretta (??) è D
31- Indicare l’elemento che ha normalmente raggio ionico minore del suo raggio atomico:
A) Cl
B) N
C) Na
D) S
soluzione
osserviamo la distribuzione elettronica degli elementi indicati:
Cl = [Ne] 3s23p5
N= [He] 2s22p3
Na = [Ne] 3s1
S = [Ne] 3s²3p⁴
da queste distribuzioni si evince che se si elimina un elettrone dall’orbitale esterno di tipo P sia per Cl che per N ed S il raggio atomico ed il raggio ionico rimangono uguali in quanto vi sono sempre altri elettroni P, mentre nel sodio se si elimina l’elettrone S il raggio atomico è più grande del raggio dello ione Na+ che si forma .
32-Una soluzione acquosa di bromuro di idrogeno al 48,5% ha densità pari a 1,488 g /cm3. La concentrazione in g per dm3 della soluzione è:
A) 1,34 g dm-3
B) 9°8,5 g dm-3
D) 722 g dm-3
soluzione
essendo la d= 1,488 g/ml allora 100 ml peserebbero 148,8 g quindi 48,5 ml pesano X coè 72,17 g /100ml cioè 721,7/1000
quindi la concentrazione in g/dm3 = 721,7 g/dm3 essendo 1 dm3 =1000 ml.
Risposta corretta D
33-Una soluzione acquosa di H2SO4 al 96,4% ha densità pari a 1,835 g cm-3. Indicare il volume che contiene una mole di acido:
A) 55,4 cm3 mol-1
B) 101 cm3 mol-1
C) 27,5 cm3 mol-1
D) 15,7 cm3 mol-1
soluzione
dalla densità si evince che 100 ml corrispondono a 183,5 g se fosse al 100 % ma è al 96,4% quindi spono in realtà 176,9 g in 100 ml
pertanto se in 1oo ml vi sono 176,9 g in X ml :1 mole cioè 98 g
X= 98 x 100 / 176,9 = 55,4 ml
risposta corretta A
34- 12,5 g si solfato di nichel esaidrato vengono sciolti in acqua, a 23 °C, in un matraccio tarato di 500 cm3. Indicare, nell’ ordine, la concentrazione molare del sale nei 500 cm3 della soluzione e in 100 cm3 della stessa:
A) 2,51 10-2 mol dm-3; 5,02 ·10-3 mol dm-3
B) 3,21 10-2 mol dm-3; 6,42 ·10-3 mol dm-3
C) 1,55 10-2 mol dm-3; 1,55 10-2 mol dm-3
D) 9,51 10-2 mol dm-3; 9,51 10-2 mol dm-3
soluzione
la concentrazione è sempre espressa in moli/litro quindi in questo caso 12,5 / PM in 500 ml cioè 12,5 /262,85= 0,047555 moli in 500 ml quindi in 1000 ve ne sono X
500: 0,047555 = 1000 :X
X1= 47,555/500 = 0,0951 moli/L = 9,51 x 10 -2 mol/dm3 = concentrazione acido
la concentrazione in moli/l è sempre riferita ad 1 litro quindi anche se abbiamo 100 ml la concentrazione è sempre uguale
per esempio in 10 ml di soluzione la concentrazione sarà sempre la stessa cioè quella che si riferisce ad i litro di soluzione.
Cambia il numero di moli in 10 0 100 ml ma non la concentrazione.
35- Secondo la legge italiana, il limite di emissione del fosforo nelle acque superficiali è di 10 ppm (in massa; mg/kg), perciò la concentrazione di ioni fosfato nelle stesse acque è di:
A) 3,22 ·10-4 mol dm-3
B) 1,71 ·10-4 mol dm-3
C) 1,23 ·10-3 mol dm-3
D) 3,67 ·10-3mol dm-3
soluzione
10 mg corrispondono a 10/PM = moli P = 10/31 = 0,322 milli moli in 1000 ml cioè 0,000322 moli/1000 = 3,22 x 10-4 moli/l
36 -All’analisi elementare si trova che l’emoglobina contiene lo 0,335% di Fe, perciò, sapendo che essa contiene 4 ioni di ferro, la sua massa molecolare è:
A) 6,70 ·104u
B) 1,67 ·104u
C) 3,40 ·103u
D) 2,89 ·102u
soluzione
calcoliamo prima la massa di ferro a cui corrispondono 4 atomi
55,85 x 4 = massa di Fe =223,4 g
se il 100% rappresenta tutta la molecola di emoglobina contenente 4 atomi di ferro che ne costituisce lo 0,335% corrispondente a 223,4 g allora calcoliamo il peso molecolare dell’emogglobina considerando che :
se 100 rappresenta il PM emoglobina allora lo 0,3335 % di ferro rappresenta il peso del ferro presente nell’emoglobina cooè 223,4 g
100:PM = 0,335: 223,4 da cui PM = 66686,6 g PM= 6,7 x 104 u
risposta corretta A
37- In base alla legge di Lavoisier, nelle reazioni fredde, la somma delle masse dei reagenti deve essere eguale a quella dei prodotti. Pertanto è ERRATO affermare:
A) le relazioni tra le masse di reagenti e prodotti sono rigorose come la legge di conservazione della massa
B) le relazioni tra le masse di reagenti e prodotti di una reazione non richiedono nessuna conoscenza circa il loro stato fisico
C) le relazioni tra masse di reagenti e prodotti non richiedono alcuna conoscenza delle vere formule molecolari (es. sapere se si ha 2 O3 al posto di 3 O2)
D) le relazioni tra masse richiedono la precisa conoscenza delle vere formule molecolari
soluzione
è fondamentale conoscere le formula molecolari in una reazione per cui la risposta corretta è D
38-38. Indicare se esistono elementi naturali radioattivi:
A) sono tutti quelli che hanno Z compreso tra 84 e 92
B) sono tutti quelli che hanno Z maggiore di 92
C) sono solo due: polonio e uranio
D) sono gli elementi Fr, Ra, Th, Pa e U
39. Un recipiente chiuso contiene i gas CO2, N2 e Ar. Le moli di Ar sono il triplo delle moli di CO2 e queste ultime sono uguali alle moli di N2. Se la pressione totale è pari a 15 atm è corretto affermare che:
A) la pressione parziale di CO2 è 5 atm
B) la pressione parziale dell’argon è 9 atm
C) la pressione parziale dell’argon è 15 atm
D) la pressione dell’azoto molecolare è 9 atm
40. Un elettrone, confrontato a un protone, ha:
A) la stessa massa e la stessa carica
B) una carica opposta e la stessa massa
C) una carica opposta e una massa maggiore
D) una carica opposta e una massa minore
Qui terminano i quesiti comuni delle classi A e B. Proseguono quelli della A fino al n° 60. Dopo riprendono (dal n° 41) quelli della classe B.
41. Una resina capace di catturare ioni Ca2+ ha formula C8H7SO3Na. Essa agisce secondo la reazione:
Ca2+ + 2 C8H7SO3Na → (C8H7SO3)2 Ca + 2 Na+
che avviene con resa del 100%. Indicare la massima capacità della resina di depurare un’acqua dal Ca2+, espressa in mol di ioni per grammo di resina:
A) 1,2 ·10-3 mol di Ca2+ g-1
B) 2,4 ·10-3 mol di Ca2+ g-1
C) 4,8 ·10-3 mol di Ca2+ g-1
D) 3,5 ·10-5 mol di Ca2+ g-1
42. Il DDT era preparato per reazione del cloralio con clorobenzene, secondo la reazione:
CCl3CHO (cloralio) + 2 C6H5Cl (clorobenzene) → (C6H4Cl)2CHCCl3 (DDT) + H2O.
Indicare quanto DDT si può ottenere, con una resa quantitativa, da
100 kg di cloralio e 100 kg di clorobenzene.
A) 200 kg
B) 157 kg
C) 187 kg
D) 210 kg

43. E’ noto che i solidi più simmetrici hanno cristalli cubici. Nel sistema cubico sono possibili tre tipi di reticoli: semplice, a facce centrate ed a corpo centrato (figura: A, B, C):
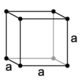

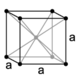
cubico a facce centrate a corpo centrato
Dalle proprietà della cella elementare si può calcolare la densità del cristallo perfetto. Indicare l’affermazione ERRATA a proposito di tale calcolo. La massa di una cella elementare si ottiene effettuando la somma delle masse degli atomi che si possono attribuire alla cella, ovvero:
A) 1/8 degli ioni ai vertici della cella
B) ¼ degli ioni sugli spigoli della cella
C) tutti gli ioni all’interno della cella
D) 1/6 della differenza tra ioni positivi e negativi
struttura tipo cloruro di sodio

Nel cloruro di sodio (NaCl) ciascuno dei due tipi di atomo forma un reticolo cubico a facce centrate;
i due reticoli si compenetrano in modo che ogni atomo di un tipo sia al centro di una cella unitaria del reticolo cubico a facce centrate degli altri atomi.
Si può considerare che gli anioni Cl– più grandi (r = 181 pm) formino un reticolo a facce centrate, mentre i cationi Na+ più piccoli (r = 102 pm) occupano gli interstizi ottaedrici. In ogni caso sia Na+ che Cl– sono esacoordinati con geometria ottaedrica.
In prima approssimazione si può prevedere che questa struttura si formi più facilmente quando il rapporto tra raggio del catione e raggio dell’anione è compreso tra 0,41 e 0,73.[1] I composti binari che cristallizzano con la struttura tipo NaCl sono più di 400. Alcuni esempi sono alogenuri di sdio litio calcio e rubidio ed ossidi di metalli bivalenti (MgO, CaO, SrO, MnO, CoO…), alogenuri d’argento (tranne AgI), leghe interstiziali.
Struttura tipo cloruro di cesio
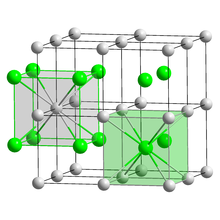
Nel CsCl ciascuno dei due tipi di atomo forma un reticolo cubico semplice; i due reticoli sono interpenetrati in modo che ogni atomo di un tipo sia al centro di una cella unitaria del reticolo cubico semplice degli altri atomi. Alternativamente, si può considerare che gli anioni Cl– (r = 181 pm) formino un reticolo cubico semplice, con un catione Cs+ (r = 167 pm) al centro di ciascun interstizio cubico. In questo modo ogni ione è circondato da otto ioni di carica opposta con simmetria cubica. In prima approssimazione si può prevedere che questa struttura si formi più facilmente quando il rapporto tra raggio del catione e raggio dell’anione è maggiore di 0,73. La struttura tipo CsCl è molto meno comune di quella tipo NaCl; oltre a CsCl è adottata ad esempio da CsBr, CsI, TiCl, TiBr.
Struttura tipo solfuro di zinco

Questa struttura è detta anche tipo blenda di zinco dal nome del minerale dove ricorre questa struttura. Analogamente alla struttura tipo NaCl, anche nella struttura tipo ZnS ciascuno dei due tipi di atomo forma un reticolo cubico a facce centrate, ma i due reticoli sono interpenetrati in modo differente, ponendo gli ioni Zn2+ in modo da occupare metà degli interstizi tetraedrici. In questo modo ogni ione è circondato da quattro ioni di carica opposta con simmetria tetraedrica. Questo reticolo cristallino è analogo a quello del diamante, che si ottiene scambiando tutti gli atomi Zn e S con atomi di carbonio. In prima approssimazione si può prevedere che questa struttura si formi più facilmente quando il rapporto tra raggio del catione e raggio dell’anione è compreso tra 0,22 e 0,41. La struttura tipo ZnS è presente in molti composti binari. Alcuni esempi sono BN, CdS, CuCl, HgS.
per rispondere al quesito ricordiamo che
1/8 è esatto per il cristallo tipo NaCl
quindi anche le risposte B e C sono corrette.
Non ha senso invece la risposta D in quanto 1/6 della differenza tra ioni positivi e negativi non significa alcunchè.
44. Indicare la struttura più plausibile dello ione azoturo:
⌈N=N=N:⌉– ⌈ N-N≡N⌉– ⌈N≡N-N⌉–
A B C
A)
B)
C)
D la forma più plausibile è una forma ciclica triangolare quì non riportata
soluzione
Gli azoturi, chiamati impropriamente anche azidi (dall’inglese Azide), sono composti binari formati dall’azoto con un metallo o con gruppi organici. Sono considerati sali dell’ acido azotidrico HN3. L’azide è anche riferito ad un gruppo funzionale in chimica organica, RN3.
N3− è un anione pressoché lineare isoelettronico con CO2 ed N2O con distanze di legame pari 116 pm.
N3− ha la struttura di lewis seguente :
![]()
gli orbitali molecolari sono identici a quelli della CO2

la risposta corretta è la struttura A
45. Indicare la massa di HCl anidro contenuto in un volume di 5 cm3 di una soluzione acquosa di HCl conc. (37,0%) e avente densità 1,19 g /cm3 :
A) 2,44 g
B) 1,11 g
C) 2,98 g
D) 2,22 g
soluzione
dal valore della densità si ricava che 1 ml pesa 1,19 g quindi 5 ml peseranno 5 x 1,19= 5,95 g
siccome l’acido non è al 100% ma al 37% la quantità corretta è calcolata dalla proporzione:
se in 100 ve ne sono 37 in 5,95 ve ne sono X
X = 5,95 x 37/100 =2,20
risposta corretta D
46. Indicare il volume di H2SO4 conc. (98%), con densità pari a 1,84 g cm-3 , che contiene una massa di 40,0 g di H2SO4 puro:
A) 11,1 cm3
B) 22,2 cm3
C) 33,3 cm3
D) 4,12 cm3
soluzione
dal valore della densità sappiamo che 1 ml di acido pesa 1,84 g quindi 4o g sono contenuti in X ml
1:1,84 = 40 : X
X= 40x 1,84 / 1 = 21,73 ml
tuttavia l’acido non è al 100% bensì al 98% quindi la quantità reale di 40 g pari a 21,73 ml è calcolata dalla proporzione:
se in 100ml vi sono 98 ml reali in X ve ne saranno 21,73
X= 21,73 x 100 /98 = 22,17 = 22,2
risposta corretta B
47. Indicare a che volume deve essere portata una soluzione di BaCl2 (0,50 M) per ottenere una soluzione che contiene 20 mg di Ba2+ per cm3 . 1 cm3 deve essere diluito:
A) a 23,44 cm
B) a 3,44 cm3
C) a 1,44 cm3
D) a 5,14 cm3
soluzione
BaCl2 : Ba =X: 0,002 g X= grammi di BaCl2 contenenti 20 mg di Ba+2
208,24 : 137,33 = X :0,00 20 g X= 0,0304 g di BaCl2 che contengono 20 mg di Ba+2
quindi 0,034 / 208,24 moli = 0,000145 moli in 1 ml cioè 0,145 moli /litro cioè la nuova soluzione deve essere 0,145 M
sapendo che V1 x M1 = V2 x M2 e sapendo che
M1 =0,5 M V1 = 1 ml
M2 = 0,145 M e V2 =X possiamo calcolare X
1 x 0,5 = V2 x 0,145 V2= 0,5 / 0,145 = 3,44 ml
risultato corretto B
48. Una soluzione acquosa contiene 10,0 g di acido acetico (CH3COOH) in 125 g di acqua. Indicare la molarità dell’acido e la sua frazione molare x:
A) 1,33 M; x = 0,024
B) 1,33 M; x = 0,976
C) 2,03 M; x = 0,124
D) 1,33 M; x = 0,986
soluzione
1n 125 ml vi sono 10 g ed 1n 1000 ve ne sono X X= 80 g cioè 80 / 60 = moli 1,33moli/l quindi la molarità è Molarità = 1,33 M
la frazione molare è calcolata da:
moli acido = 80 / 60 = 1,33
moli acqua = 1000 /18 =55,5
Fraz molare=1,33 /55,5 + 1,33= 1,33 / 56,83= 0,0234
risposta corretta A
49. La molecola del diossido di carbonio è:
A) lineare e diamagnetica
B) a V e paramagnetica
C) angolata di 120 ° e diamagnetica
D) angolata e paramagnetica
soluzione
la distribuzione elettronica negli orbitali molecolari dela CO2 è tale da non presentare elettroni non accoppiati quindi la molecola è diamagnetica
diamagnetismo è una forma di magnetismoche tutti i materiali mostrano in presenza di un campo magnetico Si tratta di un effetto molto debole di natura quantistica, che viene annullato se il materiale possiede altre proprietà magnetiche come il ferromagnetismo o il paramagnetismo . I materiali in cui il diamagnetismo si manifesta in maniera rilevante sono detti materiali diamagnetici e sono caratterizzati dal fatto che la magnetizzazione ha verso opposto rispetto al campo magnetico applicato, quindi questi materiali ne vengono debolmente “respinti”.

Il biossido di carbonio, o CO2, ha tre strutture di risonanza, di cui una contribuisce maggiormente
alla struttura risonante. La molecola di CO2 ha un totale di 16 elettroni di valenza :4 di carbonio e 6 di ciascun
atomo di ossigeno. Ecco le tre strutture di risonanza per CO2, tutte che rappresentano i 16 elettroni di valenza
 la struttura 1 sarà più stabile e quindi contribuirà maggiormente, poiché non ha alcuna separazione di carica.
Le strutture 2 e 3 mostrano la separazione della carica causata dalla presenza di cariche formali su entrambi
gli atomi di ossigeno. Inoltre, la presenza di una carica positiva sull'ossigeno riduce ulteriormente la stabilità
di queste due strutture.
la struttura 1 sarà più stabile e quindi contribuirà maggiormente, poiché non ha alcuna separazione di carica.
Le strutture 2 e 3 mostrano la separazione della carica causata dalla presenza di cariche formali su entrambi
gli atomi di ossigeno. Inoltre, la presenza di una carica positiva sull'ossigeno riduce ulteriormente la stabilità
di queste due strutture.
Questo composto ha due gruppi di elettroni attorno al carbonio. Secondo la teoria VSEPR, le due serie di elettroni si orienteranno a 180 °, su lati opposti dell’atomo di carbonio, riducendo al minimo la repulsione di elettroni. Pertanto la struttura molecolare della CO2 è lineare.

risposta corretta A
50. Se si mescolano volumi uguali di due soluzioni aventi la stessa concentrazione molare, una di un acido forte monoprotico e una di una base forte monoacida, la soluzione risultante:
A) è neutra
B) è acida perché l’acido prevale
C) assumerà un valore superiore o inferiore a 7 infunzione della natura dell’acido e della base
D) è minore di 7 perché in chimica prevalgono le basi
soluzione
Dobbiamo dire che una base generica AOH si dissocia in acqua formando A- + OH-
AOH <=> A- + OH-
A– viene definito acido coniugato della base AOH e questo è il motivo per cui nel quesito la base viene definita monoacida.
Detto questo, sappiamo che l’acqua pura si dissocia:
2H2O <=>H3O+ + OH– oppure H2O <=>H+ + OH–
infatti [H3O+] si può ritenere uguale ad [H+] essendo il comportamento chimico dei due ioni uguale.
pertanto per la legge di Gouldeberg -Waage
Keq= [H+][OH-] / [H2O] dove Keq= 1,8 x 10 -16
in questa espressione le concentrazioni sono espresse in moli/litro per cui
[H2O]= 1000 g /18 = 55,5 moli/l
quindi [H+] [OH-]= 1,8 x 10 -16 x 55,5 = 1 x 10 -14
La nuova costante che deriva da Keq x 55,5 è detta Kw (costante di dissociazione dell’acqua) quindi
[H+] [OH-]= Kw = 10-14
Dalla reazione di dissociazione dell’acqua si ha che [H+] = [OH-] quindi [H+]2 = 10-14 [H+] = √10-14 = 10-7
pertanto PH = -log [H+]= -log 10-7 = 7 ed è evidente che [OH-]= 10-7 POH = -log[OH-]= 7
quindi PH+POH =14
concludiamo questa digressione dicendo che quando le concentrazioni di H+ e di OH- sono uguali il PH =7 e la soluzione è neutra.
Il quesito indica che le quantità di H+ provenienti dall’ acido sono uguali alle quantità di OH- provenienti dalla base per cui ne deriva che la soluzione è neutra.
51. Se si pone in “freezer”per 24 ore una bottiglia di plastica chiusa, colma fino all’orlo di acqua
minerale gasata:
A) la si recupera rimpicciolita con l’acqua liquida diventata ghiaccio
B) la si recupera immutata nella forma con l’acqua liquida diventata ghiaccio
C) la plastica si romperà a causa dello sviluppo del gas che a freddo è meno solubile
D) la bottiglia si romperà a causa dell’ espansione del ghiaccio che si è formato
soluzione
i liquidi se riscaldati subiscono una dilatazione calcolabile dalla relazione V=V0⋅(1+α⋅Δt) dove α è il coefficiente di dilatazione che è da 10 a 100 volte maggiore di quello di un solido.
L’acqua però ha un comportamento anomalo.
A temperature comprese tra 0° e 4° C il volume dell’ acqua diminuisce se riscaldata,mentre per raffreddamento forma il ghiaccio che rispetto al liquido aumenta di volume contrariamente a quanto avviene per gli altri liquidi.
Nel caso di basse temperature, infatti, lo strato superficiale dell’acqua comincia a raffreddare e, di conseguenza, diminuisce il suo volume quindi aumenta la densità e per le leggi di Archimede, la parte più densa superficiale tende a scendere verso il basso, permettendo all’ acqua più calda che si trova in fondo di risalire verso l’alto.
Questo processo si ripete fino a quando tutta l’acqua non raggiunge una temperatura omogenea.Di conseguenza, poiché lo strato superficiale è continuamente sottoposto a raffreddamento dall’ ambiente esterno, si ha ora un aumento del volume, con conseguente diminuzione della sua densità. A questo punto, essendo lo strato superficiale meno denso dell’ acqua sottostante, esso tende a rimanere in superficie; il continuo raffreddamento fa si che questo strato passi dallo stato liquido a quello solido, con formazione di ghiaccio superficiale.Queste particolari caratteristiche dell’ acqua sono dovute ai legami idrogeno, che conferiscono alla struttura molecolare dell’acqua solida una forma più regolare e geometrica rispetto all’acqua liquida.
La struttura cristallina è caratterizzata da una simmetria esagonale e da angoli di legame che si approssimano a quelli di un tetraedro. Questo angolo di legame tetraedrico della molecola d’acqua è la spiegazione principale della bassa densità del reticolo cristallino tale disposizione con angoli tetraedrici,infatti,comporta un ‘aumento di volume del reticolo cristallino dal momento che i grossi anelli esagonali lasciano sufficiente spazio perché un’altra molecola d’acqua si possa inserire dentro ed aumentare il volume.
Da quanto detto ne deriva che se si conserva in freezer una bottiglia di vetro contenente acqua il volume aumenta e la bottiglia si rompe.
risposta corretta D
52. I tre isotopi dell’ossigeno naturale sono 16O, 17O e 18O:
A) i primi due sono radioattivi, il terzo ha il nucleo stabile
B) i primi due sono stabili, il terzo è radioattivo
C) sono tutti stabili
D) l’isotopo con numero di massa dispari radioattivo, gli altri due sono stabili
soluzione
La stabilità di un nucleo dipende dal rapporto Z/A cioè dal rapporto tra numero di protoni (numero atomico Z) e la somma di protoni e neutroni (numero di massa A) e solo una piccola quantità di nuclei specialmente quelli con numeri atomici sino a circa 20 è stabile in quanto hanno un rapporto massimo Z/A di circa ½ (cioè hanno ugual numero di protoni e neutroni). Quando gli atomi più pesanti possiedono un numero di neutroni che eccede leggermente il numero di protoni allora il loro nucleo è instabile e tende sempre a diventare stabile mediante emissione di particelle il che determina la loro radioattività.( Per Z>82 vi sono solo isotopi instabili).Nel caso dell’ossigeno il rapporto Z/A per tutti e tre gli isotopi è inferiore a 1/2 quindi i tre isotopi sono stabili e nessuno dei tre è pertanto radioattivo.
Risposta corretta C
53. Nello ione H2AsO3-il numero di ossidazione dell’arsenico è:
A) +1
B) +2
C) +3
D) +5
soluzione
il numero di ossidazione di un elemento è un numero che viene attribuito ad un atomo a seconda del numero di coppie elettroniche che lo legano ad altri atomi più eletytronegativi o meno elettronegativi:
a)Per ogni coppia di elettroni che lega un atomo ad un altro più elettronegativo si attribuisce il numero +1
b) Per ogni coppia di elettroni che lega un atomo ad un altro meno elettronegativo si attribuisce il numero -1
c) per un legame ad un altro atomo uguale si attribuisce il numero 0 (es C-C O=O ecc) senza distinzioni tra legame semplice doppio o triplo.
Quindi nel composto H2AsO3–
a) ogni atomo di ossigeno (più elettronegativo di AS )è legato ad As con 2 legami quindi ad As si attribuisce il numero + 1 x (2 legami x 3 atomi) quindi + 6
b) essendo As legato all’H che è meno elettronegativo si attribuisce il numero 2 x -1 = -2
c)Trattandosi di uno ione con 1 carica negativa si attribuisce il numero -1
pertanto il n. o. dell’As in H2AsO3– è = + 6 – 2 – 1 = +6-3 = + 3
ATTENZIONE!
non devi confondere il numero di ossidazione con la valenza!
la valenza in passato era definita la capacità di un atomo di combinarsi con uno o più atomi di un altro elemento chimico per formare composti e coincideva numericamente con il numero di atomi di idrogeno che poteva legare a sè.
Per esempio nel composto CH3CH2OH ogni atomo di C possiede 4 legami quindi la valenza è 4 per ognuno degli atomi.
Invece il numero di ossidazione del C cui è legato OH calcolato secondo quanto sopra esposto è:
-2 per il legame con 2 atomi di H
+1 per il legame con l’ossigeno
0 per il legame con l’altro atomo di C
quindi il n. o. del C ossidrilico è – 2 +1 = -1 valore diverso dalla valenza che è 4
La risposta corretta al quesito è C
54. Nella reazione 3 A + B → A3B si pongono a reagire 1,2 mol di A e 0,5 mol di B. La quantità massima di prodotto A3B ottenibile è:
A) 0,5 mol
B) 1,2 mol
C) 0,4 mol
D) 1,7 mol
soluzione
se 3 moli di A reagiscono con 1 mole di B, 1,2 moli reagiscono con X
3 :1 = 1,2 :X X= 1,2 /3 = 0,4 moli
risposta corretta C
55. Rutherford, dirigendo un fascio di particelle alfa, generate dal decadimento radioattivo di radio, ortogonalmente ad un foglio sottile d’oro, confutò il modello atomico di Thomson detto modello a panettone (plum pudding model). Nacque così il modello atomico di Rutherford o modello planetario. La struttura di Thomson non spiegava perché:
A) alcune particelle venissero respinte, Rutherford si aspettava che tutte attraversassero il foglio
B) molte particelle attraversassero il foglio d’oro, egli si aspettava che nessuna lo attraversasse
C) alcune particelle formassero atomi di elio
D) alcune particelle venissero magnetizzate
soluzione
la risposta corretta è A perchè se fosse stata esatta la teoria di Thomson, Rutherford avrebbe dovuto osservare che tutte le particelle dovevano essere respinte. Rutherford osservò invece che la maggior parte delle particelle alfa attraversava la lamina di metallo e poche di esse venivano respinte. (circa 1 su 10000).
Vedi l’esperimento di Rutherford contenuto nel capitolo:” struttura dell’atomo spettri atomici e teoria di Bohr “ su questo stesso blog.
56. Un composto sublima quando passa direttamente dallo stato:
A) di vapore a quello liquido
B) di vapore a quello solido
C) solido a quello liquido
D) solido a quello vapore
soluzione
la sublimazione è il passaggio diretto dallo stato solido a quello vapore.
La differenza tra stato di vapore e stato gassoso consiste nel fatto che il vapore è un gas a contatto col proprio liquido ( per esempio si chiama vapore di ossigeno se il gas è a contatto con l’ossigeno liquido)
Un esempio di sublimazione è il passaggio dello iodio solido a quello di vapore.
risposta corretta D
57. Dalla combinazione tra gli elementi N e O si formano:
A) due diversi ossidi di azoto: NO2 e NO
B) due diversi ossidi di azoto: N2O e NO
C) tre diversi ossidi di azoto: N2O, NO e NO2
D) un numero di ossidi di azoto superiore a tre
soluzione
L’azoto è in grado di formare diversi ossidi:
- il monossido di azoto(NO)
- il biossido di azoto o ipoazotide (NO2, anche come N2O4)
- l’l’ossido di diazoto o protossido di azoto (N2O)
- il il triossido di diazoto anidride nitrosa (N2O3)
- il pentossido di diazoto o anidride nitrica (N2O5)
In modo generico, gli ossidi di azoto che si producono come sottoprodotti durante una combustione che utilizza aria, vengono indicati con NOx
La risposta corretta è quindi D
58. Nel blocco d della tavola periodica:
A) tutti gli elementi presenti sono non-metalli
B) tutti gli elementi presenti sono metalli
C) tutti gli elementi presenti sono semimetalli
D) gli elementi presenti sono in parte metalli e in parte non-metalli
soluzione
se ossserviamo la tavola periodica

notiamo che gli elementi del gruppo d sono metalli di transizione e sono colorati in rosa scuro e sono dallo scandio al rame e sino all’oro. Essi quindi sono tutti metalli.
risposta corretta B
59. Indicare l’affermazione ERRATA:
A) la maggior parte degli elementi della tavola periodica è formata da metalli
B) i non metalli sono concentrati nella parte destra della tavola periodica
C) i gas nobili, 18mo gruppo, possono essere considerati un gruppo particolare di metalli
D) metalli e non-metalli sono separati da una spezzata a cavallo della quale ci sono i semimetalli
soluzione
le risposte A,B,D sono corrette mentre la risposta errata è C in quanto il 18 gruppo è un gruppo a se stante e sono tutti gas (gas nobili) con struttura esterna che presenta orbitali con elettroni tutti accoppiati.
risposta corretta D
60. Se si fanno reagire completamente 1 mol di Na e 0,5 mol di Cl2, a reazione completata saranno
presenti:
A) 1 mol di NaCl
B) 1 mol di NaCl e 0,5 mol di Na
C) 1.5 mol di NaCl
D) 0.5 mol di NaCl e 0,5 mol di Na
la reazione da considerare è
Na + 1/2 Cl2 → NaCl
pertanto da 1 Na e 0,5 di Cl si ottiene 1 NaCl da ciò si deduce che la risposta corretta è A in quanto non rimane alcun residuo nè di Na che di Cl.
Qui terminano i quesiti della classe A, di seguito riprendono i quesiti della classe B
41. Indicare il pH di una soluzione acquosa di NaCN (0,500 M) sapendo che l’acido HCN ha
Ka = 6,20 ·10-10 a 25 °C:
A) 2,55
B) 7,34
C) 11,4
D) 9,10
soluzione
NaCN è un sale formato da una acido debole( HCN ) ed una base forte (NaOH) che in acqua si dissocia in Na+ e CN-
CN- reagisce con l’acqua ( idrolisi del sale) per cui
CN- + H2O <=> HCN + OH- per cui
Kb = [HCN][OH-] / [CN-] [H2O]
ritenendo costante [H2O] ed indicando con Cs la concentrazione [CN- ]del sale si può scrivere
Kb = [OH-]2 / Cs ma Kb= Kw/Ka quindi
[OH-]= √ Kw/Ka x Cs
[OH-]= √(10-14 /6,20 ·10-10) x 0,5 = √ 0,161 x 10 -4 x 0,5 =√ 0,08 x 10-4 = √8 x 10-6 = 2,82 x 10-3
POH= 3-log 2,82= 3 – 0,45 =2,55
PH= 14 .POH = 14 – 2,55 = 11,45
risposta corretta C
42. Il cromato di piombo è un sale i cui componenti sono entrambi pericolosi per la salute umana. Per di più, lo ione cromato è particolarmente mobile. Immaginate che PbCrO4 si sciolga in unterreno con pH = 6,00 a 25°C. Usando le costanti di equilibrio qui riportate, calcolare le concentrazioni all’equilibrio di Pb2+, CrO42-e Cr2O7 2-, a 25 °C (i coefficienti di attività vengono assunti = 1).
Kps (PbCrO4) = 2,82 ·10-13
Ka2 = [H+] [CrO42-] / [HCrO4–] = 3,34 ·10-7
Kd = [Cr2O72-] / [H+]2[CrO42-]2= 3,13 ·1014
A) Pb2+ = 1,06 ·10-3 mol dm-3; CrO42-= 1,46 ·10-7 mol dm-3; Cr2O72-= 3,22 ·10-12 mol dm-3
B) Pb2+= 2,00 ·10-4 mol dm-3 ; CrO42-= 1,16 ·10-7mol dm-3; Cr2O7 2-= 3,11 ·10-11 mol dm-3
C) Pb2+= 1,06 ·10-6 mol dm-3; CrO42-= 2,66 ·10-7 mol dm-3; Cr2O7 2-= 2,21 ·10-11 mol dm-3
D) Pb2+= 3,01 ·10-6 mol dm-3; CrO42-= 4,62 ·10-7mol dm-3; Cr2O72-= 3,24 ·10-11 mol dm-3
soluzione
questo quesito riguarda la solubilità di un sale PbCrO4 in funzione del PH
Infatti in questo caso CrO4-2 che deriva dalla dissociazione di PbCrO4 reagisce con l’idrogeno in soluzione dando origine a HCrO4- ed H2CrO4.
I dati del quesito ci indicano che possiamo limitarci alla formazione di HCrO4- ritenendo che H2CrO4 sia trascurabile.
Da ciò si deduce che Kps = [Pb+2] x ([ CrO4-2] + [HCrO4-])
cioè Kps = S x α S S= √ Kps /α dalla Ka data sopra si ottiene α = Ka/ [H+] + Ka per cui
S= √Kps ([H+] +Ka) / Ka
pertanto S=[Pb+2] = √ 2,82 x 10 -13 x 10-6 + 2,82 x 10-13 x 3,34 x 10-7 / 3,34 x 10-7
S= [Pb+2] = 2,82 x 10 -19 + 9,41 x 10-20 /3,34 x 10-7
S= [Pb+2] =√ 3,76 x 10-19 / 3,34 x 10-7
S= [Pb+2]= √1,125 x 10-12
[Pb+2]= 1,061 x 10-6 moli/l
calcoliamo adesso [CrO4-2] da Kps= [Pb+2][CrO4-2]
[CrO4-2]= 2,82 x 10-13 /1,061 x 10-6 = 2,66 x 10-7 moli/l
quindi calcoliamo [Cr2O7-2] ricordando che [Cr2O72-] / [H+]2[CrO42-]2= 3,13 ·1014
[Cr2O7-2] = 3,13 x 1014 x (10-6)2 x ( 2,66 x 10-7)2
[Cr2O7-2] = 2,21 x 10-11 moli/l
la risposta corretta è C
43. Secondo la teoria di Bronsted e Lowry, NaOH si comporta da base forte in acqua:
A) perché contiene gruppi OH e in acqua si dissocia completamente liberandoli come ioni OH-
B) i sui ioni OH, già presenti nel cristallo, una volta che l’idrossido è sciolto in acqua, strappano quantitativamente protoni all’acqua
C) perché OH è la base coniugata dell’acido debole H2O, quindi per definizione è forte
D) perché in acqua gli ioni OH legano tutti gli ioni H+ liberi in acqua
soluzione
Secondo Brønsted e Lowry, un acido è una specie chimica capace di donare uno ione H+ ad un’altra specie chimica; similmente, una base è una specie chimica capace di accettare uno ione H+ da un’altra specie chimica.
La definizione di Brønsted e Lowry implica che una sostanza ha bisogno della presenza dell’altra per manifestare il proprio comportamento acido o basico.

l’acqua si comporta da acido e necessita dell’OH- che riceve H3O+ , e viceversa si comporta anche da base e necessita di H3O+ che acquisti OH-.
HCl è un acido perché cede H+ all’OH- dell’acqua ed NaOH è una base perché cede OH- all’H3O+ dell’acqua.
Secondo Arrhenius invece, gli acidi sono definiti come sostanze che, sciolte in acqua, liberano ioni H+ (ioni idrogeno). Le basi, invece, sono tutte quelle sostanze che liberano ioni OH– (ioni idrossido).
In generale però una base è un composto o ione che è in grado di cedere elettroni, mentre un acido è un composto o ione che acquista elettroni.
44. Un composto organico otticamente inattivo, X, ha formula molecolare C5H12O. Per ossidazione
controllata con CrO3 in piridina forma un composto Y, di formula C5H10O, che non reagisce con il
reattivo di Fehling o di Tollens e per riduzione con NaBH4 ridà lo stesso composto X di partenza.
Indicare la formula di X:
A) A
B) B
C) C
D) D
soluzione
Il reattivo di Tollens è costituito da idrossiammoniato d’argento (ovvero ione Diamminoargento) serve per evidenziare le aldeidi che reagiscono con il reattivo, formando il corrispondente acido carbossilico ( trasforma il gruppo CHO ossidandolo in COOH in cui il C con n.o. da +1 forma un C con n.o.+3 riducendo nel contempo l’Ag da +1 a 0 che si deposita sulle pareti della provetta sotto forma di sottile strato a specchio, (da cui il nome “specchio d’argento”).
Il reattivo di Fehling è un reattivo specifico di alcuni glucidi e consiste i due parti di Fehling A e Fehling B;
A è costituito da solfato di rame pentaidrato (CuSO4·5 H2O) (69,278 g/l di soluzione)
B è costituito da tartrato di sodio e potassio (sale di Seignette) + NaOH (idrossido di sodio): 346g + 100g di NaOH/l di soluzione.
un caratteristico precipitato di solfato di rame (I) rosso mattone conferma la presenza di un carboidrato (che è un riducente).
Il rame della soluzione A viene mantenuto in soluzione come ione rameico grazie al tampone tartrato di sodio e potassio (Fehling B) che lo complessa favorendo la tautomeria cheto enolica perché altrimenti il rame precipiterebbe come idrossido dato l’ambiente basico dovuto ad NaOH.
Quindi l’ossidazione con CrO3 non forma certamente un’ aldeide considerato che non reagisce nè col tollens nè con Fehling ma può formare un chetone infatti C5H10O è un chetone:
questo composto per riduzione riforma l’alcol di partenza
risposta corretta A
45. Indicare il pH di una soluzione acquosa contenente acido lattico (CH3CHOHCOOH) 0,12 M e lattato di sodio 0,10 M sapendo che la Ka dell’acido è 1,4 10-4 :
A) 10,33
B) 3,77
C) 2,45
D) 4,65
soluzione
la soluzione è costituita da un acido debole e dal suo sale e pertanto siamo in presenza di una soluzione TAMPONE.
Riscriviamo l’acido debole come un generico HA che si dissocia in H+ +A-
per la legge di Gouldeberg-Waage si ha :
[H+][A-]/[HA] = ka tuttavia
[HA]=Ca (concentrazione dell’acido)
[A-] = Cs (concentrazione del sale)
si ha pertanto [H+] Cs /Ca = Ka cioè [H+] = ka Ca/Cs da cui possiamo calcolare [H+] e quindi ikl PH
Nel caso del quesito Ca= 0,12 moli/l e Cs= 0,10 moli/l quindi
[H+]= 1,4 x 10-4 x 0,12 / 0,1 [H+]= 1,4 x 10-4 x 1,2 = 1,68 x 10-4
PH= -log[H+] = 4- log 1,68 = 4 – 0,22 = 3,77
risposta corretta B
46. Un campione di polvere (1,599 g) contiene ossido di magnesio e carbonato di magnesio. Per
determinare la composizione del campione, un chimico lo scalda fino a completo svolgimento di
CO2 da parte del carbonato e determina il peso finale del residuo composto da MgO puro (1,294
g). Le percentuali dell’ossido e del carbonato sono:
A) MgO = 63,5 %; MgCO3 = 36,5 %
B) MgO = 46,5 %; MgCO3 = 56,5 %
C) MgO = 26,5 %; MgCO3 = 73,5 %
D) MgO = 36,5 %; MgCO3 = 63,5 %
soluzione
La CO2 proviene solo dal carbonato MgCO3 per cui dai 1,599 g iniziali costituiti da MgO + MgCO3 la CO2 è 1,599 g- 1,294 g = 0,304 g
Possiamo adesso calcolare i grammi di MgCO3 che hanno generato 0,304 g di CO2 infatti :
se da una molecola di MgCO3 si ottiene una molecola di CO2 allora da X molecole di MgCO3 se ne ottengono 0,304 g pertanto:
MgCO3 : CO2 = X : 0,305 84,3 : 44 = X :0,305 X= 0,584 g di MgCO3 iniziali
per ottenere la % di MgCO3 si ricorre alla proporzione:
se in 1,599 g vi sono 0,584 g di MgCO3 in 100 g ve ne sono X
1,599 :0,584 = 100 :X X = 36,5%
ovviamente MgO iniziale è contenuto per il 63,5%
risposta corretta A
47. Indicare l’affermazione ERRATA. Ogni sostanza, in fase solida o liquida, libera particelle allo stato gassoso. Se la sostanza si trova in un recipiente chiuso, dopo un tempo adeguato, si stabilisce un equilibrio tra le particelle che passano dallo stato condensato allo stato gassoso e quelle che compiono il percorso opposto. La pressione del gas in equilibrio con il proprio liquido o solido:
A) è detta pressione di vapore o tensione superficiale e dipende dalla natura chimica della sostanza, dall’estensione della superficie della sostanza e dal volume del recipiente
B) è detta pressione o tensione di vapore e dipende dalla natura chimica della sostanza ma non dall’estensione della superficie della sostanza e dal volume del recipiente
C) dipende dalla natura della sostanza e dalla temperatura
D) non dipende dalla quantità della sostanza
soluzione
Se una sostanza liquida è posta in un recipiente in cui vi è il vuoto, se si mantiene la temperatura costante, le molecole di liquido che si trovano nello strato superficiale passano allo stato aeriforme con una certa velocità V1 e la loro concentrazione aumenta progressivamente. Nel loro movimento caotico, però, esse urtano nuovamente la superficie del liquido e vengono così trattenute sulla superficie e ciò avviene con velocità V2. Vi sarà un momento in cui le due velocità saranno uguali (V1=V2) ed allora si dice che il vapore saturo è in equilibrio col liquido. Se si misura a questo punto la pressione del vapore in equilibrio col liquido, il suo valore è chiamato Tensione di Vapore. Il valore della Tensione di Vapore dipende quindi dalla natura della sostanza e dalla temperatura ma non dal volume del recipiente o dalla superficie di liquido. Infatti la tensione di vapore di un liquido aumenta al crescere della temperatura, perché le molecole acquistano maggior energia cinetica ed hanno così una maggiore tendenza a passare allo stato aeriforme ma questa tendenza, a tempertura costante, è sempre identica anche se la superficie del liquido è diversa o il volume del recipiente è diverso.
Si deduce che la risposta errata è A
48 – In un esperimento si sciolgono 3,20 g di zolfo in 100g di naftalina liquida. Sapendo che la soluzione ottenuta ha un punto di congelamento più basso di 0,860 °C rispetto a quello del solvente puro, calcolare la formula molecolare dello zolfo nella soluzione (Kcr = 6,8 °C mol-1 kg):
A) S
B) S2
C) S8
D) S3
soluzione
Dall’equazione ΔT = Kf x m ricaviamo la molalità m della soluzione:
m = ΔT/ Kf = 0,860/ 6,8 = 0,126 m
la molalità è definita come moli di soluto / chilogrammi di solvente:
m = mol/Kg per cui essendo 100 i g di solvente cioè 0,1 Kg
0,126 = moli di soluto/ 0.100 Kg
da cui:
moli di soluto = 0.126 x 0.100= 0.0126 moli
ma sappiamo che
moli di soluto = massa soluto / peso molecolare
si ha peso molecolare = massa soluto/moli soluto
ovvero, sostituendo i dati si ha:
peso molecolare = 3,2 g/ 0.01265 = 254, g/mol
Sapendo che lo Zolfo pesa 32 g è chiaro che la molecola è costituita da 254/32 atomi = 7,94 = 8 atomi
La risposta corretta è C
49. Indicare la serie che riporta le seguenti sostanze: H2, CO, HF, Ne, BaCl2 in ordine di punto
di ebollizione crescente:
A) BaCl2 < HF < H2 < CO < Ne
B) H2 < Ne < CO < HF < BaCl2
C) Ne < H2 < CO < HF < BaCl2
D) HF < CO < Ne < H2 < BaCl2
soluzione
la temperatura di ebollizione è la temperatura alla quale la tensione di vapore di un liquido eguaglia la pressione esterna e il liquido inizia a bollire: essa è determinata dai valori di temperatura e pressione in cui coesistono liquido ed aeriforme. Legami idrogeno o aggregazioni di vario tipo in un liquido fanno aumentare la temperatura di ebollizione.
BaCl2 è un sale che in un liquido esiste sotto forma di ioni che interagiscono col solvente acqua oltre che tra di loro, quindi la t.e. è la più alta.
L’elevata elettronegatività del Fluoro rende il legame H-F estremamente polare che con le dimensioni piccole degli atomi forma aggregati (HF)n (con n che varia da 2 a 6) in cui le molecole sono tenute insieme da legami idrogeno e questo si riflette sul valore del punto di ebollizione che aumenta. La sua t.e. deve essere inferiore a BaCl2.
L’ossido di Carbonio ha struttura seguente :

ed è una molecola polare a causa dell’elettronegatività dell’ossigeno. Ciò comporta attrazioni dipolo-dipolo e crea un leggero aumento della temperatura di ebollizione ma è inferiore a quella di HF dove l’aggregazione è elevata.
Il neon Ne è uno dei gas nobili, presente nell’aria ed il liquido ha un bassissimo punto di ebollizione (−246 °C) 27K° e si ottiene dalle frazioni più leggere distillando l’aria totalmente liquefatta.
L’ idrogeno H2 ha un punto di ebollizione di 20,27 K ( -252,7 °C) quindi iferiore al neon .
Pertanto l’ordine di ebollizione crescente è B cioè
H2 < Ne < CO < HF < BaCl2
50. Due soluzioni di KI e di zucchero da tavola (saccarosio) di uguale concentrazione 1,00 ·10-2 M
hanno i valori delle pressioni osmotiche rispettivamente 4,65 ·10-1 atme 2,45 ·10-1 atm, alla stessa temperatura. Ciò permette di calcolare il coefficiente di van’t Hoff per la soluzione di ioduro come uguale a:
A) 1,90
B) 3,80
C) 9,50 ·10-1
D) 3,40
soluzione
La pressione osmotica è una proprietà colligativa associata alle soluzioni. Quando due soluzioni con lo stesso solvente ma a concentrazioni diverse sono separate da una membrana semipermeabile, le molecole di solvente si spostano dalla soluzione meno concentrata alla soluzione più concentrata in modo da uguagliare la concentrazione delle due soluzioni.
La pressione che occorre applicare alla soluzione affinché il passaggio del solvente non avvenga è detta appunto “pressione osmotica”.
Il meccanismo con il quale si manifesta la pressione osmotica può essere interpretato considerando anzitutto che le particelle di un soluto tendono a disperdersi uniformemente nel solvente, anche contro la gravità, così come quelle di un gas tendono a occupare tutto lo spazio a loro disposizione: le particelle di soluto esercitano perciò una pressione analoga alla pressione gassosa.
Se poi si considera un sistema costituito da una soluzione e dal relativo solvente puro separati da una membrana semipermeabile, il numero delle molecole di solvente che nell’unità di tempo attraversano la membrana verso la soluzione è superiore al numero di molecole di solvente che la attraversano in senso opposto, perché nel primo caso le molecole che vengono a contatto con la membrana sono tutte di solvente, nel secondo caso invece si ha una certa percentuale di particelle di soluto, che non passano ma che esercitano comunque con i loro urti sulla membrana una pressione, appunto la pressione osmotica.
Questa non è direttamente misurabile, mentre è misurabile la pressione idrostatica che si determina nella soluzione a causa del maggior numero di molecole di solvente che vi penetrano rispetto a quelle che ne escono.
W.P.F.Pfeffer e Jacobus Henricus van ‘t Hoff hanno verificato leggi, parallele a quelle dei gas, che esprimono l’andamento della pressione osmotica in funzione della concentrazione e della temperatura; queste leggi si compendiano in una relazione del tutto simile all’equazione di stato dei gas perfetti:
πV= nRT
dove π è la pressione osmotica, V il volume della soluzione, T la temperatura assoluta e R una costante che ha lo stesso valore della costante dei gas (0,0821 atm l/mol K).
Indipendentemente dalla natura del soluto, soluzioni aventi la stessa concentrazione hanno medesima pressione osmotica e si dicono isotoniche; tra soluzioni a diversa concentrazione si dicono ipertoniche le più concentrate, ipotoniche quelle a più bassa concentrazione. La pressione osmotica dei liquidi cellulari e intercellulari svolge un ruolo molto importante per gli esseri viventi, e il suo valore, come quello di altre costanti chimico-fisiche relative all’ambiente interno degli organismi, non può variare oltre certi limiti senza compromettere la funzionalità e la sopravvivenza stessa delle cellule.
L’osmosi inversa è una importante applicazione moderna dei principi dell’osmosi nei processi di purificazione o dissalazione delle acque, o per la concentrazione a freddo di soluzioni acquose.
Pertanto nel caso specifico del quesito
π1 = n1/V RT x i π2 =n2/V RT
ma n/V =moli /litro cioè n/V = Concentrazione e quindi
essendo n1/V=n2/V =1,00 ·10-2 M si ha π1 /π2 = 1,02 x 10-2 x 0,0821 x T x i / 1,02 x o,o821 T
e semplificando π1 /π2 = i pertanto
4,65 ·10-1 / 2,45 ·10-1 = i
i= coefficiente di van’t Hoff = 1,897 cioè
i = 1,9
risposta corretta A
51. Nell’ultimo cinquantennio il benzene viene ottenuto, quasi esclusivamente, dal petrolio, con un processo (catalytic reforming) che trasforma in parte una miscela di idrocarburi alifatici in una miscela contenente anche benzene e toluene. Questi vengono quindi separarti prima per dissoluzione in glicole dietilenico (HOCH2CH2OCH2CH2OH), quindi per distillazione frazionata da esso. Ciò è possibile perché:
A) il glicole dietilenico ha un elevato punto di ebollizione e scioglie gli idrocarburi alifatici e non gli aromatici
B) il glicole dietilenico ha un elevato punto di ebollizione e scioglie gli idrocarburi aromatici ma non gli alifatici in quanto induce negli anelli aromatici una polarizzazione
C) il glicole dietilenico ha un basso punto di ebollizione e forma legami a ponte di idrogeno con gli idrocarburi alifatici, più ricchi di idrogeno,sciogliendoli
D) il benzene e il toluene si sciolgono in glicole perché formano un sale interno
soluzione
sappiamo che benzene e toluene, a temperatura ambiente, si trovano allo stato liquido e sono facilmente miscibili. Se una miscela di benzene e toluene viene sottoposta a distillazione, il vapore che si forma contiene una percentuale maggiore del componente più volatile, cioè quello che ha la temperatura di ebollizione minore. Benzene e toluene però, vengono sottoposti a distillazione frazionata dopo reazione con glicol dietilenico che con i due composti forma un sale interno e quindi per distillazione la separazione tra benzene e toluene è più efficace ed il benzene si ottiene con solamente una piccola quantità di toluene.
52. Nel processo detto catalytic reforming, il benzene, alla fine, viene recuperato per distillazione da una miscela con dietilen glicole che contiene come impurezza toluene. Se la tensione di vapore del benzene puro, del toluene e del glicole dietilenico sono nell’ordine 369 mm Hg, 149 mm Hg e 1,70 ·10-1 mm Hg rispettivamente, a 65 °C, calcolare la percentuale in massa di toluene nel distillato quando la pressione di vapore del liquido è di 368 mm Hg. Nel calcolo si può trascurare la frazione molare del glicole avendo esso una tensione di vapore molto più bassa.
A) 6,0 ·10-1 %
B) 9,4 %
C) 3,0 %
D) 2,0 ·10-1 %
La distillazione viene usata per separare i componenti di una miscela omogenea, ovvero per arricchire la miscela di uno dei suoi componenti. La distillazione si basa sul fatto che portando una miscela liquida, ad esempio binaria cioè A+B , al suo punto di ebollizione, il componente più volatile passa alla fase vapore in quantità maggiore di quello meno volatile; si ottengono quindi due miscele, una nella fase vapore più ricca del componente più volatile, l’altra nella fase liquida più ricca del componente meno volatile. Ripetendo in maniera opportuna questa operazione è possibile ottenere una miscela con la concentrazione dei componenti desiderata.
Siano A e B dell’esempio perfettamente solubili in equilibrio con la fase vapore e sia il componente A il più volatile. Ad una certa temperatura T ciascun componente, considerato separatamente, è caratterizzato da una tensione di vapore Px A > PxB .
Considerando invece la miscela, risultano definite le tensioni parziali di vapore saturo relative ai due componenti (PA)sol e (PB)sol, date dalla legge di Raoult:
(Pi)sol = xiPi
con i = A, B, ed essendo xA e xB le concentrazioni dei componenti nella fase liquida.
In conseguenza della legge di Dalton la tensione di vapore P della miscela è la somma delle tensioni di vapore saturo parziali relative ai componenti:
P = xAPA + xBPB = xAPA + (1 − xA) PB
Dalla definizione stessa di pressione parziale in una miscela gassosa (la fase vapore in equilibrio con il liquido), si possono ricavare le frazioni molari (cioè la composizione) della fase vapore (yA,yB):
YA =( PA)sol/P YA = xAPA/P
YB = (PB)sol /P YB = XB PB / P = (1 − xA) PB /P = 1 – YA
xA =P − PB / PA − PB
53. Il seguente equilibrio, a 800 °C, CaCO3 (s) → CaO (s) + CO2 (g) mostra una pressione di CO2 = 0,236 atm. Per esso si deducono le seguenti Kp e Kc alla stessa temperatura:
A) Kp = 2,00 e Kc = 2,68 ·10-3
B) Kp = 2,36 ·10-1 e Kc = 2,68 ·10-3
C) Kp = 2,68 ·10-3 e Kc = 2,36 ·10-1
D) Kp = Kc = 2,36 ·10-1
soluzione
la relazione tra Kp e Kc possiamo ottenerla considerando una generica reazione
a A + b B = c C
abbiamo quindi
P(A) = nA/VRT = [A]RT
P(B) =nB/VRT = [B]RT
P(C) =nC/VRT = [C]RT
pertanto la costante di equilibrio della reazione Kp è :
Kp = P(C)c / P(A)a *P(B)b
Kp = [C]c(RT)c / [A]a *(RT)a x [B]b (RT)b
Kp = [C]c /[A]a [B]b (RT)a /(RT)b x (RT)c
Kp = Kc (RT) c-(a+b) ponendo c-(a+b)=Δn
Kp = Kc (RT)Δn
Kc = Kp/(RT)Δn
nel caso del quesito la pressione totale coincide con la pressione parziale della CO2 unico gas presente, quindi la costante di equilibrio coincide con Kp tenendo presente che gli altri composti si trovano allo stato solido.
Si deduce che Kc = Kp/(RT)Δn
essendo Δn =2-1 =1
Kc=0,236/0,0821 x (800 +273) = 2,68 ·10-3
54. Se si considera la reazione di formazione dell’ammoniaca da H2 e N2, si possono scrivere le tre equazioni di equilibrio:
a) N2(g) + 3 H2(g) → 2 NH3(g)
b) 1/2 N2(g) + 3/2 H2(g) → NH3(g)
c) 1/3 N2(g) + H2(g) → 2/3 NH3(g)
per le quali:
A) si ricava la stessa costante di equilibrio essendo la reazione la stessa
B) si ricavano tre costanti d’equilibrio: Ka= Kb2= Kc3
C) Ka = Kb = Kc purché la T sia costante, infatti la costante di equilibrio dipende solo dalla T
D) per calcolare la costante di equilibrio, non è necessario bilanciare l’equazione di reazione essendo l’equilibrio indipendente, la Kp è unica.
soluzione
applichiamo la legge di Gouldeberg-Waage ai 3 equilibri ed abbiamo:
Ka= [NH3]2 / [N2] [H2]3
Kb= [NH3] / [N2]½ [H2]3/2
Kc = [NH3]2/3 / [N2]1/3 [H2]
è evidente che se eleviamo al quadrato Kb otteniamo Ka e se eleviamo al cubo Kc si ottiene sempre Ka pertanto possiamo scrivere che Ka=Kb2 = Kc3
risposta corretta B
55. Una cella elettrochimica è formata da un elettrodo d’oro (5,00 g) immerso in una soluzione
di un sale d’oro(III) avente M = 1,50 ·10-1 e da unelettrodo inerte immerso in una soluzione acquosa acida di perossido di idrogeno (0,5 dm3 ; 2,50 M).
Considerando un rendimento dell’85%, tale cella può erogare una quantità di elettricità totale pari a coulomb:
(Au3+(aq)/Au = 1,42 V; H2O2 (aq)/H2O = 1,78 V)
A) 3,07 ·105 C
B) 6,25 ·103 C
C) 3,11 ·102 C
D) 1,12 ·103 C
soluzione


